- Introduction
- Matériaux et méthodes
- Équipements et systèmes de contrôle
- Le système TPD
- Préparation de l’échantillon
- Procédure expérimentale
- Evacuation
- Analyse des gaz résiduels
- Refroidissement
- Adsorption
- Desorption
- Molécules adsorbées
- Résultats et discussion
- Empreinte de la désorption/décomposition de la cellulose
- TPD-Spectra
- désorption du n-décane
- Désorption du méthanol deutéré
- Conclusions
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
- Matériel supplémentaire
Introduction
La discussion sur les avantages par rapport au coût environnemental des matériaux d’emballage est constante. À l’heure où la conscience environnementale ne cesse de croître, les clients récompensent souvent le fait de » passer au vert » et le papier occupe assurément une place de choix dans ce domaine.
Cependant, pour être utilisé comme matériau d’emballage pour les aliments, le papier doit répondre à un certain nombre d’exigences. D’une part, les molécules d’arôme doivent rester à l’intérieur de l’aliment et d’autre part, l’emballage est mis en place pour protéger l’aliment des influences environnementales comme l’oxygène ou les molécules organiques qui pourraient déclencher le mûrissement ou produire des saveurs pourries. Le papier étant un matériau poreux, l’une de ses principales caractéristiques est le transport des molécules à travers la structure poreuse afin de mieux comprendre et contrôler les problèmes susmentionnés. L’une des questions auxquelles il faut répondre dans ce contexte est de savoir dans quelle mesure les molécules s’adsorbent sur les parois des pores. Cela rend les études d’adsorption des molécules sur les surfaces cellulosiques d’autant plus essentielles.
La recherche documentaire révèle un nombre substantiel d’études sur les matériaux cellulosiques à l’état humide pour éliminer les polluants de l’eau (voir par exemple, Voisin et al., 2017). De même, l’adsorption de polyélectrolytes sur les pâtes à papier a fait l’objet de recherches intenses (voir par exemple Li et al., 2003 ; Neumann et al., 2018). L’adsorption de molécules plus petites a attiré moins d’attention comme l’a prouvé une revue récente (Lombardo et Thielemans, 2019). L’adsorption de composés aromatiques sur la cellulose a été étudiée par Perez et al. (2004). L’adsorption de la benzophénone a été étudiée par Mazeau et Vergelati (2002) et celle du rouge Congo par Mazeau et Wyszomirski (2012). L’adsorption de la naphtaline et du pyrène a été étudiée par Tozuka et al. (1998, 2002). L’adsorption de l’urée a été étudiée par Chen et al. (2017), pour ne citer que quelques exemples. Cependant, ces articles ne sont pas pertinents pour le domaine des emballages alimentaires. Nous étudions donc spécifiquement l’adsorption de petites molécules de la phase gazeuse sur des surfaces cellulosiques. Dans ce contexte, la sorption dynamique de vapeur a été largement étudiée (voir par exemple, Xie et al., 2011). Habituellement, ces études ont lieu dans des conditions d’équilibre. Lorsque l’adsorption de petites molécules se produit dans un emballage en papier, il est peu probable que les conditions d’équilibre s’appliquent. Nous proposons plutôt d’étudier l’adsorption de petites molécules dans des conditions de vide poussé, loin de l’équilibre. Malheureusement, de telles mesures sont impossibles en utilisant des échantillons de papier, car le papier ne peut pas être chauffé directement dans une chambre à vide. C’est pourquoi nous devons utiliser un système modèle, dans notre cas des films minces de cellulose. Malgré le fait que ces films minces de cellulose sont produits à partir de cellulose II au lieu de cellulose I, que l’on trouve dans le papier, il a été démontré que ces films sont un système modèle de remplacement utile pour le papier (Rohm et al., 2014). Les films minces de cellulose ont également été utilisés auparavant comme substrats pour l’adsorption d’eau (voir par exemple Niinivaara et al., 2015, 2016 ; Hakalahti et al., 2017) et l’adsorption de sucre (Hoja et al, 2014).
Dans cette étude, nous présentons les premières études d’adsorption sous vide poussé et de spectroscopie de désorption programmée en température du n-décane et du méthanol deutéré sur des films minces de cellulose.
Matériaux et méthodes
Équipements et systèmes de contrôle
– Pompe à palettes:
Leybold TRIVAC D 25 B
– Pompe turbo moléculaire & système de contrôle:
Oerlikon Leybold Vacuum, Turbovac type TMP151 & Turbo.Drive TD20 classic
– Spectromètre de masse quadripolaire & logiciel de contrôle:
Balzers Prisma type QME 200 (CF DN40) & Quadstar 32-Bit
– Alimentation électrique :
Système d’alimentation en courant continu HP 6261B
– Système de contrôle de la température
Contrôleur PID (Proportionnel-Intégral-Dérivé) dans National Instruments LabVIEW 7.0
– Système de contrôle de la jauge Bayard-Alpert & :
Leybold AG IE 414 (CF DN40) & IONIVAC IM 520
– Valve d’angle manuelle
Balzers EVA 025 H (KF DN25)
– Valve d’admission de gaz
Pfeiffer Valve de dosage de gaz sous vide EVN 116 (KF DN16)
– Connecteur métal-verre condamné :
GMA-KF16-KGD-152-TD13 (KF DN16).
Le système TPD
La chambre à vide principale est un croisement à six voies en acier inoxydable. Le système de pompage est constitué d’une pompe turbo moléculaire, fixée sur le côté inférieur de la chambre principale (voir figure 1), suivie d’une pompe à palettes non représentée sur la figure 1. Le spectromètre de masse quadripolaire et la jauge Bayard-Alpert sont montés sur le côté gauche et sur le côté droit de la chambre. La valve d’entrée de gaz est fixée sur le côté arrière et connectée à un récipient en verre contenant les molécules organiques liquides (voir Figure 1 vue arrière).
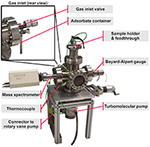
Figure 1. Système TPD, vue d’ensemble.
Le côté supérieur du croisement à six voies est prolongé par un adaptateur à un couvercle de bride CF DN63, qui est fixé par une chaîne de serrage rapide CF permettant un changement d’échantillon plus rapide. Le couvercle à bride offre deux passages électriques et un passage pour thermocouple, ainsi qu’un trou dans le corps en cuivre du doigt de refroidissement. Le doigt de refroidissement, une pièce cylindrique creuse en cuivre, est monté sur le côté intérieur de ce couvercle à bride, s’étendant vers le bas jusqu’au centre de la chambre, se fondant dans une pièce d’extrémité aplatie, appelée plus tard « porte-échantillon » (figure 2). Deux bancs de maintien des échantillons sont fixés à cette plate-forme isolée par des entretoises en oxyde d’aluminium, qui assurent l’isolation électrique et la conduction thermique.

Figure 2. Porte-échantillon du système TPD, vue de dessus et vue latérale.
Le substrat d’échantillon lui-même est une plaque d’acier inoxydable de 1 × 1 cm avec deux fils Ta pour le chauffage par résistance et un thermocouple de type K, soudé par points sur sa face arrière. Le substrat est monté en serrant les fils chauffants dans les bancs de maintien de l’échantillon, qui sont reliés à la traversée électrique par des câbles en cuivre.
Dans la section centrale, le doigt de refroidissement contient également deux mini-connecteurs de thermocouple en oxyde d’aluminium, qui sont branchés ensemble. Alors que le mini-connecteur supérieur est câblé en permanence à la traversée de thermocouple du couvercle de la bride, le connecteur inférieur agit comme une planche de serrage pour les fils de thermocouple provenant de l’arrière de l’échantillon (voir la figure 2).
Afin d’augmenter le flux de gaz vers la surface de l’échantillon, un tuyau d’entrée de gaz, qui est connecté à la vanne d’entrée de gaz (voir la figure 3), pointe vers la surface de l’échantillon à un angle d’environ 35° et se termine à une distance d’environ 3 cm de la surface de l’échantillon. Le spectromètre de masse est positionné exactement à l’opposé de la surface de l’échantillon à la même distance.

Figure 3. Géométrie intérieure de la chambre à vide.
Préparation de l’échantillon
L’échantillon est préparé selon la même procédure standard que celle proposée par Kontturi et al. (2003) et Rohm et al. (2014), le substrat étant recouvert d’un mince film de cellulose. La cellulose en question est de la triméthylsilylcellulose (TMSC) avec un degré de substitution d’environ 2,8 (Thüringisches Institut für Textil-und Kunstoff-Forschung e.V. (TITK), Allemagne) et dissoute dans du toluène avec une concentration d’environ 1 mg/ml. La solution obtenue est coulée en gouttes sur la surface métallique polie de l’échantillon et séchée à l’air. Ensuite, une goutte de HCl à 10% est placée dans une boîte de Pétri et l’échantillon est placé juste à côté de la goutte de HCl. Le plat, y compris le montage de l’échantillon, est ensuite recouvert d’une feuille d’aluminium et laissé réagir pendant 15 min.
Selon Konturri et Djak, cette procédure permet d’obtenir un film de cellulose entièrement régénéré d’une épaisseur d’environ 50 nm (Kontturi et al., 2003 ; Djak et al., 2011). Les mesures FTIR des films n’ont pas trouvé de vibrations induites par le triméthylsilyle dans les films de cellulose pure. Une masse 73 a cependant été trouvée lors de la désorption thermique qui pourrait correspondre au fragment triméthylsilyle. La quantité de TMSC résiduel est donc inférieure à la limite de détection de l’IRTF (~1 × 1013 molécules) et supérieure à la limite de détection de la spectroscopie de masse. L’épaisseur du film de plusieurs autres échantillons a également été mesurée par AFM. Par la suite, ces échantillons AFM n’ont plus été utilisés pour les expériences de désorption afin d’éviter l’influence des rayures causées par les mesures d’épaisseur AFM sur le comportement de désorption.
Les films sont complètement amorphes ; c’est pourquoi nous ne nous attendons pas à y voir une structure poreuse. Au cours des investigations AFM de tels films (Ganser et al., 2014, 2016 ; Rohm et al., 2014), aucune indication de pores n’a été trouvée. Cela indique que la densité devrait être proche de celle de la cellulose régénérée. Néanmoins, la porosité et la densité des films n’ont pas été mesurées dans le cadre de cette étude.
Procédure expérimentale
Evacuation
L’échantillon est monté dans les bancs de maintien de l’échantillon et le thermocouple est connecté (voir ci-dessus). Le porte-échantillon est inséré dans la chambre à vide et le contrôle de la température est lancé. Le couvercle de la bride est fixé par la chaîne de serrage rapide CF et la chambre à vide est évacuée à la pression de base d’environ 5 × 10-9 mbar. En raison des filaments du spectromètre de masse et de la jauge Bayard-Alpert, la température de l’échantillon à l’intérieur de la chambre à vide se stabilise à 55°C pendant que l’évacuation est effectuée.
Analyse des gaz résiduels
Une analyse des gaz résiduels est effectuée en enregistrant un spectre de masse de la masse 1 à la masse 100 (un tel spectre de masse est présenté dans les informations complémentaires (figure 1 du SI) pour l’évaluation des conditions de départ et de la qualité du vide.
Refroidissement
De l’azote liquide (N2(l)) est maintenant rempli dans le doigt de refroidissement de manière répétée. Une fois que la température de base préréglée de l’échantillon (-80°C) est atteinte, elle est maintenue par un chauffage par résistance modéré, contrôlé par PID (Proportionnel-Intégral-Dérivé) et un refroidissement supplémentaire par N2(l) si nécessaire.
Adsorption
La vanne d’entrée de gaz est maintenant ouverte avec précaution. En raison de la pression de vapeur à température ambiante des molécules organiques à l’intérieur du récipient d’adsorbat, la vapeur est dosée dans la chambre à vide. L’échantillon est maintenu à -80°C pendant l’adsorption. La vanne est ajustée jusqu’à ce que l’entrée des molécules organiques gazeuses et le pompage de la pompe turbo moléculaire se stabilisent à une pression de 5 × 10-6 mbar. Cette pression est ensuite maintenue pendant un temps d’adsorption spécifié de 6 minutes. Après ce temps, la vanne d’entrée de gaz est fermée rapidement, et la pression de la chambre revient à la pression de base.
Desorption
Il faut environ 1 min pour atteindre la pression de base et le processus de désorption thermique est lancé à partir de -80°C. Le contrôleur PID chauffe l’échantillon avec une vitesse de chauffage de 1°C/s jusqu’à la limite supérieure de température de 600°C. Pendant la désorption, les signaux d’intensité des masses prédéfinies sont enregistrés en continu et en fonction du temps par le spectromètre de masse. En même temps, la température de l’échantillon est enregistrée en fonction du temps. L’intensité de chaque masse est ensuite représentée en fonction de la température. Ceci représente une configuration assez typique pour les mesures TPD (voir par exemple Hohenegger et al., 1998).
Comme seul un nombre limité d’intensités de masse peut être enregistré dans une rangée, chaque masse représente un fragment caractéristique d’une molécule participante : masse 57 pour le n-décane, masse 34 pour le méthanol deutéré (D3COD), masse 44 pour le CO2, et masse 18 pour H2O. Alors que les deux premières masses sont caractéristiques de l’espèce adsorbée, les deux dernières sont caractéristiques de la désorption de la cellulose.
Molécules adsorbées
Les molécules aromatiques sont généralement des molécules organiques ayant une pression de vapeur assez élevée. On peut rencontrer des molécules d’arômes polaires et non polaires. Pour avoir une première idée du comportement d’adsorption de telles molécules sur un film mince de cellulose, nous avons utilisé du n-décane comme molécule non-polaire et du méthanol deutéré (D3COD) comme molécule polaire. Ces deux molécules ont été obtenues en grade p.a. auprès de Sigma Aldrich (méthanol deutéré ≥99%, pureté isotopique ≥99,8 % atomique D, n-décane ≥99,5 %) et ont été nettoyées in situ via plusieurs cycles de congélation et décongélation. La masse moléculaire du n-décane est de 142 amu et la pression de vapeur à 30°C est de 3,17 hPa, ce qui s’est avéré suffisant pour l’adsorption. Comme le spectromètre de masse quadripolaire utilisé a une masse maximale de 100 amu, nous avons dû chercher la masse 57 pour le n-décane. En fin de compte, il s’agissait également du pic le plus élevé dans le spectre de masse du n-décane. La masse 57 est également d’une intensité plutôt faible dans le spectre de masse du film de cellulose désorbant. Le spectre de masse du n-décane se trouve dans les informations complémentaires (SI Figure 2). Le spectre de masse du n-décane est resté inchangé au fil du temps et ne montre aucun signe de contamination par des hydrocarbures inférieurs. Néanmoins, des traces de contamination par le nonane et l’octane ne peuvent être complètement exclues.
La masse moléculaire du méthanol deutéré est de 36 amu. Le pic le plus élevé dans le spectre de masse du méthanol deutéré est à 34 amu. Dans nos mesures TPD, nous avons utilisé cette masse comme indicateur car elle n’interfère pas avec le spectre de masse du film de cellulose désorbant ni avec le n-décane. Le spectre de masse du méthanol deutéré pendant l’exposition se trouve également dans les informations complémentaires (SI Figure 3). La pression de vapeur du méthanol deutéré à 20°C est de 129 hPa.
Résultats et discussion
Les molécules exposées ne s’adsorbent pas seulement sur le film de cellulose, car l’adsorption se fait via la phase gazeuse. Par conséquent, une série d’expériences en aveugle a été réalisée pour s’assurer que les effets constatés proviennent uniquement des films de cellulose. Dans le régime aveugle, les films de substrat propres avec et sans adsorption de n-décane et de méthanol deutéré ont été testés. Ces trois expériences montrent clairement des pics de désorption différents de ceux présentés ici. Sans adsorption préalable de gaz sur les films de cellulose on trouve (voir figure 4) plusieurs fragments se désorbant dans la même gamme de température comme le montrent les spectres TPD ci-dessous.
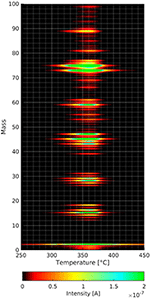
Figure 4. Spectres de masse en fonction de la température de la décomposition et de la désorption du film de cellulose. Les intensités des différentes masses sont liées au code couleur.
Empreinte de la désorption/décomposition de la cellulose
La figure 4 montre le résultat d’une expérience de TPD avec un film de cellulose sans adsorption préalable de gaz. Dans le tracé tridimensionnel, on peut voir que l’intensité maximale des fragments de désorption de la cellulose se produit à environ 360°C. Il s’agit d’une température inférieure à celles des autres spectres TPD présentés plus loin. La vitesse de chauffage dans l’expérience susmentionnée n’est que de 0,1°C/s, contre 1°C/s dans toutes les autres expériences. La vitesse de chauffage plus faible est devenue nécessaire car l’acquisition d’un spectre de masse complet de 0 à 100 amu prend beaucoup plus de temps que les 4 masses individuelles dans les autres expériences présentées plus loin.
On peut voir sur la figure 4 que la masse 18 et la masse 44 se désorbent toutes deux pendant la décomposition et la désorption de la cellulose. Les pics de désorption les plus intenses sont aux masses 73 et 75 amu. Bien que le pic à la masse 73 corresponde au groupe triméthylsilyle, on ne peut pas expliquer la masse 75 par ce groupe car l’isotope Si de masse 30 n’est présent qu’à environ 3%. Dans ce contexte, la masse 75 pourrait également provenir de la fragmentation d’espèces plus grandes que nous ne sommes pas en mesure de détecter en raison de la limitation de la masse (masse 100) du spectromètre de masse utilisé. On peut voir plusieurs groupes de masses avec une distance d’environ 10 amu, ce qui est une caractéristique commune des spectres de masse des molécules organiques. Néanmoins, il faut bien réfléchir aux masses à suivre lors des expériences de désorption thermique des films de cellulose. Cela permet de distinguer l’espèce adsorbée du film de cellulose en décomposition/désorption. Nous avons choisi la masse 57 pour le n-décane car ce pic est le plus petit des pics de la cellulose pouvant être utilisé pour le n-décane. Le méthanol deutéré a été employé, car son pic de masse le plus élevé de 34 amu n’est pas détecté dans le spectre de désorption du film de cellulose.
Nous avons également noté dans les expériences préliminaires que le chauffage à 150°C entraînait un changement marqué dans les films de cellulose minces, montré par un changement significatif dans le début des spectres TPD après des mesures répétées sur le même film (voir SI Figure 4). Dans ce travail, nous présentons uniquement les données obtenues avec un film mince de cellulose vierge. La désorption des films de cellulose est terminée à environ 600°C. Avec le temps, nous avons constaté une accumulation d’un résidu de carbone sur le substrat, qui a été enlevé en polissant la surface avant la formation du film.
TPD-Spectra
L’interprétation des spectres TPD en science des surfaces suit le principe de l’équilibre microscopique. Une espèce adsorbante empruntera donc le même chemin pendant l’adsorption et la désorption. En conclusion inverse, on peut apprendre quelque chose sur le processus d’adsorption à partir des expériences de désorption (Somorjai, 1981). Il a été démontré que la forme du pic de désorption d’une expérience TPD a une forme caractéristique pour la désorption d’une multicouche pour la désorption moléculaire et pour l’adsorption dissociative (Somorjai, 1981). Redhead a proposé une méthode simplifiée pour calculer l’énergie d’adsorption à partir de la température au maximum du pic d’un spectre de désorption thermique (Redhead, 1962). Dans ce travail, nous rapportons les énergies d’adsorption pour les espèces adsorbées calculées selon la formule de Redhead. Dans tous les cas, il faut garder à l’esprit que cette méthode était à l’origine destinée à l’adsorption de molécules simples comme CO ou H2. Les circonstances dans lesquelles la méthode de Redhead s’applique également aux molécules organiques n’ont pas encore été étudiées. En fin de compte, les valeurs fournissent au moins une idée de l’énergie d’adsorption. Des énergies d’adsorption différentes sont généralement liées à des sites d’adsorption différents sur la surface. Cette connexion est utilisée tout au long de cet article.
désorption du n-décane
La forme asymétrique du pic avec le bord arrière abrupt du pic de désorption comme le démontre la figure 5 est un signe clair que le n-décane se désorbe d’une multicouche qui a été adsorbée à -80°C. La multicouche se désorbe entre environ -70 et -52°C avec une énergie d’adsorption d’environ 60 kJ/mol. Cette valeur se situe juste entre la chaleur de vaporisation de 56 kJ/mol à -15°C (Carruth et Kobayashi, 1973) et 77 kJ/mol obtenue par extrapolation des données de Majer et Scoboda (1985) à -70°C. Ceci suggère que ce pic de désorption provient d’une multicouche à la surface. Dans la même plage de température, on peut également observer une certaine désorption du CO2, qui provient très probablement de l’adsorption du gaz résiduel pendant le refroidissement et pendant l’adsorption du n-décane. Un examen plus approfondi de la même plage de température montre également un pic de désorption de l’eau (voir la figure 6).
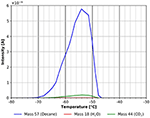
Figure 5. Désorption du n-décane (masse 57, bleu), du dioxyde de carbone (masse 44, vert) et de l’eau (masse 18, rouge) entre -80 et -30°C.
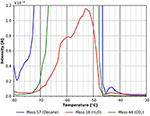
Figure 6. Zoom sur le spectre TPD présenté à la figure 5. n-décane (masse 57, bleu), dioxyde de carbone (masse 44, vert) et eau (masse 18, rouge).
Le pic de désorption de l’eau observé dans la plage de température comprise entre -80 et environ -52°C est très probablement dû à l’adsorption d’eau à partir du gaz résiduel pendant le refroidissement et l’exposition au gaz. Il pourrait également provenir en partie de l’eau résiduelle dans le film de cellulose. Pour minimiser ce dernier effet, les expériences présentées ici n’ont été lancées que lorsqu’une pression de fond d’environ 5 ×10-9 mbar a été atteinte. L’influence de la pression de fond avant l’adsorption est illustrée dans les informations complémentaires (figure 5 du SI). La figure 6 montre également une autre caractéristique de désorption à partir du n-décane et de l’eau avec un maximum à environ -43°C. Même si ce pic est petit, veuillez noter que toutes les figures sont dérivées directement des données brutes sans aucun lissage. Pour cette raison, tous les pics discutés dans cet article montrent un bon rapport signal/bruit et toutes les caractéristiques discutées ont été reproduites expérimentalement plusieurs fois.
Cette caractéristique est montrée plus en détail dans la figure 7. Le pic de désorption à environ -43°C suggère clairement une espèce de n-décane plus fortement liée. En utilisant la formule de Redhead, cela correspond à une énergie de liaison d’environ 70 kJ/mol. Un petit pic de CO2 et d’eau est clairement visible dans la figure 7 toujours, indiquant que ces espèces trouvent des sites d’adsorption similaires sur la surface de la cellulose.
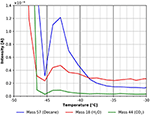
Figure 7. Zoom sur le spectre TPD présenté à la figure 6. n-décane (masse 57, bleu), dioxyde de carbone (masse 44, vert) et eau (masse 18, rouge).
En allant vers des températures plus élevées, on trouve une petite et large caractéristique de désorption du n-décane entre environ -40 et +14°C (voir figure 8) correspondant à une énergie d’adsorption d’environ 160 kJ/mol. Cette caractéristique n’est pas présente dans la trace de désorption du CO2, et n’est pas clairement visible dans la trace de désorption de l’eau. La raison de la diffusion plus élevée dans les données de la figure 8 pourrait avoir été causée par une vitesse de chauffage qui n’était pas parfaitement linéaire dans cette plage de température.
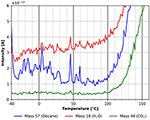
Figure 8. Désorption du n-décane (masse 57, bleu), du dioxyde de carbone (masse 44, vert) et de l’eau (masse 18, rouge) dans la gamme de température comprise entre -40 et +160°C.
La figure 8 montre également que les trois espèces commencent à se désorber à des températures de début différentes d’environ 80°C pour l’eau, 95°C pour le n-décane et 100°C pour le CO2. C’est également le début de la désorption/dégradation du film de cellulose, comme on peut le voir sur la figure 8. Une autre indication forte que le film de cellulose subit des changements significatifs pendant le chauffage peut être vue dans la différence entre le début de la désorption après des cycles répétés d’adsorption et de désorption sans préparation d’un nouveau film montré dans les informations complémentaires (SI Figure 4).
Le plus grand pic de désorption dans la Figure 9 est le pic de CO2 suivi par le pic d’eau. De manière surprenante, une désorption significative du n-décane est encore visible. Ce pic peut également provenir en partie de la décomposition/désorption du film de cellulose. Malheureusement, ces deux possibilités ne peuvent pas être distinguées l’une de l’autre à l’heure actuelle. Comme mentionné ci-dessus, un fragment à la masse 57 est visible sur la figure 4. Il existe probablement un 4ème site d’adsorption pour le n-décane avec une énergie de liaison d’environ 180 kJ/mol. La dégradation de la cellulose a également lieu à peu près dans la même plage de température. Ces résultats montrent que les molécules non polaires s’adsorbent facilement sur les surfaces de cellulose à température ambiante et plus.
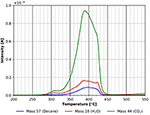
Figure 9. Désorption du n-décane (masse 57, bleu), du dioxyde de carbone (masse 44, vert) et de l’eau (masse 18, rouge) dans la plage de température comprise entre 200 et 550°C.
Une comparaison des figures 9 et 10 montre que la désorption finale de toutes les espèces est influencée par les molécules adsorbées. Dans le cas de l’adsorption du n-décane, trois pics de désorption différents pour les trois espèces étudiées peuvent être visualisés sur la figure 9. Pour le méthanol deutéré, un seul pic est observé dans la même région de température (Figure 10). Ceci suggère, que les espèces adsorbées ont bien une influence sur la décomposition et la désorption de la cellulose.
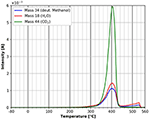
Figure 10. Désorption du méthanol deutéré (masse 34, bleu), du dioxyde de carbone (masse 44, vert) et de l’eau (masse 18, rouge) dans la gamme de température entre -80 et 560°C.
Désorption du méthanol deutéré
La figure 10 montre le spectre TPD du méthanol deutéré sur toute la gamme de température. De toute évidence, les pics à basse température sont absents dans ce cas. Ceci est un indicateur fort que le méthanol polaire deutéré est plus fortement lié pendant l’adsorption que le n-décane. Néanmoins, l’énergie d’adsorption selon l’équation de Redhead est également d’environ 180 kJ/mol. Il est clair qu’il faut garder à l’esprit que le pic de désorption de la masse 57 dans le cas du n-décane chevauche la masse 57 provenant de la désorption/décomposition de la cellulose, ce qui n’est pas le cas dans la désorption du méthanol deutéré. Toute la désorption de la masse 57 a lieu à des températures plus basses et donc les énergies d’adsorption plus basses sont complètement absentes dans le cas du méthanol deutéré. De plus, il semble y avoir une influence marquée de la principale molécule adsorbée sur l’adsorption de l’eau et du CO2 du gaz résiduel. L’influence du méthanol deutéré sur le film de cellulose lui-même est visible au niveau du pic principal à 400°C. Contrairement au cas du n-décane, il n’y a pas d’épaulement dans le pic de dégradation/désorption après l’adsorption du méthanol deutéré. Après l’adsorption du méthanol deutéré, le petit pic apparaissant à environ 310°C après l’adsorption du n-décane est absent, ainsi que les épaulements du pic principal de désorption. Nous pouvons également détecter une petite désorption supplémentaire des trois espèces à environ 550°C, qui n’a pas été observée après l’adsorption du n-décane. Malheureusement, à cette température, un artefact du porte-échantillon en cuivre ne peut être complètement exclu.
Les résultats présentés dans les figures 9, 10 montrent que l’adsorption de molécules polaires a une forte influence sur les films minces de cellulose, car les spectres de désorption sont significativement différents.
La figure 11 montre plus en détail le point de départ des spectres TPD après l’adsorption de méthanol deutéré. La désorption de l’eau commence à environ -60°C. Les fluctuations de la désorption de l’eau dans cette gamme de température sont très probablement dues à de petites fluctuations dans le taux de chauffage linéaire. Il est intéressant de constater que la désorption du méthanol deutéré commence à une température d’environ +40°C. Cette différence dans les points de départ de la désorption entre l’eau et le méthanol deutéré peut être attribuée à des sites d’adsorption différents. Apparemment, le méthanol est plus fortement lié au film de cellulose que l’eau. La désorption du CO2 commence à environ +60°C, marquant le début de la décomposition de la cellulose et de la désorption.
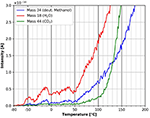
Figure 11. Zoom sur la désorption du méthanol deutéré (masse 34, bleu), du dioxyde de carbone (masse 44, vert) et de l’eau (masse 18, rouge) dans la plage de température comprise entre -80 et 200°C.
Conclusions
Dans cette étude, l’adsorption et la désorption de molécules organiques sur des films minces de cellulose ont été étudiées en utilisant la désorption programmée en température. Il a pu être démontré que la co-adsorption de l’eau et du CO2 du gaz résiduel est également influencée par les molécules adsorbées. Toutes les espèces ont une influence marquée sur la décomposition/désorption des films de cellulose. D’après les résultats présentés ici, il devient clair que les molécules non polaires et polaires s’adsorbent facilement sur une surface de cellulose, la molécule polaire présentant une énergie de liaison plus élevée.
Le méthanol deutéré présente un pic de désorption à environ 400°C et dans la même plage de température, la désorption/décomposition de la cellulose a lieu. Comme les espèces adsorbées se désorbent dans la même plage que le film de cellulose, l’énergie d’adsorption pourrait en fait être plus élevée que les 180 kJ/mol approximatifs obtenus à partir de l’équation de Redhead.
À l’avenir, nous prévoyons d’étudier différentes molécules ainsi que l’influence possible de l’épaisseur du film de cellulose sur l’adsorption et la désorption des molécules organiques.
Contributions des auteurs
EH a planifié et construit la chambre à vide et réalisé les expériences. VH a réalisé les expériences initiales. JA a réalisé les premières expériences. RS a eu l’idée de la recherche, de la configuration de la chambre à vide, et a supervisé les étudiants.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Ce travail a été soutenu par la Société Christian Doppler, Autriche. Le soutien financier du ministère fédéral autrichien des Affaires numériques et économiques et de la Fondation nationale pour la recherche, la technologie et le développement, Autriche, est remercié.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fmats.2019.00178/full#supplementary-material
Carruth, G. F., et Kobayashi, R. (1973). Pression de vapeur des paraffines normales éthane à n-décane de leurs points triples à environ 10 mm de mercure. J Chem Eng Data. 18, 115-126. doi : 10.1021/je60057a009
CrossRef Full Text | Google Scholar
Chen, P., Nishiyama, Y., Wohlert, J., Lu, A., Mazeau, K., et Ismail, A. E. (2017). L’entropie translationnelle et l’énergie de dispersion dirigent conjointement l’adsorption de l’urée sur la cellulose. J. Phys. Chem. B 121, 2244-2251. doi : 10.1021/acs.jpcb.6b11914
PubMed Abstract | CrossRef Full Text | Google Scholar
Djak, M., Gilli, E., Kontturi, E., et Schennach, R. (2011). Dépendance de l’épaisseur des spectres infrarouges de réflexion-absorption de films polymères minces supportés. Macromolecules 44, 1775-1778. doi : 10.1021/ma102905v
CrossRef Full Text | Google Scholar
Ganser, C., Hirn, U., Rohm, S., Schennach, R., et Teichert, C. (2014). Nanoindentation AFM de fibres de pâte à papier et de films minces de cellulose à humidité relative variable. Holzforschung 68, 53-60. doi : 10.1515/hf-2013-0014
CrossRef Full Text | Google Scholar
Ganser, C., Niegelhell, K., Czibula, C., Chemelli, A., Teichert, C., Schennach, R., et al. (2016). Effets de topographie dans les expériences de cartographie de force AFM sur les films minces de cellulose décorés de xylan. Holzforschung 70, 1115-1123. doi : 10.1515/hf-2016-0023
CrossRef Full Text | Google Scholar
Hakalahti, M., Faustini, M., Boissiere, C., Kontturi, E., et Tammelin, T. (2017). Mécanismes interfaciaux de sorption de la vapeur d’eau dans les films de nanofibrilles de cellulose, révélés par des modèles quantitatifs. Biomacromolecules 18, 2951-2958. doi : 10.1021/acs.biomac.7b00890
PubMed Abstract | CrossRef Full Text | Google Scholar
Hohenegger, M., Bechtold, E., et Schennach, R. (1998). Coadsorption de l’oxygène et du chlore sur Pt(111). Surf. Sci. 412/413, 184-191.
Google Scholar
Hoja, J., Maurer, R. J., et Sax, A. F. (2014). Adsorption du glucose, du cellobiose et du cellotetraose sur des surfaces modèles de cellulose. J Phys. Chemistry B 118, 9017-9027. doi : 10.1021/jp5025685
PubMed Abstract | CrossRef Full Text | Google Scholar
Kontturi, E., Thüne, P. C., et Niemantsverdriet, J. W. (2003). Nouvelle méthode pour préparer des surfaces modèles de cellulose par revêtement par centrifugation. Polymer 44, 3621-3625. doi : 10.1016/S0032-3861(03)00283-0
CrossRef Full Text | Google Scholar
Li, H., Du, Y., et Xu, Y. (2003). Adsorption et complexation des additifs chitosan wet-end dans les systèmes de fabrication du papier. J Appl Polymer Sci. 91, 2642-2648. doi : 10.1002/app.13444
CrossRef Full Text | Google Scholar
Lombardo, S., et Thielemans, W. (2019). Thermodynamique de l’adsorption sur les surfaces de nanocellulose. Cellulose 26, 249-279. doi : 10.1007/s10570-018-02239-2
CrossRef Full Text | Google Scholar
Majer, V., et Scoboda, V. (1985). Enthalpies de vaporisation des composés organiques : une revue critique et une compilation de données. Blackwell Sci. Publications. 1985:300.
Mazeau, K., et Vergelati, C. (2002). Modélisation atomistique de l’adsorption de la benzophénone sur des surfaces cellulosiques. Langmuir 18, 1919-1927. doi : 10.1021/la010792q
CrossRef Full Text | Google Scholar
Mazeau, K., et Wyszomirski, M. (2012). Modélisation de l’adsorption du rouge Congo sur la surface hydrophobe de la cellulose en utilisant la dynamique moléculaire. Cellulose 19, 1495-1506. doi : 10.1007/s10570-012-9757-6
CrossRef Full Text | Google Scholar
Neumann, R. D., Berg, J. M., et Claesson, P. M. (2018). Mesure directe des forces de surface dans les systèmes de fabrication et de couchage du papier. Nordic Pulp Paper Res. J. 8, 96-104. doi : 10.3183/npprj-1993-08-01-p096-104
CrossRef Full Text
Niinivaara, E., Faustini, M., Tammelin, T., et Kontturi, E. (2015). Absorption de la vapeur d’eau des films ultraminces de nanocristaux d’origine biologique : évaluation quantitative avec la microbalance à cristal de quartz et l’ellipsométrie spectroscopique. Langmuir 31, 12170-12176. doi : 10.1021/acs.langmuir.5b01763
PubMed Abstract | CrossRef Full Text | Google Scholar
Niinivaara, E., Faustini, M., Tammelin, T., et Kontturi, E. (2016). Mimer la réponse à l’humidité de la paroi cellulaire végétale en utilisant des systèmes bidimensionnels : le rôle critique des polysaccharides amorphes et cristallins. Langmuir 32, 2032-2040. doi : 10.1021/acs.langmuir.5b04264
PubMed Abstract | CrossRef Full Text | Google Scholar
Perez, D. D. S., Ruggiero, R., Morais, L. C., Machado, A. E. H., et Mazeau, K. (2004). Theoretical and experimental studies on the adsorption of aromatic compounds onto cellulose. Langmuir 20, 3151-3158. doi : 10.1021/la0357817
CrossRef Full Text | Google Scholar
Redhead, P. A. (1962). Désorption thermique des gaz. Vacuum 12, 203-211, doi : 10.1016/0042-207X(62)90978-8
CrossRef Full Text | Google Scholar
Rohm, S., Hirn, U., Ganser, C., Teichert, C., et Schennach, R. (2014). Films minces de cellulose comme système modèle pour les liaisons de fibres de papier. Cellulose 21, 237-249. doi : 10.1007/s10570-013-0098-x
CrossRef Full Text | Google Scholar
Somorjai, G. A. (1981). La chimie en deux dimensions : Surfaces. Ithaca, NY : Cornell University Press.
Tozuka, Y., Tashiro, E., Yonemochi, E., Oguchi, T., et Yamamoto, K. (2002). Solid-state fluorescence study of naphthalene adsorptionon porous material. J. Colloid Interface Sci. 248, 239-243. doi : 10.1006/jcis.2001.8142
PubMed Abstract | CrossRef Full Text | Google Scholar
Tozuka, Y., Yonemochi, E., Oguchi, T., et Yamamoto, K. (1998). Études fluorométriques de l’adsorption du pyrène sur la cellulose cristalline poreuse. J Colloid Interface Sci. 205, 510-515.
PubMed Abstract | Google Scholar
Voisin, H., Bergström, L., Liu, P., et Mathew, A. P. (2017). Matériaux à base de nanocellulose pour la purification de l’eau. Nanomaterials 7:57. doi : 10.3390/nano7030057
PubMed Abstract | CrossRef Full Text | Google Scholar
Xie, Y., Hill, C. A. S., Jalaludin, Z., et Sun, D. (2011). Le comportement de sorption de la vapeur d’eau de trois celluloses : analyse à l’aide de la cinétique exponentielle parallèle et interprétation à l’aide du modèle viscoélastique de Kelvin-Voigt. Cellulose 18, 517-530. doi : 10.1007/s10570-011-9512-4
CrossRef Full Text | Google Scholar
.