La bonne réponse est : C. TEP/TDM au 18F-FDG
Après discussion avec l’équipe cardiaque, nous avons opté pour un examen d’imagerie nucléaire pour déterminer s’il y avait un abcès de la racine aortique. Une tomographie par émission de positons/tomodensitométrie (TEP/TDM) au fludésoxyglucose F 18 (18F-FDG) réalisée en urgence a permis d’élucider un foyer de prise intense de 18F-FDG adjacent aux calcifications de la racine aortique avec une extension de l’inflammation à l’aspect antérieur droit de la racine aortique. Ces résultats étaient compatibles avec une aortite focale. On a également noté un épanchement péricardique avec une densité mixte encapsulée par un rebord de faible prise de 18F-FDG, représentant une composante protéinique/hémorragique de l’épanchement et une péricardite en cours (figure 1).
Figure 1
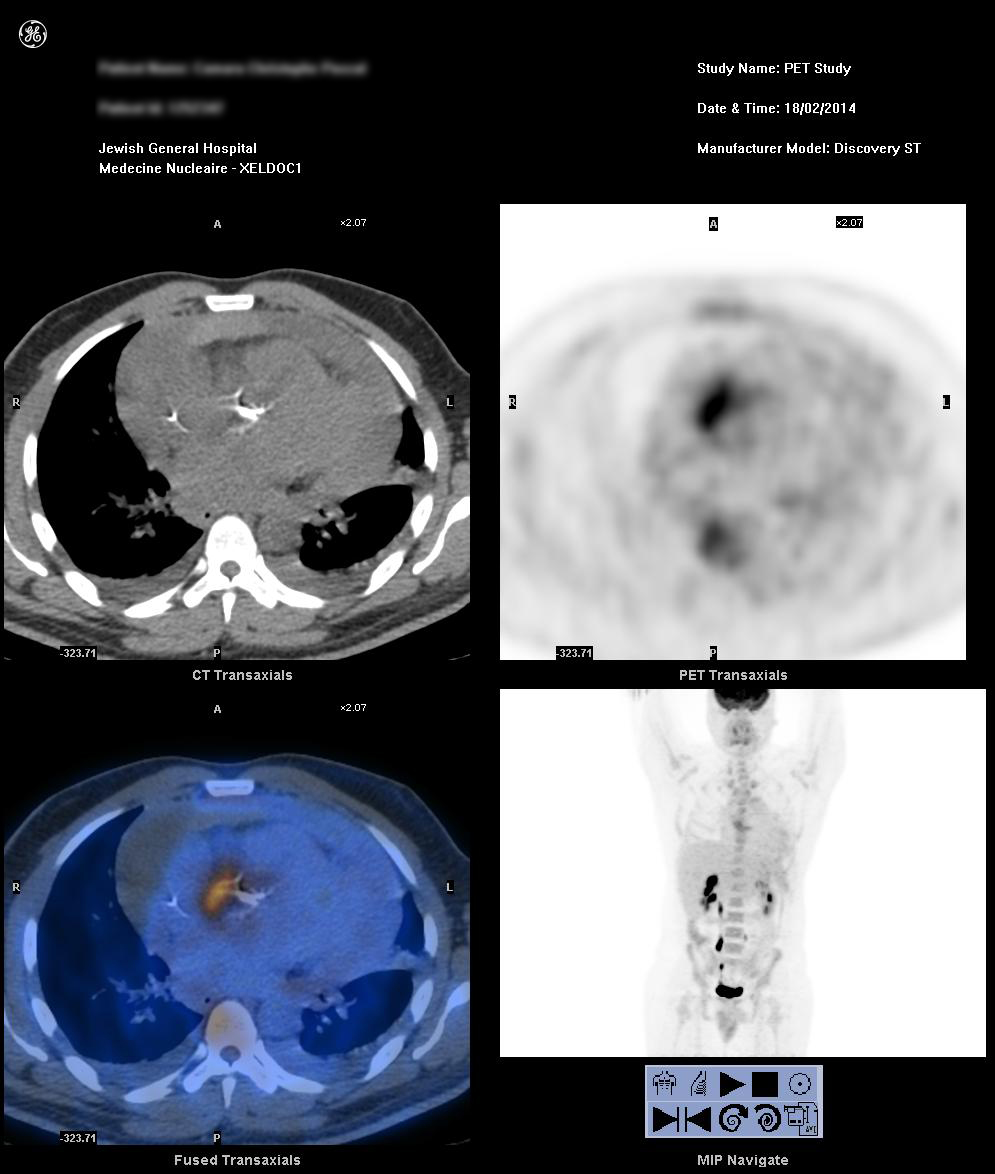
Notre patient a ensuite été diagnostiqué avec une endocardite aiguë de la valve aortique sur une valve aortique native qui a été compliquée à la fois par un abcès de la racine aortique et une rupture contenue de la racine aortique, entraînant une péricardite hémorragique. L’abcès situé antérieurement, rétrospectivement, était ombragé par la valve aortique fortement calcifiée sur l’ETO.
Le patient a été envoyé en urgence au bloc opératoire où les chirurgiens ont noté un péricarde tendu avec la présence de sang, un hémopéricarde et beaucoup de caillots sanguins sur la face antérieure du ventricule droit. Ils ont également identifié une péricardite hémorragique et une racine aortique infectée, notamment au-dessus du sinus coronaire droit et du sinus non coronaire. Bien que la face externe de la racine aortique ne présentait pas de pus franc, ils ont identifié une zone de rupture contenue et un abcès muré. Enfin, la valve aortique était fortement calcifiée par ce qui était très probablement une maladie rhumatismale, sur laquelle des végétations ont été identifiées.
La présence d’extensions périvalvulaires de l’EI est associée à un mauvais pronostic. Ces complications comprennent la formation d’abcès, de pseudo-anévrisme et de fistules.1 Étant donné que la présence d’un abcès de la racine aortique est une indication urgente de chirurgie, son diagnostic rapide et précis est obligatoire pour tenter de réduire la morbidité et la mortalité péri-opératoires.2
L’ETO, avec sa qualité d’image améliorée et sa proximité des différentes structures en question ainsi que des sondes à plus haute fréquence, permet une résolution spatiale et temporelle plus détaillée pour détecter une végétation valvaire et toute complication associée.3 En outre, l’ETO, avec une sensibilité de 90 %, est considérée comme la modalité d’imagerie diagnostique supérieure à l’ETT (sensibilité d’environ 50 %) pour le diagnostic des abcès dans les endocardites compliquées de la valve aortique4,5. À ce titre, la Société européenne de cardiologie (ESC) recommande un ETO si l’ETT est de qualité sous-optimale, s’il y a une valve prothétique ou s’il y a une suspicion de complication causée par ce processus infectieux.
L’abcès de la racine aortique antérieure est classiquement plus difficile à diagnostiquer. Il est plus visible dans le plan longitudinal et nécessite une imagerie multiplan pour identifier sa présence.2 De plus, la présence de calcifications entrave la transmission des ondes ultrasonores à l’ETO et constitue une limitation évidente lors de l’évaluation d’une valve aortique calcifiée6. Par conséquent, dans notre cas, l’utilisation d’une imagerie alternative a été recherchée pour clarifier le diagnostic d’endocardite infectée présumée.
Dans la précédente itération des lignes directrices de l’ESC pour le diagnostic et le traitement de l’endocardite, un nouvel ETO était recommandé dans les 7 à 10 jours suivant la présentation lorsque l’imagerie initiale est négative mais que la suspicion clinique d’EI reste élevée.1,7-10 Des études récentes ont toutefois montré la valeur diagnostique supplémentaire de la TEP/TDM dans les infections impliquant des prothèses et des dispositifs de valve cardiaque, lorsque le diagnostic est souvent difficile. Pour l’endocardite des prothèses valvulaires, Saby et al. ont constaté que la TEP/TDM avait une sensibilité de 73 % et une spécificité de 80 %. Lorsque les résultats de la TEP/TDM ont été combinés aux critères traditionnels de Duke, la sensibilité et la spécificité sont passées de 70 à 97 % et de 52 à 91 %, respectivement, pour le diagnostic de l’EI.1,10 De plus, l’inclusion de la TEP/TDM dans les critères de Duke modifiés a permis un diagnostic plus précoce, notamment lorsque l’échocardiographie était normale ou douteuse et, surtout, avant la survenue de tout dommage infectieux ou événement indésirable.10 Ainsi, la dernière itération des lignes directrices de l’ESC pour le diagnostic et le traitement de l’endocardite a intégré la TEP/TDM au 18F-FDG en cas d’incertitude diagnostique. En tant qu’équipe, nous avons extrapolé à partir de ces données qu’en présence d’une calcification importante, la TEP/TDM nous permettrait de confirmer notre suspicion dans un cas d’endocardite à valve native.
Conclusion
L’ETO, en particulier dans les cas d’endocardite à valve mitrale, est clairement supérieur à l’ETT pour le diagnostic et l’évaluation de l’EI et de ses complications associées. L’endocardite de la valve aortique, en revanche, peut parfois s’avérer être un défi diagnostique, notamment lors de l’évaluation de la racine aortique antérieure pour la présence d’un abcès. Dans de telles circonstances, l’ETT et l’ETO jouent un rôle complémentaire pour poser un diagnostic définitif. Ce défi diagnostique peut être accentué, comme dans ce cas, par la présence d’une prothèse ou d’une calcification importante. Dans ces circonstances, une imagerie alternative doit être obtenue. La TEP-TDM peut permettre un diagnostic définitif plus précoce et éviter la progression vers des complications graves lorsque des abcès périaortiques sont suspectés.
- Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis : La Task Force pour la prise en charge de l’endocardite infectieuse de la Société européenne de cardiologie (ESC). Approuvé par : L’Association européenne de chirurgie cardio-thoracique (EACTS), l’Association européenne de médecine nucléaire (EANM). Eur Heart J 2015;36:3075-128.
- Leung DY, Cranney GB, Hopkins AP, Walsh WF. Rôle de l’échocardiographie transoesophagienne dans le diagnostic et la gestion de l’abcès de la racine aortique. Br Heart J 1994;72:175-81.
- Karalis DG, Bansal RC, Hauck AJ, et al. Reconnaissance échocardiographique transoesophagienne des complications subaortiques dans l’endocardite de la valve aortique. Implications cliniques et chirurgicales. Circulation 1992;86:353-62.
- Habib G, Badano L, Tribouilloy C, et al. Recommandations pour la pratique de l’échocardiographie dans l’endocardite infectieuse. Eur J Echocardiogr 2010;11:202-19.
- Daniel WG, Mügge A, Martin RP, et al. Amélioration du diagnostic des abcès associés à l’endocardite par échocardiographie transoesophagienne. N Engl J Med 1991;324:795-800.
- Iung B, Rouzet F, Brochet E, Duval X. Imagerie cardiaque de l’endocardite infectieuse, Echo et au-delà. Curr Infect Dis Rep 2017;19:8.
- Habib G, Hoen B, Tornos P, et al. Lignes directrices sur la prévention, le diagnostic et le traitement de l’endocardite infectieuse (nouvelle version 2009) : la Task Force sur la prévention, le diagnostic et le traitement de l’endocardite infectieuse de la Société européenne de cardiologie (ESC). Approuvé par la Société européenne de microbiologie clinique et des maladies infectieuses (ESCMID) et la Société internationale de chimiothérapie (ISC) pour l’infection et le cancer. Eur Heart J 2009;30:2369-413.
- Pérez-Vázquez A, Fariñas MC, García-Palomo JD, Bernal JM, Revuelta JM, González-Macías J. Evaluation des critères de Duke dans 93 épisodes d’endocardite de valve prothétique : la sensibilité pourrait-elle être améliorée ? Arch Intern Med 2000;160:1185-91.
- Roque A, Pizzi MN, Cuéllar-Calàbria H, Aguadé-Bruix S. Angiographie 18F-FDG-PET/CT pour le diagnostic de l’endocardite infectieuse. Curr Cardiol Rep 2017;19:15.
- Saby L, Laas O, Habib G, et al. Tomographie par émission de positons/tomodensitométrie pour le diagnostic de l’endocardite à valve prothétique : augmentation de la captation valvulaire du 18F-fluorodésoxyglucose comme nouveau critère majeur. J Am Coll Cardiol 2013;61:2374-82.