- Introduction
- Epidémiologie
- L’organisme et la physiopathologie de la diarrhée à C. difficile
- Manifestations cliniques
- Diagnostic
- Directives pratiques pour le diagnostic des syndromes diarrhéiques à C. difficile
- Diagnostic endoscopique de la diarrhée et de la colite à C. difficile
- Traitement
- Gestion de la diarrhée récurrente à C. difficile
- Colite à C. difficile sévère
- Conclusion
Introduction
La diarrhée associée à Clostridium difficile (DACD) a été reconnue avec une fréquence accrue comme une cause de maladie nosocomiale. La fréquence et l’incidence de la DACD varient considérablement et sont influencées par de multiples facteurs, notamment les épidémies nosocomiales, les modes d’utilisation des antimicrobiens et la sensibilité individuelle. Il n’existe aucun rapport d’études prospectives menées par des hôpitaux qui suivent les toxines A ou A/B positives et les résultats de la DACD et de ses complications.
Les Centres de contrôle et de prévention des maladies (CDC) ont analysé les tendances séculaires de l’incidence de la DACD, et ils ont signalé une augmentation constante de 1987 à 2001 (1). Dans ce rapport, 30 % des 440 médecins spécialisés dans les maladies infectieuses qui ont participé à un sondage en ligne ont déclaré qu’ils observaient des taux de DACD plus élevés, des DACD plus graves et des DACD récidivantes plus nombreuses que par le passé. L’impression générale est qu’il y a eu une augmentation de la proportion de cas avec des complications graves et fatales, et une augmentation du taux de rechute chez les patients affectés.
En plus de la morbidité et de la mortalité, le fardeau économique de l’infection à C. difficile en termes de retard de sortie et d’autres coûts hospitaliers est considérable.
Epidémiologie
La fréquence et l’incidence de la DACD varient entre les hôpitaux et au sein d’un établissement donné au fil du temps. Le risque de maladie augmente chez les patients qui ont été exposés à des antibiotiques, qui ont subi une chirurgie gastro-intestinale, dont la durée de séjour dans les établissements de santé s’allonge, qui souffrent d’une maladie sous-jacente grave, qui sont immunodéprimés et qui ont un âge avancé.
C. difficile est excrété dans les selles. Toute surface, tout dispositif ou tout matériel (par exemple, la commode, la baignoire et le thermomètre rectal électronique) qui est contaminé par des matières fécales peut servir de réservoir aux spores de C. difficile. Les spores sont transférées aux patients principalement par les mains du personnel de santé qui a touché une surface ou un article contaminé (2-6).
 cliquez pour une version large
cliquez pour une version large
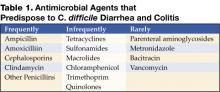
Figure 1 . La radiographie numérique issue de la tomodensitométrie montre un épaississement nodulaire de la houppe dans le côlon transverse.
L’organisme et la physiopathologie de la diarrhée à C. difficile
C. difficile est un bacille à Gram positif, anaérobie, sporulé, responsable du développement de diarrhées et de colites associées aux antibiotiques. C. difficile a été décrit pour la première fois en 1935 comme un composant de la flore fécale de nouveau-nés en bonne santé et n’était initialement pas considéré comme pathogène (7). Le bacille a été nommé difficile car il se développe lentement et est difficile à cultiver. C. difficile est actuellement responsable de presque toutes les causes de colite pseudo-membraneuse et de 20 % des cas de diarrhée sans colite associée aux antibiotiques. Bien qu’on ne le trouve dans les selles que de 5 % de la population générale, jusqu’à 21 % des adultes sont colonisés par cet organisme lorsqu’ils sont hospitalisés (2,6).
Une altération de la microflore colique normale, généralement causée par une antibiothérapie, est le principal facteur qui prédispose à l’infection par C. difficile. Presque tous les antibiotiques ont été associés à la diarrhée et à la colite à C. difficile. Les antibiotiques les plus fréquemment associés sont la clindamycine, les céphalosporines, l’ampicilline et l’amoxicilline (tableau 1) (8).
En plus de l’antibiothérapie, l’âge avancé et la gravité de la maladie sous-jacente sont des facteurs de risque importants pour l’infection à C. difficile. D’autres facteurs de risque comprennent la présence d’une sonde nasogastrique, les interventions gastro-intestinales, les médicaments antisécrétoires acides, le séjour en unité de soins intensifs et la durée de l’hospitalisation (9).
La diarrhée à C. difficile est principalement causée par l’élaboration des toxines A et B produites par la multiplication bactérienne dans la lumière intestinale. Ces toxines se lient à la muqueuse colique et exercent leurs effets délétères sur celle-ci. L’organisme endommage rarement le côlon par invasion directe, et la diarrhée est causée par les effets des toxines produites dans la lumière intestinale qui adhèrent à la surface de la muqueuse. La plupart des isolats toxigènes produisent les deux toxines, et environ 5 à 25 % des isolats ne produisent ni la toxine A ni la toxine B, et ne provoquent ni colite ni diarrhée (3-5).
Manifestations cliniques
L’infection par C. difficile peut produire un large éventail de manifestations cliniques, y compris un portage asymptomatique, une diarrhée légère à modérée, et une maladie fulminante avec colite pseudo-membraneuse (10). Chez les patients qui développent une DACD, les symptômes commencent généralement peu après la colonisation. La colonisation peut se produire pendant le traitement antibiotique ou jusqu’à plusieurs semaines après un traitement antibiotique. La DACD est généralement associée à l’émission de selles fréquentes et molles correspondant à une proctocolite. Du mucus ou du sang occulte peuvent être présents, mais le sang visible est rare.
Diagnostic
Le diagnostic de la DACD repose sur des antécédents d’antibiothérapie récente ou en cours, l’apparition de diarrhée ou d’autres signes de colite aiguë, et la démonstration d’une infection par C. difficile toxigène, généralement par la détection de la toxine A ou de la toxine B dans l’échantillon de selles.
 cliquez pour agrandir
cliquez pour agrandir
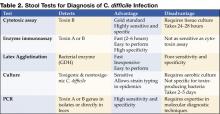
Figure 1 . La radiographie numérique issue de la tomodensitométrie montre un épaississement nodulaire de la houppe dans le côlon transverse.
Directives pratiques pour le diagnostic des syndromes diarrhéiques à C. difficile
- Le diagnostic doit être suspecté chez toute personne souffrant de diarrhée qui a reçu des antibiotiques dans les 2 mois précédents et/ou dont la diarrhée commence 72 heures ou plus après une hospitalisation.
- Lorsque le diagnostic est suspecté, un seul échantillon de selles doit être envoyé au laboratoire pour rechercher la présence de C. difficile et/ou de ses toxines.
- Lorsque la diarrhée persiste malgré un résultat négatif pour les toxines des selles, un ou deux échantillons supplémentaires peuvent être envoyés pour être testés avec les mêmes tests ou des tests différents (4). L’endoscopie est réservée à des situations particulières, par exemple lorsqu’un diagnostic rapide est nécessaire et que les résultats des tests sont retardés ou que le test n’est pas très sensible, lorsque le patient présente un iléus et que les selles ne sont pas disponibles, ou lorsque d’autres maladies coliques sont également à envisager.
Il n’existe pas encore de test simple, peu coûteux, rapide, sensible et spécifique pour diagnostiquer le C. difficile, et tous les tests disponibles ne peuvent pas être adoptés par tous les laboratoires (tableau 2) (11).
Diagnostic endoscopique de la diarrhée et de la colite à C. difficile
La sigmoïdoscopie et la coloscopie ne sont pas indiquées pour la plupart des patients atteints de DACD (10,12). L’endoscopie est toutefois utile dans des situations particulières, par exemple lorsque le diagnostic est douteux ou que la situation clinique exige un diagnostic rapide. Les résultats de l’examen endoscopique peuvent être normaux chez les patients présentant une diarrhée légère ou montrer une colite non spécifique dans les cas modérés. La découverte de pseudomembranes coliques chez un patient souffrant de diarrhée associée à des antibiotiques est pratiquement pathognomonique de la colite à C. difficile. Quelques patients sans caractéristiques diagnostiques dans le rectosigmoïde ont des pseudomembranes dans les zones plus proximales du côlon (13). Les autres résultats endoscopiques comprennent l’érythème, l’œdème, la friabilité et une colite non spécifique avec de petites ulcérations ou érosions.
Traitement
La première étape de la prise en charge de la diarrhée et de la colite à C. difficile est d’arrêter les antibiotiques précipitants si possible (10,12). La diarrhée disparaît chez environ 15 à 25 % des patients sans traitement spécifique contre le C. difficile (14,15). Cependant, le traitement conservateur seul peut ne pas être indiqué chez les patients souffrant d’une maladie systémique ou de multiples problèmes médicaux, car il est difficile de prédire quels patients vont s’améliorer spontanément. S’il n’est pas possible d’interrompre la prise de l’antibiotique déclencheur en raison d’autres infections actives, le régime antibiotique du patient doit être modifié si possible pour utiliser des agents moins susceptibles de provoquer une DACD (par ex, Les agents antipéristaltiques, comme le diphénoxylate plus atropine (Lomotil) ou le lopéramide (Imodium), et les analgésiques narcotiques doivent être évités car ils peuvent retarder l’élimination des toxines du côlon et ainsi exacerber les lésions coliques induites par les toxines ou précipiter l’iléus et la dilatation toxique (12,16). Une thérapie spécifique pour éradiquer C. difficile doit être utilisée chez les patients présentant des symptômes initialement sévères et chez les patients dont les symptômes persistent malgré l’arrêt du traitement antibiotique. Bien que le diagnostic de colite à C. difficile doive idéalement être établi avant la mise en place d’un traitement antimicrobien, les directives actuelles de l’ACG recommandent d’initier un traitement empirique dans les cas très évocateurs de patients gravement malades (tableau 3, page 54) (12).
À l’heure actuelle, la vancomycine ou le métronidazole par voie orale, utilisés pendant 7 à 10 jours, sont considérés comme un traitement de première intention par la plupart des auteurs et les directives actuelles. Le métronidazole à la dose de 250 mg 4 fois par jour est recommandé par la plupart des auteurs et des directives de l’ACG comme le médicament de choix pour le traitement initial de la colite à C. difficile (12). Ces recommandations sont largement fondées sur l’efficacité, les coûts moindres et les préoccupations concernant le développement de souches résistantes à la vancomycine. Les principaux inconvénients du métronidazole comprennent un profil médicamenteux moins souhaitable et des contre-indications chez les enfants et les femmes enceintes.
La vancomycine, en revanche, à une dose de 125 mg 4 fois par jour, est sûre et bien tolérée et atteint des niveaux dans les selles 20 fois supérieurs à la concentration minimale inhibitrice requise pour le traitement de C. difficile. Les inconvénients de l’utilisation de la vancomycine sont son coût et le développement potentiel de souches résistantes à la vancomycine. Les directives actuelles de l’ACG considèrent la vancomycine comme le médicament de choix chez les patients gravement malades et dans les cas où l’utilisation du métronidazole est exclue.
On manque d’essais cliniques contrôlés pour les patients atteints de colite fulminante qui peuvent ne pas tolérer le traitement oral. L’administration de métronidazole par voie intraveineuse ou l’administration de vancomycine par sonde nasogastrique ou lavement rectal ont été décrites dans de petites séries de cas (17-20). L’administration intraveineuse de vancomycine n’est pas recommandée, car le médicament n’est pas excrété dans le côlon (17).
Gestion de la diarrhée récurrente à C. difficile
Malgré un traitement initial réussi de la DACD, 15 à 20% des patients présentent une récurrence de la diarrhée en association avec un test de selles positif pour la toxine C. difficile. La récurrence symptomatique est rarement due à un échec du traitement ou à une résistance antimicrobienne au métronidazole ou à la vancomycine. Les approches de la prise en charge comprennent un traitement conservateur (cependant, de nombreux patients sont âgés et infirmes et ne peuvent pas tolérer la diarrhée), un traitement avec des antibiotiques spécifiques anti-C. difficile, l’utilisation de résines liant les anions, un traitement avec des micro-organismes (probiotiques) et un traitement par immunoglobulines.
Le traitement le plus courant pour la diarrhée récurrente à C. difficile est un second traitement avec le même antibiotique que celui utilisé pour traiter l’épisode initial (12). Dans une vaste étude d’observation menée aux États-Unis, 92 % des patients atteints de DACD récurrente ont répondu avec succès à un seul traitement répété, généralement à base de métronidazole ou de vancomycine (14). Il existe des preuves suggérant que les patients ayant des antécédents de récidive présentent un risque élevé de nouveaux épisodes de DACD après l’arrêt de l’antibiothérapie. Il n’existe pas de données suggérant que les épisodes séquentiels deviennent progressivement plus graves ou compliqués (21). Différents schémas thérapeutiques ont été proposés pour les patients présentant des récidives multiples de diarrhée à C. difficile. L’une des approches consiste à administrer un traitement prolongé de vancomycine (ou de métronidazole) en utilisant un schéma posologique décroissant suivi d’un traitement pulsé (tableau 4).
La cholestyramine, une résine échangeuse d’anions administrée à la dose de 4 grammes 3 ou 4 fois par jour pendant 1 à 2 semaines, fixe les toxines de C. difficile et peut être utilisée conjointement avec les antibiotiques pour traiter les récidives répétées. Comme la cholestyramine peut fixer la vancomycine ainsi que les toxines, elle doit être prise à au moins 2 à 3 heures d’intervalle de la vancomycine.
Colite à C. difficile sévère
L’incidence de la colite à C. difficile fulminante a été rapportée à 1,6-3,2% (22). Bien que l’on manque de chiffres précis récents provenant d’autres centres, elle est reconnue comme une cause croissante de complications et de décès. Le syndrome clinique de la colite fulminante à C. difficile peut être reconnu avec une bonne connaissance du spectre de présentation de la maladie.
A. Diarrhée : Bien que la diarrhée soit la caractéristique de la colite à C. difficile, elle n’est pas invariablement présente, et son absence peut entraîner une confusion diagnostique. Lorsque la diarrhée est absente, cela semble être secondaire à une dysmotilité colique sévère. Même lorsqu’elle est présente, la diarrhée peut être perçue comme une composante mineure d’un tableau septique non spécifique.
 Réimprimé avec la permission de BUMC Proceedings 1999 ; 12:249-250
Réimprimé avec la permission de BUMC Proceedings 1999 ; 12:249-250
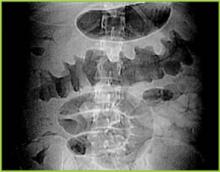
Figure 1 . La radiographie numérique de la tomodensitométrie montre un épaississement nodulaire de la houppe dans le côlon transverse.
 Réimprimé avec la permission de BUMC Proceedings 1999 ; 12:249-250
Réimprimé avec la permission de BUMC Proceedings 1999 ; 12:249-250
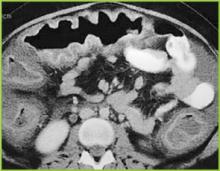
Figure 2 . Une image CT de l’abdomen supérieur confirme un épaississement haustral marqué dans le côlon transverse.
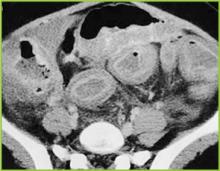 Réimprimé avec la permission de BUMC Proceedings 1999 ; 12:249-250
Réimprimé avec la permission de BUMC Proceedings 1999 ; 12:249-250
Figure 3 . L’image tomodensitométrique de l’abdomen moyen démontre un épaississement marqué de l’ensemble du côlon. Des changements inflammatoires légers sont présents dans la graisse péricolonique.
B. Maladie sévère : La colite fulminante est une forme inhabituelle de l’infection à C. difficile, ne se produisant que chez 3 % des patients mais représentant pratiquement toutes les complications graves. Les patients présentant des formes plus sévères de la maladie peuvent se présenter avec ou sans diarrhée. Lorsque les patients développent une colite localisée au cæcum et au côté droit du côlon, la diarrhée peut être minime ou absente. En l’absence de diarrhée, les seuls indices du diagnostic peuvent être des signes systémiques de toxicité (fièvre, tachycardie, leucocytose et/ou déplétion volumique).
Un taux élevé de globules blancs peut être un indice important de l’imminence d’une colite fulminante à C. difficile. L’élévation rapide du nombre de globules blancs périphériques (souvent jusqu’à 30 000 à 50 000) avec un excès significatif de bandes et parfois de formes plus immatures précède souvent une instabilité hémodynamique et le développement d’un dysfonctionnement des organes. Même chez les patients qui présentent des symptômes légers pendant une période prolongée, une évolution soudaine et inattendue vers le choc peut se produire. Il est difficile de prévoir les patients qui ne répondront pas au traitement médical. Par conséquent, les signes d’alerte précoces tels qu’une réaction leucémoïde peuvent être précieux.
L’hypotension est une découverte tardive et peut être résistante au soutien vasopresseur. Les signes abdominaux vont de la distension à la sensibilité généralisée avec garde. La perforation colique est généralement accompagnée d’une rigidité abdominale, d’une garde involontaire, d’une sensibilité de rebond et d’une absence de bruits intestinaux. De l’air libre peut être révélé sur les radiographies de l’abdomen. Toute suspicion de perforation dans ce contexte doit entraîner une consultation chirurgicale immédiate. Le décès survient généralement avant que l’air libre et la perforation ne se produisent. Dans une étude, contrairement à la plupart des autres publications, la perforation s’est avérée rare (22).
La radiographie abdominale peut révéler un côlon dilaté (>7 cm dans son plus grand diamètre), compatible avec un mégacôlon toxique. Les patients atteints de mégacôlon peuvent présenter un iléus de l’intestin grêle associé avec un intestin grêle dilaté sur les radiographies abdominales simples, avec des niveaux air-fluide imitant une obstruction ou une ischémie de l’intestin grêle. La tomodensitométrie sans contraste et l’endoscopie peuvent rapidement diagnostiquer ou au moins suggérer fortement une colite fulminante à C. difficile. Les résultats de la tomographie comprennent des signes d’ascite, d’épaississement et/ou de dilatation de la paroi colique. Ces résultats peuvent s’avérer utiles pour catégoriser la gravité de la colite.
Une intervention plus agressive chez les patients qui ne répondent pas au traitement médical, y compris l’identification rapide des patients qui ne répondent pas au traitement médical, est cruciale pour une issue positive, et une intervention chirurgicale précoce devrait être effectuée dans ce groupe (Figures 1-3).
Il est important que toutes les personnes impliquées dans les soins aux patients dans les hôpitaux, les maisons de soins infirmiers et les établissements de soins qualifiés soient informées sur l’organisme et son épidémiologie, les approches rationnelles du traitement et des soins des patients atteints de C. difficile, l’importance du lavage des mains entre les contacts avec les patients, l’utilisation de gants pour soigner un patient atteint de diarrhée à C. difficile et l’évitement de l’utilisation inutile d’antimicrobiens.
Conclusion
Les dernières années ont soulevé des inquiétudes quant à l’augmentation de l’incidence et des taux de complications graves de la DACD dans les hôpitaux nord-américains (22,23). Le journal de l’Association médicale canadienne a publié en 2004 un rapport détaillant une épidémie de DACD impliquant plusieurs hôpitaux de Montréal. L’introduction de nouvelles souches hypervirulentes et hautement transmissibles de C. difficile a été avancée comme cause possible de cette épidémie (24). La détérioration de l’infrastructure, les pratiques inadéquates de contrôle des infections, le nombre croissant de patients affaiblis, le vieillissement de la population et les souches hypervirulentes ont tous été considérés comme des facteurs probables des récentes éclosions au Canada (25).
Deux enquêtes épidémiologiques menées aux États-Unis et au Canada (24,26) ont examiné indépendamment des échantillons de C. difficile et ont révélé qu’une version mutée de la souche « sauvage » était responsable des éclosions au Québec et de l’augmentation des taux de DACD dans les hôpitaux des États-Unis récemment (22,23). Des épidémiologistes cliniques du CDC ont étudié des isolats de C. difficile provenant d’hôpitaux des États-Unis ayant connu des éclosions récentes (c.-à-d. de 2001 à 2004) de DACD (22,23). Le rapport indique l’émergence d’une nouvelle souche épidémique, « BI » (distincte de la souche « J » de 1989-1992), qui pourrait être responsable de la récente augmentation des taux et de la gravité apparente de la DACD (26).
La DACD et la colite peuvent, dans la plupart des cas, être traitées par l’administration de métronidazole ou de vancomycine. Chez certains patients, une toxicité grave menaçant le pronostic vital se développe malgré un traitement médical approprié et opportun, et une intervention chirurgicale est nécessaire. Les symptômes systémiques de l’infection par C. difficile ne proviendraient pas d’une bactériémie, d’une perforation colique ou d’une ischémie, mais de médiateurs inflammatoires induits par la toxine et libérés par le côlon (27-29). Une intervention chirurgicale précoce devrait être utilisée dans les cas réfractaires de maladie grave. L’intervention chirurgicale est cependant loin d’être idéale et comporte un taux très élevé de complications et un risque important de mortalité (22). La future approche clinique du traitement de la colite nosocomiale à C. difficile pourrait éventuellement impliquer des hyperimmunoglobulines antitoxines spécifiques et des inhibiteurs de la cascade inflammatoire (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Tendance séculaire de la maladie Clostridium difficile acquise en milieu hospitalier aux États-Unis ; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Colite associée aux antibiotiques. Dans : Mandell G, Bennet JE, Dolin R, eds. Principes et pratique des maladies infectieuses. 4th ed. New York : Churchill Livingston ; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhée : Pathogenèse, épidémiologie et traitement. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile : Histoire de son rôle en tant qu’agent pathogène entérique et état actuel des connaissances sur cet organisme. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In : Mayhall CG, ed. Épidémiologie hospitalière et contrôle de l’infection. Baltimore, Md : Williams & Wilkins ; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Acquisition nosocomiale de Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants : Avec une description d’un nouvel anaérobie pathogène, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Traitement de la diarrhée et de la colite à Clostridium difficile. In : Wolfe MM, ed. Pharmacothérapie gastro-intestinale. Philadelphie, Pa. : WB Saunders ; 1993:199-212.
- Bignardi GE. Facteurs de risque de l’infection à Clostridium difficile. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Colite à Clostridium difficile. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Colite à Clostridium difficile. In : Lamont JT, ed. Infections gastro-intestinales : Diagnosis and Management. New York : Marcel Dekker ; 1997:293-325.
- Fekety R. Lignes directrices pour le diagnostic et la gestion de la diarrhée et de la colite associées à Clostridium difficile. Collège américain de gastro-entérologie, comité des paramètres de pratique. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. L’épargne rectale dans la colite pseudomembraneuse associée aux antibiotiques : Une étude prospective. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Dix ans de surveillance prospective des maladies associées à Clostridium difficile et de traitement au centre médical VA de Minneapolis, 1982-1991. Infect Control Hosp Epidemiol. 1994;15 : 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Vancomycine intracolonique adjuvante pour la colite grave à Clostridium difficile : série de cas et revue de la littérature. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Métronidazole intraveineux pour le traitement de la colite à Clostridium difficile. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Diarrhée récurrente à Clostridium difficile : caractéristiques et facteurs de risque pour les patients inscrits dans un essai prospectif, randomisé, en double aveugle. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile : une cause sous-estimée et croissante de décès et de complications. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Colite à Clostridium difficile : une maladie iatrogène de plus en plus agressive ? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. JAMC. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. L’infection à Clostridium difficile dans les hôpitaux : une tempête qui se prépare. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence d’une souche épidémique de Clostridium difficile aux États-Unis, 2001-4 : Rôle potentiel des facteurs de virulence et des traits de résistance aux antimicrobiens. 42e réunion annuelle de l’Infectious Diseases Society of America. Boston, MA, 30 septembre – 3 octobre 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Augmentation des réponses à la substance P dans les ganglions de la racine dorsale, les macrophages intestinaux pendant l’entérite à la toxine A de Clostridium difficile chez les rats. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. La toxine A de Clostridium difficile stimule la production de la protéine-2 inflammatoire du macrophage dans les cellules épithéliales intestinales du rat. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survie du concentré d’immunoglobuline bovine anti-Clostridium difficile dans le tractus gastro-intestinal humain. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis. Gut. 1997;41:366-70.