Introduction
La maladie rénale chronique (MRC) est associée à une mortalité élevée, notamment d’origine cardiovasculaire. Cependant, l’association limitée entre la mortalité et les facteurs de risque cardiovasculaire traditionnels chez ces patients est paradoxale. Seuls certains marqueurs liés à l’inflammation ou à la nutrition (par exemple, la protéine C-réactive et l’albumine sérique) se sont révélés être des prédicteurs cohérents de la mortalité dans l’IRC1.
Ces dernières années, certaines études d’observation ont montré une association entre des concentrations sériques totales élevées de phosphatase alcaline (ALP) et la mortalité chez les patients atteints d’IRC2-5 ; cependant, la signification biologique et clinique de cette découverte reste inconnue.
La gamma-glutamyl transférase (GGT) est une enzyme présente dans le sérum et sur la surface externe des cellules de différents organes tels que le foie, le pancréas, l’intestin, les poumons et les reins6. La GGT sérique est non seulement un marqueur traditionnel de la consommation d’alcool et des maladies hépatobiliaires, mais plusieurs études ont également montré une association entre des taux élevés de GGT sérique et les maladies cardiovasculaires, le diabète sucré, l’hypertension et le syndrome métabolique7.
Le taux de GGT est un facteur prédictif de mortalité dans la population générale ; en fait, cette enzyme a récemment été incluse dans un ensemble de paramètres biochimiques prédictifs de mortalité.8 De plus, le taux de GGT sérique pourrait aider à interpréter des valeurs élevées d’ALP d’origine incertaine.
Il n’existe que peu d’études ayant analysé la signification clinique et pronostique de la GGT sérique dans l’IRC.9,10 L’objectif de cette étude était d’étudier les caractéristiques cliniques des patients atteints d’IRC présentant des taux sériques de GGT anormalement élevés et leur interaction avec l’ALP, et de déterminer la valeur de ce paramètre en tant que prédicteur de la mortalité.
Matériels et méthodes
Il s’agit d’une étude rétrospective, observationnelle, menée sur une cohorte de patients adultes suivis dans la clinique ambulatoire de faible clairance (IRC avancée) du département de néphrologie de l’hôpital Infanta Cristina, Badajoz, Espagne, de janvier 2002 à octobre 2013. L’étude comprenait tous les patients en pré-dialyse âgés de >18 ans avec un débit de filtration glomérulaire estimé (DFGe)
mL/min/1,73m2. Les patients atteints d’IRC due à un dysfonctionnement de la transplantation rénale n’ont pas été inclus.
Les données démographiques et les paramètres cliniques tels que l’âge, le sexe, l’indice de masse corporelle (IMC), les comorbidités et les médicaments ont été enregistrés lors de l’inclusion.
La comorbidité a été évaluée à l’aide du score de Davies,11 et les patients ont été classés en fonction de l’agrégation de leurs différentes comorbidités : aucune comorbidité, légère-modérée (1 ou 2 processus comorbides), ou sévère (3 processus comorbides ou plus). Les principales comorbidités enregistrées étaient : le diabète sucré, l’insuffisance cardiaque, la maladie coronarienne, la maladie cérébrovasculaire ou vasculaire périphérique, la maladie pulmonaire obstructive chronique, le cancer et les processus inflammatoires chroniques.
Dans la présente étude, le terme « maladie du foie » incluait non seulement les patients diagnostiqués avec des maladies chroniques du foie, une cirrhose ou une transplantation du foie, mais aussi les patients souffrant d’alcoolisme actif, ou d’une infection active par le virus hépatotrope (B ou C). La stéatohépatite non alcoolique (maladie du foie gras) était un résultat échographique commun chez ces patients, bien que cette maladie ne soit pas incluse dans la liste des maladies du foie.
Les patients ont été suivis régulièrement depuis leur inclusion dans l’étude jusqu’à leur décès, leur transplantation rénale, leur perte de suivi ou la fin de la période de collecte des données (31 décembre 2014).
Compte tenu de la conception rétrospective de l’étude, le consentement éclairé individuel n’a pas été obtenu.
Mesures biochimiques
Depuis janvier 2002, la GGT sérique et l’ALP totale ont été ajoutées aux mesures de routine des paramètres biochimiques chez les patients de notre clinique d’IRC avancée.
Les taux de GGT ont été déterminés à l’aide d’un auto-analyseur (Advia Chemistry, Siemens Healthcare Diagnostics, New York, USA) par méthode colorimétrique cinétique avec le gamma-glutamyl-3-carboxy-4-nitroanilide et la glycylglycine. Le coefficient de variation est inférieur à 4,5% et la gamme de référence 0-36U/L.
Les taux sériques d’ALP ont également été mesurés par autoanalyseur (Advia Chemistry), avec la méthode ALPI, qui quantifie l’activité Alkalinine Phosphatase en mesurant la transphosphorylation du p-nitrophénylphosphate en p-nitrophénol en présence de 2-amino-2-méthyl-1-propanol. Le coefficient de variation était inférieur à 4 % et la plage de référence était de 45 à 120 U/L.
Pour caractériser les patients dont le taux sérique de GGT ou d’ALP était anormalement élevé, les paramètres hématologiques et biochimiques de base (indiqués dans le tableau 1) ont également été inclus dans l’étude. Les paramètres biochimiques ont été déterminés par des méthodes de laboratoire conventionnelles (Advia Chemistry, New York, USA). Les taux d’hormone parathyroïdienne (molécule 7-84) (PTH) ont été déterminés par un dosage immunologique chimioluminescent automatisé (DiaSorin, Italie), les concentrations d’albumine sérique par la méthode du vert de bromocrésol et la protéine C-réactive de haute sensibilité par un dosage immunoenzymatique chimioluminescent en phase solide (auto-analyseur Immulite, Diagnostic Product Corporation, New York, États-Unis).
Caractéristiques cliniques et biochimiques de l’ensemble des patients et des sous-groupes en fonction des valeurs anormalement élevées de GGT ou d’ALP.
| Total | GGT et ALP normales | Hauts. GGT | Haute ALP | GGT et ALP simultanément élevées | P* | |
|---|---|---|---|---|---|---|
| N patients | 909 | 596 | 141 | 104 | 68 | |
| Âge (années) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 |
| Sexe, masculin/féminin | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 |
| Indice de comorbidité % | ||||||
| Aucun | 31 | 37 | 21 | 29 | 9 | |
| Léger-modérée | 52 | 48 | 63 | 59 | 54 | |
| Sévère | 17 | 15 | 16 | 12 | 37 | |
| Fumeurs actifs, % | 15 | 14 | 21 | 10 | 25 | 0.011 |
| Diabète sucré, % | 39 | 35 | 46 | 41 | 50 | 0.013 |
| Maladie du foie, % | 3 | 2 | 6 | 2 | 10 | |
| Cardiopathie ischémique, % | 16 | 14 | 10 | 16 | 38 | |
| Ischémie du SNC ou périphérique, % | 21 | 19 | 18 | 23 | 34 | 0.031 |
| Insuffisance cardiaque, % | 18 | 16 | 21 | 14 | 37 | |
| IMC, kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5,9) | 0,176 |
| DFGe, mL/min/1,73 m2 | 14,7 (5,1) | 14,8 (5,1) | 14.6 (4,6) | 14,1 (4,4) | 15,6 (6,2) | 0,234 |
| Hémoglobine (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 |
| Acide urique sérique, mg/dL | 7,6 (1,9) | 7,5 (1,9) | 7,9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | |
| Cholestérol total, mg/dL | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 |
| Triglycérides, mg/dL | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 |
| Albumine sérique, g/dL | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 |
| Calcium total sérique, mg/dL | 9,1 (0,8) | 9,2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 |
| Phosphore sérique, mg/dL | 4,7 (1,1) | 4,7 (1) | 4,7 (0,9) | 4,6 (1.2) | 4,6 (1,2) | 0,851 |
| Bicarbonate sérique, mEq/L | 21,4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 |
| PTH, pg/mL | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | |
| ALT, UI/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | |
| GGT, UI/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | |
| ALP, IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | |
| Ferritine sérique, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | |
| Protéine C-réactive, mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | |
| Protéinurie, mg/g de créatinine | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 |
| Inhibiteurs de la rénine-angiotensine, % | 79 | 80 | 78 | 78 | 72 | 0.502 |
| Bêta-bloquants, % | 26 | 25 | 30 | 22 | 35 | 0.140 |
| Diurétiques, % | 60 | 59 | 62 | 60 | 65 | 0.829 |
| Statines, % | 53 | 54 | 53 | 55 | 47 | 0.762 |
| Alopurinol, % | 22 | 22 | 25 | 26 | 13 | 0.200 |
| Analogues de la vitamine D, % | 10 | 10 | 7 | 15 | 9 | 0.201 |
| Agents antiplaquettaires, % | 34 | 33 | 28 | 41 | 38 | 0.124 |
Les données sont présentées sous forme de moyenne (écart-type), sauf indication contraire.
ANOVA ou χ2 entre les groupes.
P0.05 GGT-ALP élevée vs GGT-ALP normale ou ALP élevée, test de Scheffé.
P0,05 GGT élevée vs GGT-ALP normale, test de Scheffé.
P0,0001 ALP élevée vs. chacun des autres sous-groupes, test de Scheffé.
P0,0001 GGT élevée ou GGT-ALP élevée vs. GGT-ALP normale ou ALP élevée, test de Scheffé.
P0,0001 ALP élevée ou GGT-ALP élevée vs. GGT-ALP normale ou GGT élevée, test de Scheffé.
P0,001 GGT élevée ou GGT-ALP élevée vs. GGT-ALP normale ou ALP élevée, test de Scheffé.
Données disponibles sur 845 patients.
La formule MDRD-4 a été utilisée pour estimer le taux de filtration glomérulaire (DFGe).12
La ferritine sérique était le seul paramètre avec des valeurs manquantes. La moyenne des valeurs disponibles a été incluse dans l’analyse descriptive, mais les valeurs manquantes n’ont pas été calculées, et cette variable n’a pas été incluse comme covariable dans l’analyse de survie.
Variable de résultat
La variable de résultat était le décès toutes causes confondues. Les causes de décès ont été classées en 5 groupes : mort subite, cardiovasculaire, infectieuse, maligne et autres causes.
Analyse statistique
Des tests paramétriques ou non paramétriques ont été utilisés pour la comparaison descriptive des variables continues, en fonction de leurs caractéristiques ; et, le test du Khi-deux a été utilisé pour les variables catégorielles. Le test de Pearson a été utilisé pour l’analyse de corrélation bivariée.
Les différences de survie entre les patients selon les quartiles de GGT ou d’ALP ont été analysées à l’aide de courbes de Kaplan-Meier, et comparées à l’aide du test log-rank de Mantel-Haenszel.
Des modèles de risque proportionnel de Cox multivariés ont été utilisés pour analyser l’effet des valeurs initiales de GGT et d’ALP sur le délai de mortalité toutes causes confondues.
Comme les niveaux initiaux de GGT et d’ALP présentaient une distribution biaisée positivement, les valeurs ont été transformées logarithmiquement pour être incluses comme variable continue.
Pour prendre en compte les différentes périodes de recrutement, les modèles multivariés ont également été ajustés en fonction d’une variable catégorielle correspondant aux périodes de recrutement (2002-2005, 2006-2009, 2010-2014).
La GGT et l’ALP ont été analysées comme des variables continues (transformation logarithmique) et comme des variables catégorielles : quartile supérieur et valeurs anormalement élevées (GGT>36IU/L et ALP>120IU/L).
Les modèles de régression suivants ont été inclus : (1) Univarié. (2). Ajusté pour l’âge, le sexe, le score de comorbidité, le diabète, les maladies du foie, le fumeur actif, l’IMC, le DFGe de base et la période de recrutement. (3) Ajusté pour les mêmes variables que dans le modèle 2, plus les taux sériques totaux de calcium, de phosphore, de PTH, d’albumine, de protéine C-réactive, de triglycérides, d’acide urique et d’alanine aminotransférase (ALT). (4) Modèle le mieux ajusté à l’aide du processus d’élimination pas à pas rétroconditionnel.
L’hypothèse de risques proportionnels a été testée à l’aide de courbes log-minus-log et de résidus de Schöenfeld pour chaque variable. Les patients ont été censurés au moment du décès, de la perte de suivi, de la transplantation rénale ou à la fin du suivi (31 décembre 2014), selon la première éventualité.
Les données descriptives sont présentées sous forme de moyenne et d’écart-type, ou de médiane et d’écart interquartile pour les variables continues, et de valeurs absolues et de pourcentages pour les variables catégorielles. A p-value
RésultatsCaractéristiques des patients
Le groupe d’étude comprenait 909 patients en IRC stade 4 ou 5, pré-dialyse (DFGe moyen 14,7±5,1mL/min/1,73m2). L’âge moyen (±SD) était de 65±15 ans, et 53% des patients étaient des hommes. Tous étaient de race blanche. Les caractéristiques cliniques et biochimiques de base sont présentées dans le tableau 1.
Pour analyser les caractéristiques cliniques et biochimiques des patients en fonction de la présence de taux de GGT ou d’ALP anormalement élevés, les patients ont été répartis en quatre sous-groupes (tableau 1) : taux de GGT et d’ALP normaux (66 % des patients), taux de GGT élevé mais ALP normal (16 %), taux de GGT normal mais ALP élevé (11 %) et taux de GGT et d’ALP simultanément élevés (7 %).
Donc, 209 (23%) et 172 (19%) patients présentaient respectivement une GGT et une ALP de base anormalement élevées. La valeur du quartile supérieur pour la GGT et l’ALP était de 34UI/L et 112UI/L, respectivement.
Il n’y avait pas de différence significative dans l’âge moyen et la répartition par sexe entre les sous-groupes. Le score de comorbidité et le pourcentage de fumeurs actifs étaient nettement plus élevés chez les patients présentant une GGT élevée, notamment dans le groupe présentant simultanément une GGT et une ALP élevées (tableau 1).
Les maladies du foie étaient des comorbidités rares dans cet ensemble de patients. Cependant, environ 8 % des patients présentant des niveaux élevés de GGT avaient été diagnostiqués avec une maladie du foie.
La prévalence des maladies cardiovasculaires chez les patients présentant soit une GGT élevée soit une ALP élevée était similaire à celle des patients présentant des valeurs normales de GGT et d’ALP, cependant cette prévalence des maladies cardiovasculaires était significativement augmentée chez les patients présentant simultanément une GGT et une ALP élevées.
Des différences significatives ont été observées dans les paramètres biochimiques entre les sous-groupes (tableau 1). Les patients présentant une GGT élevée avaient des concentrations sériques d’acide urique, de triglycérides, d’ALT, de ferritine et de CRP plus élevées que les patients présentant des niveaux normaux de GGT et d’ALP, ou une ALP élevée seule. Le sous-groupe de patients présentant uniquement un taux élevé d’ALP avait des taux de PTH plus élevés. Les valeurs moyennes d’albumine de base étaient similaires entre les sous-groupes.
Ces profils biochimiques associés à la GGT ou à l’ALP ont été confirmés par une analyse de corrélation bivariée (tableau 2).
Coefficients de corrélation entre les paramètres biochimiques.
| Log GGTa | Log ALPb | Haemoglobine | Acide urique | Triglycérides | ALT | Phosphore | Calcium | Ferritine | Albumine | PTH | Protéine C-réactive | eGFR | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | |||||||||||||
| Log ALPb | 0.337** | ||||||||||||
| Haemoglobine | -0.001 | 0.029 | |||||||||||
| Acide urique | 0.162** | 0.051 | 0.068* | ||||||||||
| Triglycérides | 0,164** | 0.011 | 0,063 | 0,083* | |||||||||
| ALT | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | ||||||||
| Phosphore | -0,013 | 0,024 | -0.092* | 0,075* | 0,020 | 0,026 | |||||||
| Calcium | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0,014 | -0,178** | ||||||
| Ferritine | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0,043 | |||||
| Albumine | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | ||||
| PTH | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0,072* | |||
| Protéine C-réactive | 0,197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0,077* | ||
| eGFR | 0,080* | -0,028 | 0,163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0,054 | |
| Protéinurie | 0,098* | 0,131** | -0,055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0,01.
Log-transformé gamma-glutamyl transférase.
Phosphatase alcaline log-transformée.
Mortalité et autres événements d’intérêt
Un total de 365 patients (40%) sont décédés pendant la période d’étude, avec une survie médiane pour l’ensemble des patients de 74 mois (tableau 3). Comme prévu, les causes les plus fréquentes de décès étaient cardiovasculaires et infectieuses, sans différences significatives entre les sous-groupes (tableau 3).
Mortalité et autres variables de résultats d’intérêt dans le groupe dans son ensemble et dans les sous-groupes selon la GGT et la phosphatase alcaline (ALP).
| Total | GGT et ALP normales | GGT élevée. | Haute ALP | GGT et ALP simultanément élevées | |
|---|---|---|---|---|---|
| Durée médiane de survie , mois | 74 | 86 | 61 | 82 | 38 |
| Décès , N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) |
| Cause du décès, N (%) : | |||||
| Soudaine | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) |
| Cardiovasculaire | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) |
| Infectieux | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) |
| Malignité | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) |
| Autres | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) |
| Dialyse, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) |
| Greffe rénale, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) |
| Perte de suivi, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) |
Pendant la période de suivi, 58% des patients ont dû commencer une dialyse et 15% ont reçu une greffe rénale (il n’y a pas eu de greffe préemptive). Aucune différence n’a été observée entre les sous-groupes en ce qui concerne le pourcentage de patients qui ont commencé une dialyse, ont subi une transplantation ou ont été perdus de vue (tableau 3).
La gamma-glutamyl transférase et la phosphatase alcaline comme déterminants de la survie
Les figures 1 et 2 montrent les courbes de survie de Kaplan-Meier en fonction des quartiles de distribution de fréquence des valeurs GGT et ALP, respectivement. Les patients présentant des taux élevés de GGT ou d’ALP (quartiles supérieurs) avaient une moins bonne survie.
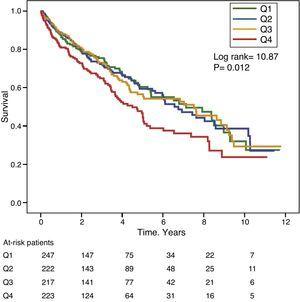
Courbes de survie de Kaplan-Meier selon les quartiles de distribution de fréquence des taux sériques de GGT (Q, quartiles).
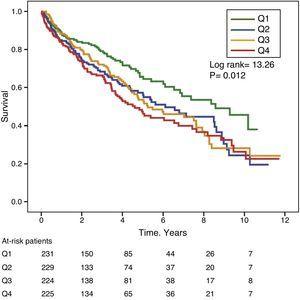
Courbes de survie de Kaplan-Meier selon les quartiles de distribution de fréquence des taux sériques d’ALP. (Q=quartiles).
En utilisant les modèles de régression de Cox, la GGT en tant que variable continue ou catégorielle (quartile supérieur ou valeur sérique >36IU/L) était significativement associée à une mortalité accrue dans les modèles analysés (tableau 4). L’ALP était également associée de manière significative et indépendante à une augmentation de la mortalité dans tous les modèles analysés, sauf si l’ALP était incluse dans le modèle le mieux ajusté en tant que variable catégorielle définie comme la valeur du quartile supérieur. Dans ce modèle, le degré d’association de l’ALP avec la mortalité n’a pas atteint la signification statistique (P=0,052) (tableau 4).
Modèles de régression deox de l’association avec la mortalité.
| Variable | HR univarié (IC 95 %) | Modèle multivarié 1a HR (95 %. CI) | Modèle multivarié 2b HR (95% CI) | Modèle multivarié 3c HR (95% CI) |
|---|---|---|---|---|
| Log-GGT transformée logarithmique | 1.310 (1,154-1,489) P0,0001 |
1,260 (1,095-1,449) P0,0001 |
1,174 (1,005-1,371) P=0.042 |
1,166 (1,010-1,347) P=0,036 |
| GGT quartile supérieur | 1,459 (1,163-1,829) P=0,001 |
1,415 (1,119-1.788) P=0,004 |
1,329 (1,036-1,705) P=0,025 |
1,315 (1,064-1,714) P=0,013 |
| GGT>36IU/L | 1.513 (1,202-1,905) P0,0001 |
1,509 (1,185-1,923) P=0,001 |
1,393 (1,078-1,800) P=0,011 |
1,390 (1,089-1,779) P=0.009 |
| ALP log-transformée | 1,635 (1,278-2,093) P0,0001 |
1,479 (1,149-1,904) P=0,002 |
1,395 (1.061-1,833) P=0,017 |
1,327 (1,008-1,746) P=0,044 |
| ALP quartile supérieur | 1,332 (1,062-1,670) P=0,013 |
1.288 (1,023-1,621) P=0,031 |
1,277 (1,001-1,630) P=0,049 |
1,261 (0,998-1,594) P=0,052 |
| ALP>120IU/L | 1.527 (1,197-1,947) P=0,001 |
1,419 (1,109-1,815) P=0,005 |
1,362 (1,048-1,770) P=0,021 |
1,305 (1,015-1,678) P=0.038 |
Ajusté pour l’âge, le sexe, l’indice de comorbidité, le diabète, le tabagisme, les maladies hépatiques, l’IMC, le DFGe et les périodes d’étude.
Ajusté pour toutes les covariables du modèle 1 plus le calcium, le phosphore, la PTH, l’acide urique, les triglycérides, l’ALT, l’albumine et la protéine C-réactive.
Modèle le mieux ajusté qui inclut toutes les variables des modèles 1 et 2 plus GGT ou ALP, avec un processus de sélection automatique des variables.
Le rapport de risque (RR) pour la mortalité chez les patients présentant des taux élevés de GGT (>36IU/L) (RR=1,39) était similaire à celui observé chez les patients présentant des taux élevés d’ALP (>120IU/L) (RR=1,31) dans le modèle entièrement ajusté (tableau 4). La figure 3 montre les courbes de survie de Kaplan-Meier qui illustrent cette association, et l’effet additif sur la survie réduite d’une GGT et d’une ALP élevées simultanément.
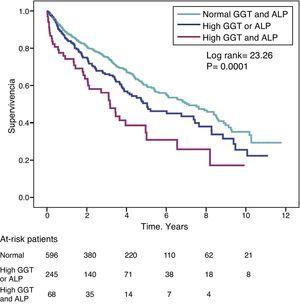
Courbes de survie de Kaplan-Meier chez les patients de l’étude en fonction des taux normaux de GGT et d’ALP, des taux anormalement élevés de GGT ou d’ALP (l’un ou l’autre), et des taux simultanément élevés de GGT et d’ALP.
Pour évaluer l’effet confondant possible d’une comorbidité hépatique sur l’association entre GGT et ALP avec la mortalité, un modèle de régression de Cox a été construit, en excluant 27 patients chez qui une maladie hépatique avait déjà été diagnostiquée. Dans ce modèle ajusté, une GGT élevée (>36IU/L) a maintenu une association statistiquement significative avec la mortalité (HR=1,316 ; 95% CI : 1.016-1.705 ; P=0.03), tandis qu’une ALP élevée (>120IU/L) a montré une association à la limite de la signification statistique (HR=1.296 ; 95% CI : 0.999-1.680 ; P=0.05).
Discussion
Les résultats de la présente étude montrent qu’une GGT ou une ALP sérique élevée est indépendamment associée à une mortalité plus élevée chez les patients atteints d’IRC. Cette étude révèle également pour la première fois que l’élévation simultanée des deux paramètres a un effet additif sur la prédiction de la mortalité, même chez les patients sans maladie hépatique.
Dans cette étude, les patients atteints d’IRC et présentant des niveaux élevés de GGT avaient une plus grande comorbidité, en particulier le diabète et l’insuffisance cardiaque, et un profil biochimique similaire à celui observé dans le syndrome métabolique, bien que l’IMC dans ce sous-groupe ne soit pas différent de celui du reste des patients de l’étude.
Compte tenu de la nature ubiquitaire de l’ALP dans le corps, des niveaux sériques élevés de cette enzyme peuvent être l’expression de différents processus pathologiques. En ce sens, la détermination d’isoenzymes spécifiques de l’ALP peut être utile pour distinguer leur origine dans les cas où des élévations isolées ne peuvent pas être attribuées à un remodelage osseux accru.
La surmortalité signalée chez les patients atteints d’IRC et présentant des taux élevés d’ALP a été attribuée de manière controversée à des effets indésirables cardiovasculaires potentiels résultant d’un manque très sévère de contrôle du métabolisme osseux et minéral.2,3,13,14 Plusieurs mécanismes pathogènes ont été proposés pour expliquer cette association, notamment une augmentation de la calcification vasculaire par hydrolyse du pyrophosphate dans la paroi artérielle15, une inflammation systémique16,17 et une carence en vitamine D18. Cependant, l’absence d’association significative entre les taux sériques de l’isoenzyme de l’ALP dérivée de l’os (ALP spécifique de l’os) et la mortalité chez les patients atteints d’IRC19 soulève de sérieux doutes quant à l’hypothèse d’un lien pathogène avec le métabolisme osseux-minéral.
Dans cette étude, 11 % des patients présentaient des taux élevés d’ALP avec des taux normaux de GGT, et la principale caractéristique de ce sous-groupe était les taux moyens élevés de PTH, ce qui suggère que l’os pourrait être à l’origine de cette élévation de l’ALP. Cependant, des taux élevés d’ALP et de GGT caractérisaient simultanément un sous-groupe de patients présentant un plus grand degré de comorbidité, principalement des maladies cardiovasculaires, et un profil biochimique plus proche de celui des patients présentant uniquement une GGT élevée que de celui des patients présentant uniquement une ALP élevée. Ainsi, deux profils de risque peuvent être distingués chez les patients atteints d’IRC et d’ALP élevée selon la présence ou l’absence de niveaux élevés de GGT. Alors qu’une ALP élevée seule était associée à un risque modéré de mortalité, l’élévation simultanée des deux enzymes était associée à un risque plus élevé de mortalité.
La GGT est l’enzyme responsable de l’hydrolyse du glutathion réduit extracellulaire (GSH), l’un des principaux antioxydants intracellulaires chez les mammifères, permettant aux acides aminés précurseurs d’être ensuite utilisés pour une nouvelle synthèse intracellulaire de GSH6. Ainsi, une augmentation de la GGT est l’expression d’une déplétion intracellulaire en GSH et, par conséquent, la GGT pourrait être considérée comme un marqueur de stress oxydatif.6
La GGT sérique s’est avérée être un biomarqueur cardiométabolique dans la population générale. Diverses études ont mis en évidence une association significative et indépendante entre les taux de GGT et la mortalité cardiovasculaire et toutes causes confondues.20-22 Il a été démontré qu’un taux élevé de GGT est associé à un pronostic plus défavorable en cas de coronaropathie et d’insuffisance cardiaque.23,24 Une implication pathogène possible de la GGT dans la formation de la plaque d’athérome, son érosion et sa rupture ultérieure a également été observée,25 ce qui pourrait contribuer à expliquer sa relation avec la morbidité et la mortalité cardiovasculaires d’un point de vue biologique.
La valeur prédictive de la GGT chez les patients atteints d’IRC a rarement été étudiée. Postorino et al.9 ont observé une association forte et indépendante entre des taux élevés de GGT et la mortalité totale et cardiovasculaire chez 584 patients IRC sous dialyse. Cependant, les concentrations sériques d’ALP n’ont pas été déterminées dans cette étude.
Dans une autre étude, des taux élevés de GGT ont été associés à un dysfonctionnement endothélial marqué chez des patients atteints d’IRC, ce qui suggère un lien entre des taux élevés de ce marqueur et le risque de maladie cardiovasculaire.10
En plus d’un possible effet pro-oxydant systémique, d’autres hypothèses pourraient contribuer à expliquer l’association entre des taux élevés de GGT et la mortalité chez les patients atteints d’IRC. Ainsi, une GGT élevée pourrait simplement indiquer un abus d’alcool ou des maladies du foie, comorbidités qui justifieraient la mortalité excessive. Cependant, dans cette étude, la GGT a maintenu une association significative avec la mortalité après avoir exclu les patients souffrant d’alcoolisme chronique, de maladies hépatiques chroniques ou d’infections par des virus hépatotropes, ce qui exclut le rôle exclusif des maladies hépatiques dans cette association.
Néanmoins, la maladie du foie gras et la maladie hépatique congestive sont deux troubles hépatiques subcliniques qui peuvent provoquer des taux élevés de GGT.26,27 La stéatose hépatique est une découverte relativement courante chez les patients atteints d’IRC, et elle est plus étroitement liée aux facteurs de risque cardiovasculaire qu’au développement de complications hépatiques.27 Les caractéristiques cliniques et biochimiques associées à la stéatose hépatique sont similaires à celles observées dans le sous-groupe de patients de notre étude présentant des GGT élevées. Cependant, dans cette étude, le diagnostic de la maladie du foie gras n’a pas été étudié de manière adéquate chez la plupart des patients et il n’est donc pas possible de garantir que la GGT élevée était principalement due à cette maladie.
La maladie hépatique congestive fait référence à un spectre d’anomalies hépatiques attribuées à la congestion passive secondaire à une insuffisance cardiaque droite ou à toute cause qui augmente la pression veineuse centrale, y compris la surcharge volumique, l’hypertension pulmonaire sévère ou les valvulopathies28. Des taux sériques élevés de GGT ou d’ALP sont des anomalies biochimiques caractéristiques chez les patients atteints d’IRC présentant une dysfonction diastolique ventriculaire gauche, surtout s’ils sont associés à une congestion pulmonaire,29 qui est également un facteur de risque reconnu de mortalité chez ces patients.30
Une GGT élevée peut également refléter l’induction d’enzymes microsomales.31 Outre la prise d’alcool, de nombreux médicaments peuvent induire des enzymes hépatiques. Dans cette étude, aucun des médicaments les plus couramment prescrits chez les patients atteints d’IRC n’était significativement associé à des taux élevés de GGT ou d’ALP, bien que l’on ne puisse pas exclure l’effet potentiel des médicaments en vente libre (en particulier les analgésiques) sur les taux élevés de GGT chez nos patients.
Cette étude présente une série de limites. Compte tenu de sa conception rétrospective, les relations de causalité n’ont pas pu être établies. L’étude a été menée sur un seul site, et la cohorte étudiée, bien que représentative de la population locale, était ethniquement homogène (caucasienne). La GGT et l’ALP n’ont pas été analysées comme des covariables variant dans le temps et, par conséquent, il est probable que la signification pronostique des augmentations transitoires de la GGT soit différente de celle des augmentations maintenues dans le temps. Cependant, dans cette étude, la détection d’une GGT élevée dans l’analyse transversale à un certain stade de l’IRC était associée à un phénotype clinique de grand intérêt en raison de sa relation avec la comorbidité cardiovasculaire et la mortalité. Enfin, l’ALP spécifique à l’os et d’autres paramètres liés plus spécifiquement au remodelage osseux n’ont pas été mesurés.
En conclusion, un taux anormalement élevé de GGT est une découverte courante chez les patients atteints d’IRC, qui est observée plus fréquemment chez les patients présentant une plus grande comorbidité, en particulier des maladies cardiovasculaires, et qui est indépendamment associée à la mortalité. L’élévation simultanée des taux sériques de GGT et d’ALP augmente le risque de mortalité. Par conséquent, la mesure combinée de la GGT sérique et de l’ALP pourrait offrir des informations prédictives supplémentaires chez les patients atteints d’IRC.
Conflits d’intérêts
Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts.