US Pharm. 2010;35(9):50-58.
L’anémie ferriprive (IDA) est la carence nutritionnelle la plus courante dans le monde.1 L’IDA, qui est causée par une diminution de la teneur totale en fer de l’organisme, se caractérise par des globules rouges hypochromes et microcytaires, qui sont souvent associés à des pertes de sang.1 L’apport en fer aux États-Unis est estimé à moins de 60 % des quantités recommandées chez les tout-petits, les femmes préménopausées et les femmes enceintes. Cet apport insuffisant est suffisant pour entraîner des risques pour la santé.2
Les objectifs de Healthy People 2010 en matière de nutrition et de statut pondéral prévoyaient une réduction de 3 à 4 % de l’ADI chez les enfants, les femmes en âge de procréer et les femmes enceintes.3 Les objectifs globaux de réduction de l’ADI dans ces populations n’ayant pas été atteints en 2010, cet objectif a été conservé dans Healthy People 2020.1,3 L’ADI est évitable et réversible en augmentant la supplémentation en fer ou en réduisant les pertes de fer. Les tout-petits, les femmes préménopausées et les adolescentes sont les plus exposés au risque d’ADI aux États-Unis et dans d’autres pays développés ; cela peut être dû à des préoccupations alimentaires et à des stratégies de prévention et des approches thérapeutiques inadéquates.1,4,5
Un diagnostic de carence en fer doit être envisagé lorsqu’un patient a des antécédents de fatigue chronique ou de perte de sang. Après le diagnostic, il convient d’évaluer la cause sous-jacente et d’élaborer un plan de traitement comprenant le remplacement des réserves de fer ou du sang.
Physiologie
Le fer est distribué dans des pools métaboliques actifs et de stockage. Par rapport aux hommes, les femmes ont des réserves totales de fer corporel plus faibles (2,5 g contre 3 g) en raison d’une taille corporelle plus petite, de niveaux d’androgènes plus faibles et d’une perte chronique de fer par les menstruations, la grossesse et la lactation. Les deux tiers du fer corporel total se trouvent en circulation sous forme d’hème, principalement dans l’hémoglobine érythrocytaire (Hb) ; le tiers restant est stocké dans les tissus et autres cellules sous forme de ferritine et d’hémosidérine.5
Le corps absorbe le fer hémique (présent dans la viande) plus efficacement que le fer non hémique (présent dans les sources végétales). Le fer non hémique alimentaire doit être réduit à l’état ferreux et libéré des aliments par les sécrétions gastriques acides. La co-ingestion de certains aliments, tels que les fibres végétales, le son et le thé, réduit de manière significative l’absorption totale du fer non héminique ; cependant, l’acide ascorbique et le jus d’agrumes améliorent l’absorption.5
Les adultes consommant un régime américain typique contenant 15 mg de fer alimentaire n’absorbent que 1 mg de fer. Les femmes préménopausées et les adolescentes ont des besoins de remplacement quotidiens plus élevés en raison des pertes sanguines menstruelles. L’absorption du fer augmente pendant les périodes de déplétion, bien que l’absorption augmente rarement à plus de 6 mg/jour à moins que du fer supplémentaire ne soit ajouté.5
Diagnostic
L’AID est suspecté chez les patients qui présentent une anémie microcytaire. Le taux normal de fer sérique chez les femmes est de 60 mcg/dL à 140 mcg/dL. La capacité totale de fixation du fer est de 250 mcg/dL à 450 mcg/dL. Les patients qui prennent du fer par voie orale peuvent avoir un taux de fer sérique normal malgré une carence totale en fer de l’organisme ; dans ces circonstances, un test valide nécessite l’arrêt du traitement par fer pendant 24 à 48 heures avant de mesurer les valeurs sériques.6
La concentration de ferritine sérique est en étroite corrélation avec les réserves totales de fer de l’organisme. La fourchette de la ferritine normale dans la plupart des laboratoires est de 30 ng/mL à 300 ng/mL, et la moyenne est de 49 ng/mL chez les femmes. La National Health and Nutrition Examination Survey décrit la carence en fer chez les femmes comme une faible concentration de ferritine (<12 ng/mL).1
Le diagnostic amène à considérer la cause de l’AID (généralement, une hémorragie). Les femmes présentant une perte de sang évidente – les menstruations – peuvent ne pas nécessiter de tests supplémentaires. Les femmes ménopausées sans perte de sang évidente devraient subir une évaluation du tractus gastro-intestinal (GI) car l’anémie peut être la seule indication d’un cancer GI occulte.6
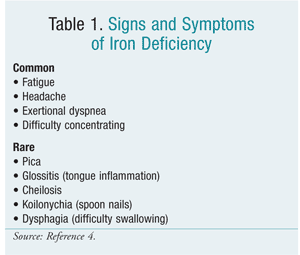
Les patients atteints d’AID peuvent ne pas présenter de symptômes jusqu’à ce que leurs réserves en fer soient sévèrement épuisées. Les patients anémiques peuvent se plaindre de fatigue à l’effort limité, de maux de tête, d’essoufflement ou de difficultés de concentration.6 Voir le TABLEAU 1 pour une liste de signes et de symptômes.
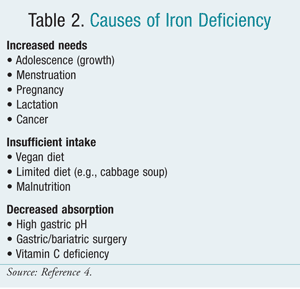
Causes de la carence en fer
Les besoins quotidiens en fer des adolescentes et des femmes préménopausées sont d’environ 20 mg de fer élémentaire. Cependant, cette quantité n’est souvent pas atteinte car l’absorption des sources alimentaires est limitée par la capacité d’absorption de l’intestin. Une carence en fer se produit facilement en raison de pertes régulières de fer, d’une augmentation des besoins ou d’une diminution des apports. Chez les femmes préménopausées, les pertes sanguines menstruelles cumulées sont une cause fréquente. La carence en vitamine C peut contribuer à l’AID en produisant une fragilité capillaire, une hémolyse et des saignements.7 Le TABLEAU 2 énumère les causes de la carence en fer.
Régime végétalien : On pense que les femmes qui ne consomment pas de protéines animales présentent un risque plus élevé d’IDA en raison de l’ingestion de fer alimentaire uniquement non héminique et de l’apport accru d’inhibiteurs de l’absorption du fer (phytates, tanins, fibres). Les principales sources alimentaires de fer pour les végétaliens sont les céréales, les haricots secs, les légumes et les fruits secs. Haddad et ses collègues ont étudié un petit groupe de végétaliens et de non-végétariens établis ainsi que leurs apports en divers nutriments et ont mesuré les différences de marqueurs hématologiques et autres marqueurs biochimiques.7 L’apport en fer provenant de l’alimentation et des compléments était similaire entre les groupes. Les femmes végétaliennes avaient un apport plus élevé en acide ascorbique, qui améliore l’absorption du fer. Les femmes végétaliennes et non végétariennes ne présentaient pas de différence au niveau des marqueurs hématologiques, notamment l’Hb, l’hématocrite et la ferritine. Un nombre similaire de femmes dans les deux groupes présentait des taux de ferritine inférieurs à 12 mcg/L, ce qui suggère qu’une supplémentation peut être nécessaire quel que soit le régime alimentaire. L’étude allemande sur les végétaliens suggère que les femmes végétaliennes ingèrent du fer en quantité suffisante, mais elle a constaté que les femmes de moins de 50 ans présentaient de faibles concentrations de ferritine sérique (14 ng/mL) par rapport aux femmes plus âgées (28 ng/mL).8 Les auteurs suggèrent un supplément de fer pour les jeunes femmes végétaliennes afin d’augmenter l’exposition au fer et de compenser la diminution de l’absorption et l’augmentation des pertes.8
Chirurgie bariatrique : La carence en fer avec ou sans anémie est plus élevée chez les patients subissant une chirurgie bariatrique (30 %-40 %), en particulier lorsque le patient est préménopausé.9 La diminution de la réponse érythropoïétique due à l’inflammation, la perte de sang due à la chirurgie, la réduction de la consommation de viande et la malabsorption postopératoire du fer et de la B12 peuvent encore augmenter le risque d’IDA chez les patients subissant une chirurgie bariatrique. L’évaluation et le traitement des réserves en fer réduites devraient avoir lieu avant la chirurgie. Une supplémentation orale en fer doit être administrée pendant une durée et à une dose suffisantes pour ramener les réserves corporelles à des niveaux normaux. En raison de la diminution de la réponse érythropoïétique et de la diminution de l’absorption gastro-intestinale chez certains patients souffrant d’obésité chronique, des agents stimulant l’érythropoïèse peuvent être administrés si le fer oral administré pendant plusieurs semaines ne parvient pas à augmenter l’Hb ou d’autres marqueurs hématopoïétiques.10 La substitution ferrique IV s’est avérée efficace pour augmenter l’Hb chez les patients ayant subi une chirurgie bariatrique postopératoire et présentant des réserves en fer réduites.9,11,12 Mechanick et ses collègues recommandent un apport quotidien de 40 mg à 65 mg de fer élémentaire avec de la vitamine C pour les patients ayant subi une intervention bariatrique de type malabsorptif ou combiné, suivi d’une surveillance continue des taux de fer et de ferritine pour permettre l’ajustement de la dose ou de la voie d’administration.12
Interactions médicamenteuses : L’utilisation des inhibiteurs de la pompe à protons (IPP) a augmenté ces dernières années, notamment depuis qu’ils sont disponibles sans ordonnance.13 L’acide chlorhydrique présent dans l’estomac dissocie les sels de fer non hémique des aliments ; les sels de fer solubilisés sont ensuite réduits à la forme ferreuse, qui est plus facilement absorbée. L’utilisation à long terme des IPP peut diminuer le fer disponible dans l’alimentation, en raison des modifications de l’acidité de l’estomac. Il n’a pas été démontré qu’un traitement prolongé à l’oméprazole réduisait les réserves de fer chez les patients ayant un régime alimentaire normal.13 Il existe une certaine controverse quant à la malabsorption du fer oral de remplacement lors de l’utilisation d’IPP en cas de carence en fer existante.13,14 Sharma et ses collègues ont rapporté le cas de deux femmes atteintes d’AID dont la réponse au traitement oral de remplacement du fer était diminuée, et qui ont toutes deux répondu au remplacement oral du fer après l’arrêt de l’oméprazole.14
L’utilisation concomitante de produits laitiers, de cholestyramine ou d’antiacides contenant du calcium, de l’aluminium ou du magnésium diminue l’absorption du fer. Les patients doivent prendre des suppléments de fer au moins 2 heures avant ou après avoir consommé ces produits.11
Adolescence : Les filles âgées de 15 à 18 ans ont besoin de fer supplémentaire pour augmenter le tissu maigre, augmenter le volume sanguin et remplacer les pertes sanguines menstruelles. Leurs besoins en fer peuvent être deux fois plus importants que ceux d’une femme adulte.15 A l’adolescence, l’obésité peut être liée à une carence en fer accrue. Pinhas-Hamiel et ses collègues ont observé que 39 % des enfants obèses (indice de masse corporelle >97e percentile) âgés de 10 à 18 ans et 12 % des enfants en surpoids (IMC 85e-97e percentile) présentaient une carence en fer, mesurée par des taux sériques de fer plus faibles, par rapport à leurs homologues de poids sain (4,4 %).16
Grossesse : Pendant la grossesse, le volume des globules rouges augmente de 30 % et atteint son maximum au milieu du troisième trimestre. Le fœtus en développement a besoin de fer pour sa croissance et la production de sang, et ces besoins supplémentaires en fer peuvent augmenter jusqu’à 1 000 mg de fer élémentaire par jour pendant la grossesse. Les conséquences de l’IDA pendant la grossesse sont une diminution de la capacité intellectuelle et productive et une sensibilité accrue aux infections. Une revue Cochrane sur la supplémentation en fer pendant la grossesse suggère que des taux d’Hb inférieurs à 95 g/l au deuxième et au troisième trimestre peuvent être associés à une prise de poids insuffisante pendant la grossesse, à un faible poids à la naissance et à un accouchement prématuré.17 En cas d’anémie, la dose quotidienne recommandée de fer élémentaire varie de 30 mg à 120 mg. Certaines découvertes plus récentes suggèrent que l’administration hebdomadaire de fer pourrait suffire à améliorer l’utilisation du fer, à augmenter l’observance et à réduire les effets secondaires de la dose quotidienne.18 Les preuves sont insuffisantes pour promouvoir la fourniture systématique de suppléments de fer aux femmes enceintes non anémiques.17
Soares et ses collègues ont comparé les réserves de fer et la prévalence de l’AID chez des adolescentes nullipares (n = 61) et des femmes adultes (n = 122) pendant la grossesse et le post-partum.18 Toutes les participantes ont reçu un supplément de fer de 40 mg/jour avec de l’acide folique. L’indice de saturation de la transferrine et les niveaux moyens de ferritine étaient plus faibles chez les adolescentes (âgées de 10 à 19 ans) en fin de grossesse et avant l’accouchement, par rapport aux adultes. La carence en fer était moins fréquente chez les adultes. Cela peut être dû à des réserves de fer réduites avant la grossesse dans la population adolescente.
Lactation : La quantité de fer excrétée dans le lait maternel ne semble pas dépendre du statut en fer de la mère. Les femmes sont encouragées à continuer à prendre des vitamines prénatales contenant du fer pendant l’allaitement. Les prématurés, les nourrissons de faible poids, les nourrissons souffrant de troubles hématologiques et ceux dont les réserves en fer sont insuffisantes à la naissance ont généralement besoin d’un supplément de fer avant l’âge de 6 mois. Les nourrissons allaités à terme et ne présentant pas d’affection sous-jacente doivent recevoir des aliments supplémentés en fer à partir de l’âge de 6 mois.19
Maintien de réserves en fer saines
Un régime alimentaire varié et adéquat en fer est recommandé pour tous. Les personnes qui ne consomment pas de protéines animales doivent être encouragées à consommer des aliments à plus forte teneur en fer – légumes à feuilles sombres, haricots secs, noix, pruneaux, raisins secs et figues séchées, céréales enrichies, céréales complètes – en association avec du jus d’agrumes ou d’autres aliments riches en acide ascorbique pour améliorer l’absorption. L’absorption du fer est réduite en cas de consommation simultanée de thé, de fibres et d’aliments riches en calcium.8
Remplacer les réserves de fer
Oral : Si le régime alimentaire seul est insuffisant pour maintenir les réserves de fer et que le patient présente des signes et des valeurs de laboratoire compatibles avec une carence en fer avec ou sans anémie, un supplément de fer oral peut être recommandé. Si la carence en fer est causée par une maladie sous-jacente ou une hémorragie gastro-intestinale, il faut en traiter la cause.16,18
Les suppléments de fer oraux sont disponibles sous forme de sels ferreux – fumarate, gluconate, glutamate, lactate, succinate et sulfate – en comprimés ou sous forme liquide. Ces différents types de sels de fer sont absorbés de manière similaire. Le dosage doit être exprimé en milligrammes de fer élémentaire pour éviter toute confusion entre les différentes formes de sel. Pour délivrer 18 mg de fer par jour à travers la paroi intestinale (à 10 % d’absorption), une dose de remplacement typique pour une personne atteinte d’AID serait de 60 mg de fer élémentaire trois fois par jour. Un comprimé de 325 mg de sulfate ferreux contient 65 mg de fer élémentaire ; un comprimé de 300 mg de gluconate ferreux contient 36 mg de fer élémentaire, ce qui nécessite deux fois plus de comprimés pour obtenir la même dose.4,5
Les formulations de comprimés de fer sont non entériques ou entériques et à libération immédiate ou prolongée. Les comprimés à enrobage entérique et à libération prolongée sont mieux tolérés et doivent être libérés dans le duodénum pour être absorbés efficacement. Le fer libéré dans l’estomac n’est pas aussi bien toléré. Si le fer est libéré sous le duodénum, l’absorption est moindre et le traitement sera inefficace. Essayer un produit sans enrobage entérique et refaire des tests de marqueurs sériques du fer serait l’étape suivante si les comprimés à libération prolongée et à enrobage entérique n’augmentent pas suffisamment les réserves de fer.4
Parentérale : Le fer parentéral peut être administré lorsque le traitement par fer oral a échoué en raison d’une malabsorption ou d’une intolérance sévère aux produits oraux. Les produits de fer parentéraux actuellement disponibles aux États-Unis comprennent le fer dextran, le gluconate ferrique de sodium et le sucrose de fer. Ces produits diffèrent par leur taille moléculaire, leur biodisponibilité, leur profil d’effets secondaires et leur coût. Les principales préoccupations concernant le fer parentéral sont son potentiel de surcharge de la capacité de fixation du fer de l’organisme et le potentiel de réactions au fer libre entraînant un dysfonctionnement immunitaire systémique.9
Les patients doivent être surveillés 5 à 10 jours après le début de la substitution en fer pour observer la réponse à tout supplément. Une fois la réponse documentée, le statut en fer doit être surveillé pour assurer la conformité au régime thérapeutique et pour déterminer si les valeurs normales en fer ont été rétablies. La thérapie au fer doit être poursuivie jusqu’à ce que les réserves corporelles totales soient reconstituées.9
Effets secondaires potentiels de la thérapie au fer
Le fer oral aux doses prescrites pour traiter l’IDA a été associé à des effets secondaires gastro-intestinaux tels que nausées, vomissements, constipation, diarrhée, selles de couleur foncée et détresse abdominale. Les préparations liquides à base de fer peuvent tacher les dents.20
L’administration de fer par voie parentérale peut provoquer des modifications de la pression artérielle, des bouffées vasomotrices, des maux de tête, des œdèmes périphériques, des nausées, des crampes musculaires, une coloration de la peau au niveau du site d’injection intramusculaire ou une dyspnée.20
Conclusion
Le DAI chez les adolescentes et les femmes préménopausées est associé à la perte de fer via les menstruations, la grossesse et la lactation. Les habitudes alimentaires ou la chirurgie bariatrique peuvent exposer certaines femmes à un risque élevé d’AID. Les femmes ménopausées présentent généralement le même risque que les hommes du même âge.
Il faut rappeler aux patients qu’un environnement gastrique acide est optimal pour l’absorption. L’absorption sera inhibée par l’utilisation concomitante d’antiacides, d’inhibiteurs de l’histamine 2, d’IPP, de produits laitiers et de cholestyramine. Certains produits contenant des minéraux – calcium, magnésium, phosphate – peuvent également diminuer l’absorption du fer. Les suppléments de fer doivent être pris entre les repas ou au coucher avec du jus d’agrumes pour améliorer l’absorption.
1. Looker AC, Cogswell ME, Gunther EW. Carence en fer–États-Unis, 1999-2000. MMWR Weekly. 2002;51:897-899.
2. Kennedy E, Meyers L. Dietary Reference Intakes : development and uses for assessment of micronutrient status of women–a global perspective. Am J Clin Nutr. 2005;81:1194S-1197S.
3. Health and Human Services. Healthy People 2020 : nutrition et statut pondéral. NWS HP2020-3 et -4.www.healthypeople.gov/hp2020/Objectives/TopicArea.aspx?id=35&TopicArea=Nutrition+et+Weight+Status. Consulté le 28 mai 2010.
4. Alleyne M, Horne MK, Miller JL. Traitement individualisé de l’anémie ferriprive chez l’adulte. Am J Med. 2008;121:943-948.
5. Zimmermann MB, Hurrell RF. La carence en fer d’origine nutritionnelle. Lancet. 2007;370:511-520.
6. Tefferi A. Anémie chez l’adulte : une approche contemporaine du diagnostic. Mayo Clin Proc. 2003;78:1274-1280.
7. Haddad EH, Berk LS, Kettering JD, et al. Dietary intake and biochemical, hematologic, and immune status of vegans compared with nonvegetarians. Am J Clin Nutr. 1999;70:586S-593S.
8. Waldmann A, Koschizke JW, Leitzmann C, Hahn A. Dietary iron intake and iron status of German female vegans : results of the German Vegan Study. Ann Nutr Metab. 2004;48:103-108.
9. Muñoz M, Botella-Romero F, Gómez-Ramírez S, et al. Carence en fer et anémie chez les patients en chirurgie bariatrique : causes, diagnostic et prise en charge adéquate. Nutr Hosp. 2009;24:640-654.
10. Péneau S, Dauchet L, Vergnaud AC, et al. Relation entre le statut en fer et les fruits et légumes alimentaires en fonction de leur teneur en vitamine C et en fibres. Am J Clin Nutr. 2008;87:1298-1305.
11. Zhu A, Kaneshiro M, Kaunitz JD. Évaluation et traitement de l’anémie ferriprive : une perspective gastro-entérologique. Dig Dis Sci. 2010;55:548-559.
12. Mechanick JI, Kushner RF, Sugerman HJ, et al. American Association of Clinical Endocrinologists, the Obesity Society, and American Society for Metabolic & Bariatric Surgery medical guidelines for clinical practice for the perioperative nutritional, metabolic, and nonurgical support of the bariatric patient. Endocr Pract. 2008;14(suppl 1):1-83.
13. Jensen RT. Conséquences du blocage de la pompe à protons à long terme : perspectives pour les études sur les patients atteints de gastrinomes. Basic Clin Pharmacol Toxicol. 2006;98:4-19.
14. Sharma VR, Brannon MA, Carloss EA. Effet de l’oméprazole sur la substitution orale du fer chez les patients atteints d’anémie ferriprive. South Med J. 2004;97:887-889.
15. Beard JL. Les besoins en fer chez les adolescentes. J Nutr. 2000;130:440S-442S.
16. Pinhas-Hamiel O, Newfield RS, Koren I, et al. Plus grande prévalence de la carence en fer chez les enfants et les adolescents en surpoids et obèses. Int J Obes Relat Metab Disord. 2003;27:416-418.
17. Peña-Rosas JP, Viteri FE. Effets et sécurité de la supplémentation orale préventive en fer ou en fer+acide folique pour les femmes pendant la grossesse. Cochrane Database Syst Rev. 2009 ;(4):CD004736.
18. Soares NN, Mattar R, Camano L, Torloni MR. Anémie ferriprive et réserves en fer chez les femmes adultes et adolescentes en cours de grossesse. Acta Obstet Gynecol Scand. 2010;89:343-349.
19. Gartner LM, Morton J, Lawrence RA, et al. L’allaitement maternel et l’utilisation du lait humain. Pediatrics. 2005;115:496-506.
20. Lexi-Drugs Online .http://online.lexi.com/crlsql/servlet/crlonline. Consulté le 28 juillet 2010.
Pour commenter cet article, [email protected].
.