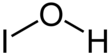
L’acide hypoiodeux est le composé inorganique de formule chimique HIO. Il se forme lorsqu’une solution aqueuse d’iode est traitée avec des sels mercuriques ou d’argent. Il se décompose rapidement par disproportionnement:
|
|||
 |
|||
| Noms | |||
|---|---|---|---|
| Nom IUPAC
Acide hypoïde
|
|||
| Identifiants | |||
|
|||
|
Modèle 3D (JSmol)
|
|||
| ChEBI |
|
||
| ChemSpider |
|
||
|
PubChem CID
|
|||
| unii | |||
| UNII |
|
||
|
Tableau de bord CompTox (EPA)
|
|||
|
|||
|
|||
| Propriétés | |||
| HIO | |||
| Masse molaire | 143.89 g/mol | ||
| Acidité (pKa) | 10.5 (dans l’eau, estimation) | ||
| Base conjuguée | Hypoiodite | ||
|
Sauf indication contraire, les données sont données pour des matériaux dans leur état standard (à 25 °C , 100 kPa).
|
|||
| |
|||
| Références infobox | |||
5 HIO → HIO3 + 2 I2 + 2 H2O
Les hypoiodites des métaux alcalins et alcalino-terreux peuvent être réalisés en solution diluée froide si l’on ajoute de l’iode à leurs hydroxydes respectifs.L’acide hypoiodique est un acide faible avec un pKa d’environ 11. La base conjuguée est l’hypoiodite (IO-). Les sels de cet anion peuvent être préparés en traitant I2 avec des hydroxydes alcalins. Ils se disproportionnent rapidement pour former des iodures et des iodates.