Mécanismes expliquant la régiosélectivité
X2/H2O ou X2/ROH : La régiosélectivité de la formation des halohydrines à partir d’une réaction d’un alcène avec un halogène dans un solvant nucléophile est analogue à la voie d’oxymercuration-démercuration. La molécule d’halogène joue le rôle d’électrophile acceptant les électrons pi nucléophiles de l’alcène tout en formant simultanément une liaison avec l’autre carbone vinylique pour créer un ion bromonium (ou chloroium). La formation de l’ion bromonium (ou chloroium) stabilise la charge positive et empêche le réarrangement du carbocation. Le solvant joue le rôle de nucléophile car il est présent dans un pourcentage beaucoup plus élevé que le groupe partant et réagit avec le carbone le plus substitué de l’ion bromonium (ou chloronium) cyclique pour créer la régiochimie. La stéréochimie de cette réaction est une anti-addition car le solvant s’approche de l’ion bromonium avec une orientation vers l’arrière pour produire le produit d’addition. Cependant, comme l’interaction de l’halogène avec l’alcène peut se produire par le haut ou par le bas, il n’y a pas de contrôle stéréochimique dans cette réaction et un mélange d’énantiomères sera produit le cas échéant. L’étape finale de ce mécanisme est un transfert de proton vers une molécule d’eau du solvant pour neutraliser le produit d’addition.
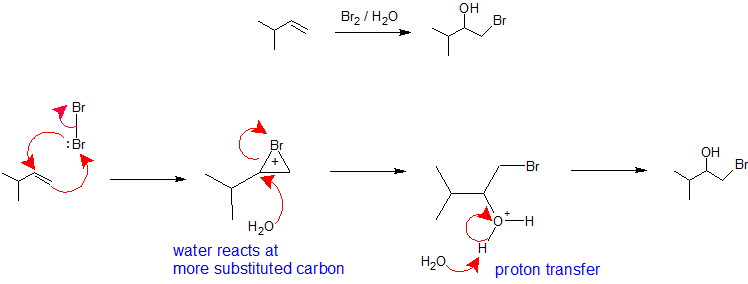
HOX ou RSCl : La régiosélectivité des réactions des acides hypohalogènes et du chlorure de sulfényle peut être expliquée par le même mécanisme que nous avons utilisé pour rationaliser la règle de Markovnikov. La liaison d’une espèce électrophile à la double liaison d’un alcène se forme préférentiellement pour produire le carbocation plus stable (plus fortement substitué). Cet intermédiaire devrait ensuite se combiner rapidement avec une espèce nucléophile pour produire le produit d’addition.
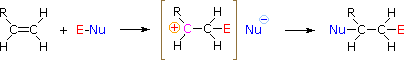
Pour appliquer ce mécanisme, nous devons déterminer la partie électrophile dans chacun des réactifs. En utilisant les différences d’électronégativité, nous pouvons disséquer les réactifs d’addition courants en fractions électrophiles et nucléophiles, comme indiqué sur la droite. Dans le cas des acides hypochloreux et hypobromeux (HOX), ces acides de Brønsted faibles (pKa d’environ 8) ne réagissent pas comme des donneurs de protons ; et puisque l’oxygène est plus électronégatif que le chlore ou le brome, l’électrophile sera un cation halogénure. L’espèce nucléophile qui se lie au carbocation intermédiaire est alors l’ion hydroxyde, ou plus probablement l’eau (le solvant habituel de ces réactifs), et les produits sont appelés halohydrines. Les chlorures de sulfényle s’ajoutent de la manière opposée parce que l’électrophile est un cation de soufre, RS(+), alors que la partie nucléophile est l’anion chlorure (le chlore est plus électronégatif que le soufre).
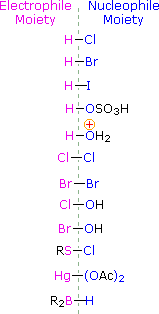
Voici quelques exemples illustrant l’addition de divers réactifs halogènes électrophiles à des groupes alcènes. Remarquez la régiochimie spécifique des produits, comme expliqué ci-dessus.
Exercice
1. Prédisez le produit de la réaction suivante :

2. Lorsque le butène est traité avec le NBS en présence d’eau, le produit montre que le brome se trouve sur le carbone le moins substitué, s’agit-il d’une réaction de Markovnikov ou d’anti-Markovnikov ?
Réponse

2. Comme le brome est la première addition à l’alcène, cette addition serait une addition anti-Markovnikov.
Contributeurs
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professeur émérite (Michigan State U.), Manuel virtuel de chimie organique
.