Triacylglycéride/Phospholipide Stéréochimie
Le glycérol est une molécule achirale, puisque C2 possède deux substituants identiques, -CH2OH. Dans l’organisme, le glycérol peut être chimiquement converti en triacylglycérides et en phospholipides (PL) qui sont chiraux, et qui existent sous une forme énantiomère. Comment cela est-il possible si les deux groupes CH2OH du glycérol sont identiques ? Il s’avère que même si ces groupes sont stéréochimiquement équivalents, nous pouvons les différencier comme suit. Orientez le glycérol avec le OH de C2 vers la gauche. Remplacez ensuite le OH de C1 par OD, où D est le deutérium. Maintenant, les deux substituants alcool sur C1 et C3 ne sont pas identiques et la molécule résultante est chirale. En faisant tourner la molécule de telle sorte que le H sur C2 pointe vers l’arrière, et en attribuant des priorités aux autres substituants sur C2 comme suit : OH =1, DOCH2 =2, et CH2OH = 3, on peut voir que la molécule résultante est en configuration S. Nous disons donc que C1 est le carbone proS. De même, si nous remplaçons le OH de C3 par OD, nous formons l’énantiomère R. Par conséquent, C3 est le carbone proR. C3 est donc le carbone proR. Cela montre qu’en réalité, nous pouvons faire la différence entre les deux substituants CH2OH identiques. Nous disons que le glycérol n’est pas chiral, mais prochiral. (Pensez-y comme le glycérol a le potentiel de devenir chiral en modifiant l’un des deux substituants identiques.)
Figure : Glycérol – Une molécule prochirale
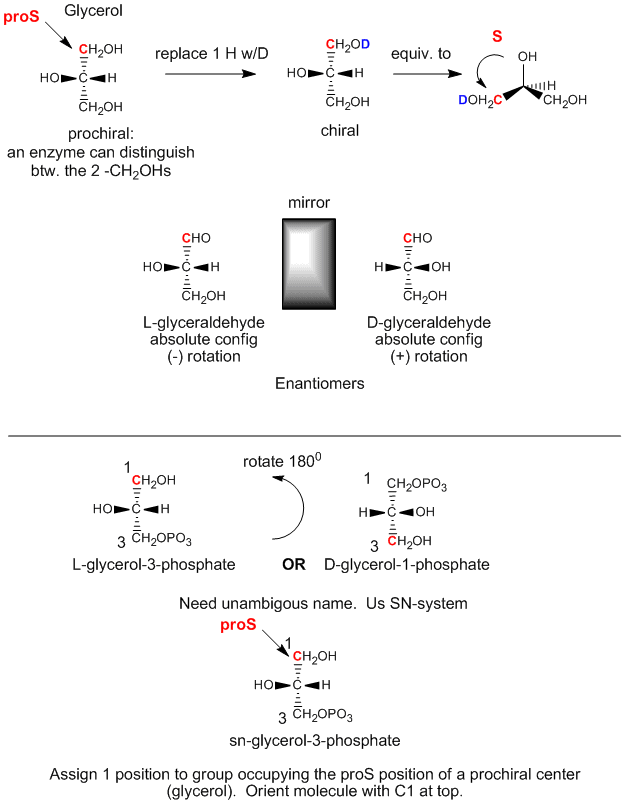
Nous pouvons relier la configuration du glycérol ci-dessus, (lorsque l’OH sur C2 pointe vers la gauche) à la configuration absolue du L-glycéraldéhyde, un sucre simple (un polyhydroxyaldéhyde ou une cétone), un autre dérivé 3C du glycérol. Cette molécule est chirale, le OH du C2 (le seul carbone chiral) pointant vers la gauche. Il est facile de se rappeler que pour tout sucre L, le OH du dernier carbone chiral est orienté vers la gauche. L’énantiomère (isomère miroir) du L-glycéraldéhyde est le D-glycéraldéhyde, dans lequel l’OH sur C2 pointe vers la droite. Les biochimistes utilisent L et D pour la stéréochimie des lipides, des sucres et des acides aminés, au lieu de la nomenclature R,S que vous utilisiez en chimie organique. La désignation stéréochimique de tous les sucres, acides aminés et glycérolipides peut être déterminée à partir de la configuration absolue du L- et du D-glycéraldéhyde.
La première étape de la synthèse in vivo (dans l’organisme) de dérivés chiraux à partir du glycérol achiral implique la phosphorylation du OH sur C3 par l’ATP (un phosphoanhydride de structure similaire à l’anhydride acétique, un excellent agent acétylant) pour produire la molécule chirale phosphate de glycérol. En se basant sur la configuration absolue du L-glycéraldéhyde, et en l’utilisant pour dessiner le glycérol (avec le OH sur C2 pointant vers la gauche), on peut voir que la molécule phosphorylée peut être nommée L-glycérol-3-phosphate. Cependant, en faisant pivoter cette molécule de 180 degrés, sans modifier la stéréochimie de la molécule, nous ne changeons pas du tout la molécule, mais en utilisant la nomenclature D/L ci-dessus, nous nommerions la molécule tournée D-glycérol-1-phosphate. On ne peut pas donner deux noms différents à la même molécule. C’est pourquoi les biochimistes ont développé le système de numérotation stéréospécifique (sn), qui attribue la position 1 d’une molécule prochirale au groupe occupant la position proS. En utilisant cette nomenclature, nous pouvons voir que la molécule chirale décrite ci-dessus, le glycérol-phosphate, peut être nommée sans ambiguïté sn-glycérol-3-phosphate. Le substituant hydroxyle sur le carbone proR a été phosphorylé.
Figure : La synthèse biologique des triacylglycérides et de l’acide phosphatidique à partir du glycérol prochiral
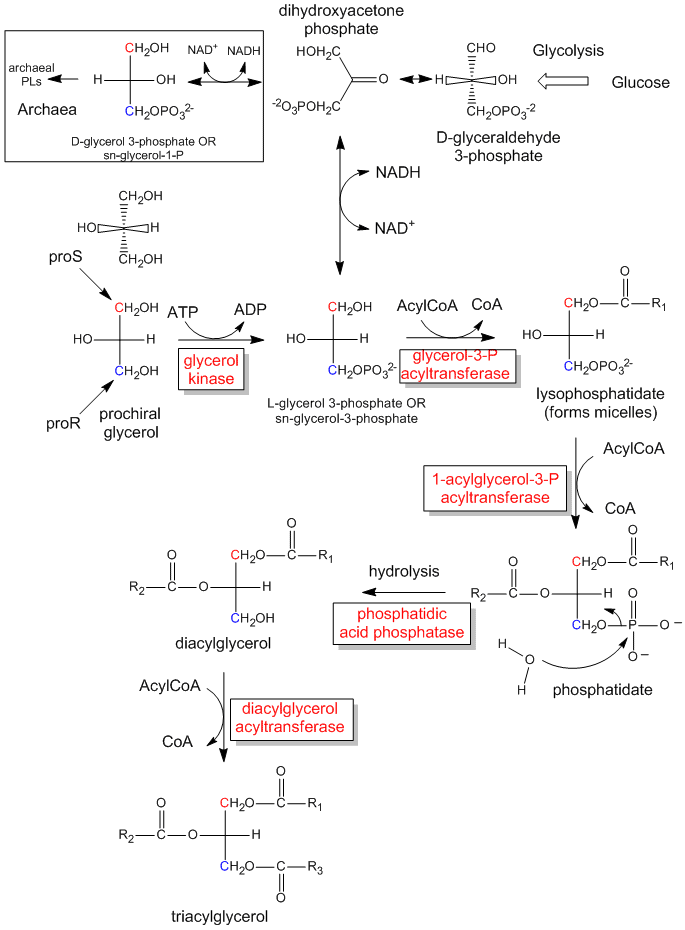
La phosphorylation enzymatique du glycérol prochiral sur OH du carbone proR pour former le sn-glycérol-3-phosphate est illustrée dans le lien ci-dessous. Comme nous avons pu différencier les 2 substituts CH2OH identiques comme contenant soit les carbones proS ou proR, l’enzyme le peut aussi. L’enzyme peut différencier des substituants identiques sur une molécule prochirale si la molécule prochirale interagit avec l’enzyme en trois points. Un autre exemple de système réactif/enzyme prochiral concerne l’oxydation de la molécule prochirale éthanol par l’enzyme alcool déshydrogénase, dans laquelle seul le H proR des 2 H sur C2 est retiré. (Nous en discuterons plus tard.)
Figure : Comment une enzyme (glycérol kinase) transfère un PO4 de l’ATP au proR CH2OH du glycérol lors de la formation des triacylglycérols chiraux et de l’acide phosphatidique.
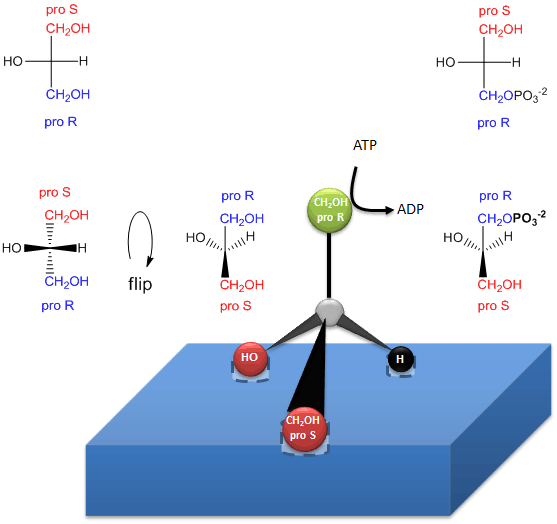
.