Das XeF4 oder Xenontetrafluorid ist eine chemische Verbindung, die aus Xenon- und Fluoridatomen besteht. Es ist die erste binäre Verbindung der Welt, die entdeckt wurde. Es ist eine Art Edelgas mit der chemischen Gleichung
Xe +2 F2 -> XeF4
Das XeF4 hat ein festes weißes Aussehen und eine Dichte von 4,040 g cm-3 in fester Form. Unter gewöhnlichen Bedingungen erscheint es als farbloses Kristallin. Es hat eine ausgezeichnete Temperatur von 115,7 Grad Celsius oder 240,26 Grad Fahrenheit. Wie die anderen Xenonfluoride bildet sich auch Xenontetrafluorid exergonisch. Bei normaler Temperatur und normalem Druck bleibt es in stabilem Zustand. Es reagiert sofort mit Wasser und setzt molekularen Sauerstoff, Fluorwasserstoff und reines Xenongas frei.
| Name des Moleküls | Xenon-Tetrafluorid (XeF4) |
| Anzahl der Valenz Elektronen im Molekül | 36 |
| Hybridisierung von XeF4 | sp3d2 Hybridisierung |
| Bindungswinkel | 90 Grad und 180 Grad |
| Molekulare Geometrie von XeF4 | Quadratisch planar |
Um mehr über seine physikalischen und chemischen Eigenschaften zu erfahren, muss man seine Lewis-Struktur und Molekülgeometrie kennen. Wir wollen die Lewis-Struktur von Xenontetrafluorid herausfinden.
Um die Lewis-Struktur zu erstellen, müssen wir die Valenzelektronen von XeF4 kennen, um seine Struktur zu erstellen und die Anordnung der Atome im Molekül zu kennen.
Inhalt
XeF4 Valenzelektronen
In diesem Molekül haben wir ein Xenonatom und vier Fluoratome. Wir berechnen die Valenzelektronen dieser beiden Atome, um die Gesamtzahl der Valenzelektronen von XeF4 zu bestimmen.
Valenz-Elektronen von Xenon = 8
Valenz-Elektronen von Fluor = 7*4 (da es vier Fluor-Atome gibt, multiplizieren wir es mit 4)
Gesamtzahl der Valenzelektronen von Xef4: 8 + 7*4
: 8 + 28
: 36
Es gibt also insgesamt 36 Valenzelektronen in XeF4.
Lewis-Struktur von XeF4
Nachdem wir nun die Valenzelektronen von Xenontetrafluorid kennen, wird es für dich einfacher sein, seine Lewis-Struktur zu zeichnen. Diese Lewis-Punktstruktur ist eine bildliche Darstellung der Valenzelektronen um die einzelnen Atome in einem Molekül zusammen mit der Bindung, die sie bilden.
Die Bindungen in der Struktur werden durch Linien dargestellt, während die Elektronen, die nicht an der Bindungsbildung beteiligt sind, als Punkte dargestellt werden. Elektronen, die keine Bindung ausbilden, nennt man nichtbindende Elektronen oder einsame Elektronenpaare.
Da Xenon das am wenigsten elektronegative Atom ist, platzieren wir es in der Mitte und alle anderen Fluoratome um es herum wie folgt:

Nachdem wir nun alle Atome platziert haben, zeigen wir die Bindungen zwischen jedem Fluor- und Xenonatom. Jede Bindung im Molekül nimmt zwei Elektronen auf, und da es vier Einfachbindungen in diesem Molekül gibt, sind 8 von 36 Elektronen verbraucht.
Beginnen Sie mit der Platzierung der restlichen Valenzelektronen um die Atome herum. Jedes Fluoratom wird sechs Valenzelektronen um sich herum haben, da ein Elektron zur Herstellung der Bindung verwendet wurde.
Sie werden feststellen, dass wir bereits 24 von 28 Elektronen um die Fluoratome angeordnet haben. Die verbleibenden nicht bindenden Elektronen oder einsamen Elektronenpaare werden auf Xenon platziert, da es eine Ausnahme von der Oktettregel darstellt.
Platziert man diese beiden nichtbindenden Elektronenpaare auf Xenon, so erhält man eine Lewis-Struktur, in der sich zwei einsame Elektronenpaare auf Xenon und sechs nichtbindende Elektronen auf jedem Fluoratom befinden.
XeF4 Hybridisierung
Die Orbitale des zentralen Xenon-Atoms werden hybridisiert, was zur Bildung neuer hybridisierter Orbitale führt. Xenon hat sechs Elektronen in seinen 5p-Orbitalen und zwei Elektronen in 5s-Orbitalen. Im Grundzustand von Xenon befinden sich keine Elektronen in d- und f-Orbitalen. Befindet sich das Atom jedoch in einem angeregten Zustand, wandern zwei Elektronen aus den p-Orbitalen in die d-Orbitale, so dass es insgesamt vier ungepaarte Elektronen gibt. Davon befinden sich zwei in p-Orbitalen und die anderen beiden ungepaarten Elektronen in d-Orbitalen. Diese hybridisierten Orbitale führen zu einer sp3d2-Hybridisierung in XeF4.
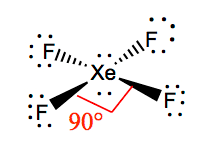
XeF4 Molekulare Geometrie
Es ist einfacher, die molekulare Geometrie eines bestimmten Moleküls zu verstehen, wenn wir seine Lewis-Struktur kennen. Da Xenon zwei einsame Elektronenpaare hat, nimmt es eine Struktur an, die diesen einsamen Paaren hilft, die Abstoßungskräfte zu vermeiden. Um die Abstoßungskräfte so gering wie möglich zu halten, befinden sich die einsamen Paare in einer senkrechten Ebene. Und da es vier Fluoratome gibt, wird das Molekül so angeordnet, dass seine Molekulargeometrie quadratisch ist. XeF4 hat eine oktaedrische Elektronengeometrie, so dass die Molekülgeometrie von Xenontetrafluorid quadratisch planar ist.

XeF4 Bindungswinkel
Die Bindungswinkel von F-Xe-F betragen 90 Grad, und die Winkel der einsamen Paare liegen bei 180 Grad. Die Fluoratome stehen in einem Winkel von 90 Grad zueinander, was zu einer symmetrischen Verteilung der Elektronen in der Ebene des Moleküls führt. Diese Bindungswinkel tragen zur Bildung der quadratischen Molekülgeometrie bei.
XeF4 Polarität – Ist XeF4 polar oder unpolar?
Obwohl die Bindungen zwischen Xenon- und Fluoratomen polar sind, ist XeF4 ein unpolares Molekül. Sie fragen sich wie? Alle Xe-F-Bindungen stehen in Opposition zueinander, so dass die Summe der Dipolmomente gleich Null ist. Das Xenon-Atom verfügt über vier Elektronen, die als nichtbindende Elektronenpaare lokalisiert sind. Da die Gesamtanordnung der Atome und Elektronen im Molekül so ist, dass die Vektorsumme der Dipole Null ist, ist XeF4 ein unpolares Molekül.
Abschließende Bemerkungen
Xenon-Tetrafluorid gehört zu den Molekülen, die relativ leicht zu verstehen sind. Seine Lewis-Struktur ist eine der am wenigsten komplizierten Strukturen, da alle Fluoratome in einem symmetrischen Muster angeordnet sind. Die einsamen Paare im Molekül sind in einer senkrechten Ebene in einer oktaedrischen Form angeordnet, um ihre Abstoßungskräfte auf ein Minimum zu beschränken.
Zusammenfassend kann man sagen, dass XeF4 36 Valenzelektronen hat. Es hat zwei einsame Elektronenpaare, die nicht an das Zentralatom von Xenon gebunden sind. Das Molekül hat eine oktaedrische Elektronengeometrie und eine quadratische Molekulargeometrie. XeF4 ist ein unpolares Molekül und hat eine sp3d2-Hybridisierung.