Abstract
Arsen stimuliert die Proliferation bei niedrigen Konzentrationen und hemmt das Zellwachstum bei hohen Konzentrationen, was eine biphasische Wirkung auf biologische Prozesse zeigt. Die biphasische Wirkung erfordert, dass die Arsenkonzentration auf einem angemessenen Schwellenwert gehalten werden muss, um Krebszellen während der Chemotherapie zu hemmen. Die Apoptose könnte ein primärer Mechanismus sein, der mit den dualen Eigenschaften des Arsens zusammenhängt.
Schlüsselwörter
Arsen, biphasischer Effekt, endemischer Arsenismus, Karzinogenese, Chemotherapie
Highlights
- Arsen ist ein Karzinogen, das die Zellproliferation bei niedrigen Konzentrationen stimulieren kann.
- Außerdem ist Arsen ein Krebsunterdrücker, der in hohen Konzentrationen das Zellwachstum hemmt.
- Die biologische Rolle des Arsens zeigt eine zweiphasige Wirkung auf das Zellwachstum.
- Apoptose könnte ein möglicher Mechanismus sein, der mit den dualen Eigenschaften des Arsens zusammenhängt.
Kommentar
Das Element Arsen (As) ist in der Natur weit verbreitet und wird oft mit Sauerstoff oder Schwefel kombiniert, um Verbindungen zu bilden. Arsen ist auch eng mit biologischen Prozessen verbunden. Seine pathophysiologischen Eigenschaften sind in den folgenden Aspekten enthalten: (a) Arsen in niedriger Dosierung stimuliert die Zellproliferation und die Karzinogenese. Als Natriumarsenit zur Behandlung menschlicher HepG2-Krebszellen oder nicht-tumoröser HHI-5-Hepatozyten verwendet wurde, stellten wir fest, dass der Prozentsatz des Zelltods in der Anfangsphase negativ war, was bedeutet, dass niedrig dosiertes Arsenit das Zellwachstum fördert (Abbildung 1). Das Arsenit konnte die Lebensfähigkeit der Zellen in einem engen Bereich niedriger Konzentrationen erhöhen. Als die Arsenitkonzentration erhöht wurde, um einen kritischen Punkt zu erreichen, begann es, die Proliferation zu hemmen und den Zelltod zu beschleunigen. Das gleiche Ergebnis wurde auch in anderen Studien festgestellt. In verschiedenen geologischen Regionen übersteigt die Arsenkonzentration im Trinkwasser den von der Weltgesundheitsorganisation empfohlenen Standardgehalt (0,01 mg/L). Anwohner, die das mit Arsen angereicherte Wasser trinken, leiden an endemischem Arsenismus. Die Häufigkeit von Krebserkrankungen verschiedener Organe (z. B. Haut, Lunge, Niere, Harnblase, Leber usw.) ist in den endemischen Gebieten deutlich höher als in den nicht endemischen Regionen. Arsen wurde von der Internationalen Agentur für Krebsforschung als krebserregend für den Menschen eingestuft; (b) eine hohe Arsenkonzentration hemmt das Zellwachstum. In der klinischen Praxis werden Arsenverbindungen (z. B. As2O3, As2S2 usw.) häufig verwendet, um Krebszellen während der Chemotherapie abzutöten. Darüber hinaus ist Arsenid das Mittel der ersten Wahl bei der Behandlung einiger Krebsarten wie Leukämie und soliden viszeralen Neoplasien. Manchmal werden die Arsenverbindungen in Kombination mit anderen Arzneimitteln eingesetzt, um die beste therapeutische Wirkung zu erzielen. Das Arsenid induziert nicht nur die Tumorentwicklung, sondern tötet auch Krebszellen als Basismedikament in der klinischen Behandlung. Arsen hat die doppelte Eigenschaft eines Karzinogens und eines Krebsunterdrückers. Daher wird ein neues Konzept „biphasischer Effekt“ vorgeschlagen, um seine bidirektionale Rolle beim Zellwachstum zu beschreiben.
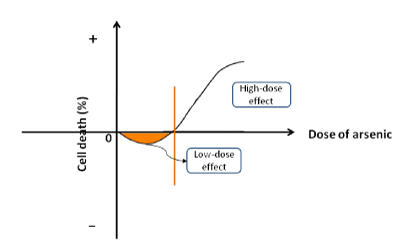
Abbildung 1. Schematische Darstellung des biphasischen Effekts. Arsen stimuliert die Zellproliferation bei niedrigen Dosen, während es bei hohen Konzentrationen den Zelltod beschleunigt
Was ist der genaue Mechanismus, der zu den dualen Eigenschaften des Arsens führt? Derzeit gibt es keine klare Antwort auf diese Frage. Die verfügbaren Daten sprechen jedoch dafür, dass die Apoptose eine entscheidende Rolle spielt. Die Apoptose ist ein gengesteuerter, energieaufwändiger, selbstmörderischer Prozess zur Erhaltung der Gewebestruktur. Das Gleichgewicht zwischen apoptotischen und anti-apoptotischen Kompetenzen bestimmt nicht nur die Lebensfähigkeit der Zellen, sondern wirkt sich auch direkt auf die Gewebefunktion aus. Bislang wurde die Apoptose als primärer Mechanismus zur Verbindung von Krebsentstehung und Krebsbekämpfung angesehen. Apoptose-Inhibitorproteine (IAPs) haben eine wichtige Funktion bei der Regulierung des Zellüberlebens und der Kontrolle der Apoptosekaskade. Darüber hinaus wird die Expression von IAPs durch mehrere nukleare Faktoren wie NF-kappa B, FoxA2, C/EBP-beta usw. moduliert. Der Zusammenhang zwischen Arsen und Apoptose sollte sorgfältig untersucht werden. Wir brauchen mehr Beweise, um zu zeigen, dass (a) niedrig dosiertes Arsen die Apoptose hemmt und die Zellproliferation stimuliert. Es ist bekannt, dass die Krebsentstehung die Apoptoseresistenz überwinden muss; (b) hochdosiertes Arsen löst die Apoptose aus und tötet Krebszellen. Die Hauptstrategie für die Krebsbehandlung besteht darin, die Apoptose von Krebszellen auszulösen. Eine vernünftige Hypothese ist, dass Arsen bei niedrigen Konzentrationen die Apoptose hemmt, während es bei hohen Konzentrationen die Apoptose fördert. Es wird auch spekuliert, dass IAPs und ihr regulatorisches Netzwerk für die dualen Eigenschaften von Arsenid verantwortlich sein könnten.
Eine Erforschung der biphasischen Wirkung von Arsen (Arsenid) hat besondere Bedeutung für die klinische Behandlung von Krebs. Wenn Arsenverbindungen zusammen mit anderen Arzneimitteln verabreicht werden, wird die Dosierung der Arsenverbindungen oft reduziert. Aufgrund der doppelten Eigenschaften von Arsen sollten wir bei der kombinierten Einnahme von Arzneimitteln den medizinischen Wert der Arsenverbindung bewerten. Zu diesem Zeitpunkt muss die lokale Konzentration von Arsenid auf einem bestimmten Niveau gehalten werden, um die Apoptose von Krebszellen auszulösen. Andernfalls kann das Arsenid die Proliferation von Krebszellen fördern. Es gibt keine therapeutische Wirkung, sogar das Gegenteil ist der Fall. Daher müssen wir eine bidirektionale Reaktion des Arsenids in Betracht ziehen, insbesondere in Kombination mit anderen Medikamenten. Was ist der genaue Schwellenwert, ab dem Arsenid den Tumor hemmt? Wie kann man das Arsenid verabreichen, um die Schwellenkonzentration zu erreichen und konstant zu halten? Welche Biomarker sind für die Überwachung der Arsenidkonzentration im Blut geeignet? Bislang gibt es keine Antworten auf diese Fragen. Die biologischen Eigenschaften des Arsens werfen auch ein neues Thema für die Toxikologie auf. Nach der traditionellen Definition der Toxikologie gilt das Absterben von Zellen oder die Erhöhung der Sterberate allgemein als toxikologisches Verhalten. Aber auch die Förderung der Vermehrung von Krebszellen ist für den Körper toxisch. Das Verhalten von niedrig dosiertem Arsen ist also ein weiterer Aspekt der Toxikologie. Vielleicht kann man es als inverse Toxikologie oder umgekehrte Toxikologie bezeichnen. Gegenwärtig arbeiten wir an molekularen Markern, mit denen die Arsenkonzentration im Blut abgeschätzt und die therapeutische Wirkung bewertet werden kann. Leukämie und solide Tumore erfordern möglicherweise unterschiedliche Konzentrationen von Arsenpräparaten (4). Um die tatsächliche Rolle von Arsenid bei der Behandlung verschiedener Krebsarten zu testen, sind klinische Versuche an großen Proben erforderlich. Darüber hinaus steht die Quantifizierung des funktionellen Zustands der Zellen derzeit im Mittelpunkt.
Zusammenfassend lässt sich sagen, dass Arsen eine biphasische Wirkung auf das Zellwachstum hat, die sich in der Proliferation bei niedrigen Konzentrationen und der Hemmung bei hohen Konzentrationen zeigt. Aufgrund der biphasischen Wirkung muss ein Schwellenwert für die Arsenkonzentration eingehalten werden, um Krebszellen während der Krebsbehandlung abzutöten. Andernfalls könnte das Arsenid die Vermehrung der Krebszellen anregen und damit eine umgekehrte Wirkung erzielen. Vorläufige Studien zeigen, dass die anti-apoptotische IAPs-Familie und ihr regulatorisches Netzwerk eine wichtige Rolle in der Arsenbiologie spielen. Die Apoptose könnte ein wesentlicher Mechanismus im Zusammenhang mit den dualen Eigenschaften von Arsen sein.
Interessenbekundung
Die Autoren haben nichts zu veröffentlichen.
Danksagungen
Diese Arbeit wurde von „The National Natural Science Foundation of China“, Projektnummer 81773367, unterstützt. Wir danken Professor Yang Jianbo für seine Anregungen und Ratschläge bei der Erstellung des Manuskripts.
- Yedjou C, Tchounwou P, Jenkins J, McMurray R (2010) Basic mechanisms of arsenic trioxide (ATO)-induced apoptosis in human leukemia (HL-60) cells. J Hematol Oncol 3: 28.
- Tseng CH, Chong CK, Tseng CP, Centeno JA (2007) Blackfoot disease in Taiwan: its link with inorganic arsenic exposure from drinking water. Ambio. 36: 82-84.
- Smith AH, Marshall G, Roh T, Ferreccio C, Liaw J, et al. (2018) Lung, bladder, and kidney cancer mortality 40 years after arsenic exposure reduction. Journal of the National Cancer Institute 110: 241-249.
- Gill H, Yim R, Lee HKK, Mak V, Lin SY, et al. (2018) Long-term outcome of relapsed acute promyelocytic leukemia treated with oral arsenic trioxide-based reinduction and maintenance regimens: A 15-year prospective study. Cancer 124: 2316-2326.
- Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, et al. (2007) IAP antagonists induce autoubiquitination of c-IAPs, NF-kappaB activation, and TNFalpha-dependent apoptosis. Cell 131: 669-681.