- Abstract
- Schlüsselwörter
- Einführung
- Frühe Methoden zur Pigmentherstellung
- Schwefelsäuremethode
- Chlorierungsverfahren
- Abtrennung von Eisen
- Elektroofenverfahren
- Hydrometallurgischer Weg
- Hochdruckverfahren
- Atmosphärisches Verfahren
- Oxyhydrolyse
- Wirbelschicht-Oxyhydrolyse
- Sprüh-Röster-Oxyhydrolyse
- Herstellung von Titan
Abstract
Minderwertiger Ilmenit kann mit konzentrierter HCl bei Atmosphärendruck und 80oC gelaugt werden. Nach der Filtration zur Abtrennung unlöslicher Bestandteile wird die TiO2+ und Fe2+ enthaltende Lösung erhitzt, um Titanhydroxid auszufällen und HCl zu gewinnen. Das Titanhydroxid wird dann kalziniert, um synthetisches Rutil zu erhalten, das mehr als 95 % TiO2 enthält, während FeCl2 einer Oxyhydrolyse oder einer Wirbelschichtbehandlung unterzogen wird, um HCl und Fe2O3 zu gewinnen. Das Verfahren kann natürlich auch auf hochgradiges Ilmenit angewendet werden. Es umgeht das Elektroofenverfahren, das nur bei hochwertigem Ilmenit angewandt werden kann, und ist dem Schwefelsäureverfahren, das sehr umweltschädlich ist, überlegen. Das Produkt dieses Prozesses kann zur Herstellung von Weißpigmenten und Titanmetall verwendet werden.
Schlüsselwörter
HCl-Auslaugung, Magpei-Prozess, synthetischer Rutil, Oxyhydrolyse, Elektroofen, Chlorierung, Schwefelsäureprozess
Einführung
Die wichtigsten Titanminerale sind Rutil, TiO2 und Ilmenit, FeTiO3 (Abbildung 1 und 2). Rutil lässt sich durch die Chlorierungsmethode leicht zu Titanmetall oder TiO2-Pigmenten verarbeiten, während Ilmenit wegen seines hohen Eisengehalts komplizierter ist. Da die Weltreserven an Titan zu 90 % in Form von Ilmenit und nur zu 10 % in Form von Rutil vorliegen, ist die Aufbereitung von Ilmenit offensichtlich eine wichtige Frage in der Metallurgie.

Abbildung 1: Museumsprobe von Rutil, ~ 90 % TiO2

Abbildung 2: Museumsprobe von Ilmenit, FeTiO3 (59.4 % TiO2)
Ilmenitvorkommen können massiv sein wie in der Provinz Quebec (Abbildung 3) oder als schwarze Sande (Abbildung 4) in Verbindung mit Magnetit, Monazit und anderen wertvollen Mineralien vorkommen, die durch physikalische Methoden abgetrennt werden (Abbildung 5). Bei der ersten magnetischen Trennung wird ein schwacher Magnet verwendet, um Magnetit abzutrennen, während bei der zweiten magnetischen Trennung ein Magnet mit hoher Intensität verwendet wird, um Ilmenit abzutrennen.

Abbildung 3: Eine Probe von massivem Ilmenit aus Quebec

Abbildung 4: Schwarze Strandsande wie in Indien
Frühe Methoden zur Pigmentherstellung
Schwefelsäuremethode
Im Jahr 1916 begannen die Titanium Pigment Corporation aus Niagara Falls, New York, und die Titan Company aus Norwegen gleichzeitig mit der kommerziellen Produktion dieses neuen Weißpigments. Damals waren die wichtigsten in Farben verwendeten Weißpigmente Bleiweiß, Zinkweiß und Lithopon. Bei diesem Verfahren wurde Ilmenit mit konzentrierter H2SO4 bei 110-120°C behandelt, um Eisen- und Titanylsulfate zu bilden:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
Die Reaktion wird in großen Betontanks durchgeführt, die mit säurebeständigen Ziegeln ausgekleidet sind (Abbildung 6) und durch direkte Injektion von Hochdruckdampf oder in einer Schneckenmühle (Abbildung 7) erhitzt werden. Die am Ende der Reaktion im Reaktor entstandene verfestigte Masse wird dann durch Auflösen in Wasser oder verdünnter Säure aus dem Reaktor ausgetragen. Nach Entfernung des unlöslichen Rückstands durch Filtration wurde die Lösung, die 120-130 g/L TiO2 und 250-300 g/L FeSO4 enthielt, unter Vakuum bei 10°C konzentriert, um FeSO4-7H2O zu kristallisieren, das anschließend zentrifugiert wurde. Das Titanoxid wird dann durch Verdünnung und Aussaat aus der Lösung ausgefällt, wobei verdünntes H2SO4 zur Entsorgung entsteht (Abbildungen 8 und 9). Der größte Hersteller von Pigmenten in Salvador, Brasilien, verwendet jedoch immer noch diese Technologie, da er die Abfallprodukte im Meer entsorgt, die von den Gezeiten entfernt werden.

Abbildung 5: Aufbereitung von schwarzem Sand zur Rückgewinnung seiner wertvollen Bestandteile

Abbildung 6: Große Betontanks, die mit säurebeständigen Ziegeln ausgekleidet sind
Abbildung 7: Beheizte Schneckenmühle

Abbildung 8: Herstellung von TiO2-Pigment durch das Schwefelsäureverfahren

Abbildung 9: Titanweiß, ~ 100% TiO2
Chlorierungsverfahren
DuPont in den USA produziert das Pigment seit 1950 durch direkte Chlorierung von Ilmeniterz, Abtrennung der Produkte durch fraktionierte Destillation und anschließende Oxidation von TiCl4 (Abbildung 10):

Abbildung 10: Vereinfachtes Du Pont-Verfahren zur Pigmentherstellung aus Ilmenit
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Das Problem dieses Verfahrens ist die Rückgewinnung von Chlor aus Eisenchlorid bzw. die Vermarktung der großen Mengen dieses Nebenprodukts.
Abtrennung von Eisen
Aufgrund der Verschmutzungsprobleme, die mit der Entsorgung von verdünnter Schwefelsäure und FeSO4 verbunden sind, wird das Eisen im Erz in einem frühen Stadium abgetrennt. Dies geschieht auf zwei Arten: im Elektroofen und durch hydrometallurgische Verfahren.
Elektroofenverfahren
Das Elektroofenverfahren wurde in den 1950er Jahren entwickelt. Das Erz wurde mit einer bestimmten Menge Anthrazit gemischt, die gerade ausreichte, um die Eisenoxidkomponente des Erzes zu reduzieren, und dann in einen Elektroofen mit einer Temperatur von 1 650 °C gegeben, wo das Eisenoxid zu Metall reduziert wird, während das Titan als Schlacke abgeschieden wird (Abbildung 11). Bei der Reduktion laufen folgende Reaktionen ab:

Abbildung 11: Elektroofenverfahren zur Eisentrennung
FeTiO3 + C → Fe + CO + TiO2(Schlacke)
Fe2O3 + 3C → 2Fe + 3CO
Dieses Verfahren wird von der Rio Tinto QIT in ihrem Werk in Sorel bei Montreal und in Richards Bay in Südafrika eingesetzt. Es wird auch in der Sowjetunion in Zaporozhye (Ukraine) und in Japan verwendet.
Titanschlacke besteht hauptsächlich aus Eisen-Magnesium-Titanat, (Fe,Mg)Ti4O10, und einer kleinen Menge Silikate; typische Analysen ergeben 72-85% Gesamt-TiO2. Ein kleiner Teil des TiO2 wird zu Ti2O3 reduziert. Die Reduktion der Eisenoxide wird nicht vollständig durchgeführt, so dass etwas Eisenoxid in der Schlacke verbleibt, um den Schmelzpunkt zu senken. Der Schmelzpunkt von TiO2 liegt bei 1840 °C, der von Ilmenit bei 1435 °C.
Die Schlacke hat einen hohen Titan- und einen niedrigen Eisengehalt (Abbildung 12) und ist daher bei der Herstellung von TiO2-Pigment oder Titanmetall dem Ilmenit vorzuziehen. Die in Quebec hergestellte Schlacke ist jedoch wegen ihres hohen Verunreinigungsgrades – etwa 16,6 % im Vergleich zu etwa 6 % bei anderen Schlacken – nicht zur Chlorierung geeignet. Diese Verunreinigungen verbrauchen nicht nur unnötige Mengen an Chlor, sondern stellen auch ein Entsorgungsproblem dar. Außerdem können einige dieser Verunreinigungen, z. B., Kalzium und Magnesium, den Chlorierungsprozess selbst, der bei 800°C durchgeführt wird, indem sie eine geschmolzene Phase bilden (CaCl2 m.p. 770°C, MgCl2 m.p. 708°C).

Abbildung 12: Gemahlene Titanschlacke, FeTi4O10 (70-80 % TiO2)
Aus diesen Gründen wurde Titanschlacke nur zur Herstellung von Pigmenten nach dem Schwefelsäureverfahren verwendet. Die Schlacke wurde auf die gleiche Weise wie Ilmenit behandelt, mit der Ausnahme, dass keine Abtrennung von Eisensulfat erforderlich war, da der größte Teil des Eisens bereits in einem früheren Schritt durch Reduktion abgetrennt wurde (Abbildung 13). Das Verfahren der Schwefelsäurebehandlung der Schlacke litt jedoch immer noch unter dem Problem der Entsorgung der Abfallsäure und wurde daher in den 1980er Jahren aufgegeben und durch eine neue Technologie ersetzt, die auf der Aufwertung der Schlacke auf 94,5 % TiO2 durch Auslaugung der meisten Verunreinigungen mit HCl unter Druck beruht, um sie für die Chlorierung geeignet zu machen.

Abbildung 13: Auslaugung von Titanschlacke zur Herstellung von TiO2-Pigment, jetzt veraltet
Hydrometallurgischer Weg
Der hydrometallurgische Weg wurde in den 1960er Jahren entwickelt und beinhaltete die Auslaugung von Eisen aus Ilmenit und die Gewinnung eines titanreichen Rückstandes (90-95 % TiO2), der als „synthetisches Rutil“ bekannt ist. In einem Fall, dem Altair-Verfahren, wurde ein TiO2 in Pigmentqualität gewonnen. Alle diese Verfahren verwenden ein Oxyhydrolyseverfahren zur Behandlung von Eisenchlorid, um HCl für die Wiederverwendung und Fe2O3 als Nebenprodukt zu erhalten.
Hochdruckverfahren
Bei diesem Verfahren wird hochwertiger Ilmenit in Autoklaven mit 20 % HCl bei 120 °C und 200 kPa zersetzt; Eisen wird als Eisen(II)-chlorid gelöst und hinterlässt einen Feststoff, der etwa 95 % TiO2 enthält, das die chemische Analyse von Rutil aufweist, weshalb es als synthetisches Rutil bezeichnet wird (Abbildung 14):

Abbildung 14: Synthetischer Rutil
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Minderwertiger Ilmenit kann nicht mit dieser Methode behandelt werden, da alle Silikate und unlöslichen Stoffe das Produkt verunreinigen. Das synthetische Rutil wird dann mit Chlor behandelt, um TiCl4 herzustellen, aus dem TiO2 oder Titanmetall ohne Verschmutzungsprobleme gewonnen wird. Das Verfahren wird in den USA, England, Japan, Taiwan und Australien eingesetzt. Die Oxyhydrolyse kann auf verschiedene Weise durchgeführt werden, wie im Folgenden beschrieben.
Atmosphärisches Verfahren
Im Jahr 2014 wurde von der Magpie Incorporation in Kanada festgestellt, dass minderwertiges Ilmenit bei 80 °C mit konzentrierter HCl bei atmosphärischem Druck aufgelöst werden kann. Nach der Filtration zur Entfernung unlöslicher Bestandteile wird die Lösung destilliert, um die HCl zurückzugewinnen und das Titanyl-Ion zu TiO2 zu hydrolysieren. Nach der Filtration wird der Rückstand kalziniert, um synthetisches Rutil herzustellen (Abbildung 16):

Abbildung 15: Herstellung von synthetischem Rutil aus Ilmenit

Abbildung 16: Herstellung von 98+% TiO2 aus minderwertigem Ilmenit
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Es ist offensichtlich, dass die neue Laugungstechnologie bei Umgebungsdruck der alten Elektroofen-Schmelz-Autoklaven-Veredelung überlegen ist.
Oxyhydrolyse
Eisenchloridlösung wird durch Oxyhydrolyse zu HCl und Fe2O3 regeneriert:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Es handelt sich um die gleiche Technologie, die auch für die Behandlung von Beizlösungen verwendet wird. Es werden zwei Methoden angewandt
Wirbelschicht-Oxyhydrolyse
In einem Wirbelschichtreaktor wird die Eisen(II)-chlorid-Lösung auf ein großes Bett aus heißem Eisen(III)-oxid aufgebracht, das durch die heißen Verbrennungsgase erhitzt wird (Abbildung 17). Da das Verbrennungsgas durch das gut bewegte Oxidbett strömt, erreicht es schnell ein thermisches Gleichgewicht mit dem Bett. Die Lösung wird auf das Oxidbett aufgetragen. Die flüssige Einspeisung benetzt die äußere Schicht der heißen Oxidpartikel und verdampft schnell, so dass sich eine zwiebelartige Schicht aus neuem festem Oxid auf dem vorhandenen Oxid bildet, wodurch dichte homogene Partikel entstehen.

Abbildung 17: Wirbelschichtreaktor für die Oxyhydrolyse von Eisen(II)-chlorid
Sprüh-Röster-Oxyhydrolyse
Bei diesem Typ von Oxyhydrolyse-Röstern wird die Eisen(II)-chlorid-Lösung in einen leeren zylindrischen Behälter gesprüht, während die erforderliche Energie durch den Aufwärtsstrom heißer Gase geliefert wird, die in den unteren Brennern erzeugt werden (Abbildung 18). Sprühröster haben große Durchmesser, um die Gasgeschwindigkeiten niedrig zu halten. Ist die Gasgeschwindigkeit hoch, werden zu viele Partikel mit dem Abgas ausgeschieden, und die Produktqualität und die Effizienz des Rösters sinken. Das Abgas und die Oxide verlassen den Röster im Gegenstrom bei etwa 400°C bis 500°C. Die Verweilzeit der versprühten Partikel in der Hochtemperatur-Reaktionszone ist sehr kurz; daher sollten durch Zerstäubung sehr kleine Flüssigkeitströpfchen erzeugt werden, die sich schnell erhitzen lassen. Das schnelle Aufheizen führt zur Bildung einer festen Oxidkruste auf der Oberfläche jedes Tropfens. Wenn sich der Großteil des Tropfens erhitzt, verdampft der Wasseranteil und durchbricht die Oxidhülle. Daher besteht das sprühgeröstete Oxid aus sehr feinen, „flauschigen“ Hohlkugeln.

Abbildung 18: Regenerierung von HCl aus Eisenchloridlösung durch Oxyhydrolyse im Sprühröster
Herstellung von Titan
Metallisches Titan wird durch Chlorierung von Rutil, synthetischem Rutil oder Titanschlacke und anschließende Reduktion in einem metallothermischen Reaktor von TiCl4 durch Magnesium zu Titan hergestellt (Abbildungen 19 und 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
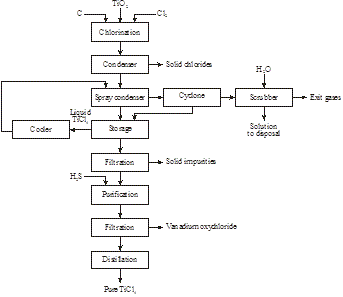
Abbildung 19: Herstellung von TiCl4 aus Rutil, synthetischem Rutil oder Titanschlacke

Abbildung 20: Herstellung von Titan aus TiCl4
TiCl4 + Mg → Ti + MgCl2
Magnesiumchlorid wird anschließend elektrolysiert, um das Magnesium und Chlor für das Recycling zurückzugewinnen. Abbildung 21 zeigt den aus dem Ofen entnommenen metallothermischen Reaktor nach der Reduktion, aus dem der Titanschwamm gewonnen wird (Abbildung 22).

Abbildung 21: Metallothermischer Reaktor, der aus dem Ofen entfernt wird

Abbildung 22: Titanschwamm (oben) und MgCl2 (unten), die aus dem Reaktor entfernt werden
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) „Titanium“, pp. 1129-1179 in Handbook of Extractive Metallurgy edited by F. Habashi, published by WILEY-VCH, Weinheim, Germany.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgie Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Nachgedruckt in Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. Die Verarbeitung von Titanerzen für die Pigment- und Metallproduktion. Arab Min J 11: 74-84