- Inhalt
- Funktion
- Mechanismus der Strangtransferhemmung
- HIV und AIDS
- Auswirkungen der Struktur
- PFV Intasome Crystallization
- Kristallisationstechnik
- Kristallographische und Verfeinerungsstatistiken
- Gesamtarchitektur & Komponenten
- Struktur
- Integrase und DNA-Wechselwirkungen
- Aktive Stelle
- Integrase-Inhibitoren
Inhalt
- 1 Funktion
- 2 Mechanismus der Strang-transfer inhibition actio
- 3 HIV und AIDS
- 4 Einfluss der Struktur
- 5 PFV Intasome Crystallization
- 5.1 Kristallisationstechnik
- 5.2 Kristallographische und Verfeinerungsstatistiken
- 6 Gesamtarchitektur & Komponenten
- 6.1 Struktur
- 6.2 Integrase und DNA-Interaktionen
- 6.3 Aktive Stelle
- 7 Integrase-Inhibitoren
- 7.1 Zusätzliche Ressourcen
- 8 3D-Strukturen der retroviralen Integrase
Funktion
Retrovirale Integrase ist ein essentielles retrovirales Enzym, das an virale DNA bindet und sie in ein Wirtszellchromosom einfügt. Die revers transkribierte cDNA des humanen Immundefizienzvirus Typ 1 (HIV-1) wird in das Genom der Wirtszelle eingebaut, um die Fitness und Virulenz des Erregers zu erhöhen. Die Integrase wird von einer Klasse von Retroviren (wie HIV) produziert und vom Virus verwendet, um sein genetisches Material in die DNA der Wirtszelle einzubauen. Die zelluläre Maschinerie des Wirts produziert dann mRNA und anschließend Proteine aus dem eingebauten genetischen Material, wodurch das Virus repliziert wird. Obwohl mehrere Integrase-hemmende Medikamente untersucht wurden, ist der Mechanismus, der für die Hemmung des Strangtransfers verantwortlich ist, noch nicht geklärt. Hare el al. (2010) haben jedoch die strukturellen Bestandteile der retroviralen Integration bestimmt. Die weitere Aufklärung der vollständigen Struktur der retroviralen Integrase und ihre Anwendung zur Regulierung der funktionellen und enzymatischen Aktivitäten könnte es den Forschern ermöglichen, das Fortschreiten retroviraler Krankheiten zu verzögern. Darüber hinaus könnte die Untersuchung der HIV-1-Integration zu einem vielversprechenden neuen Ziel führen und zur Entwicklung von Pharmakophoren für die antivirale Therapie beitragen.
HIV-Integraseinhibitoren: Raltegravir, das unter dem Namen Isentress vermarktet wird, ist derzeit als therapeutischer Hemmstoff der HIV-Integrase zugelassen. Es wurde am 12. Oktober 2007 zugelassen; zu Phagenintegrase siehe Phagenintegrase.
Mechanismus der Strangtransferhemmung
Bildunterschrift
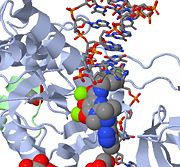
Oben sehen Sie ein JMOL-Bild von MK-0518, das das 3′-Ende der viralen DNA an der Bindung des aktiven Zentrums hindert. Beachten Sie die Metallchelat-Sauerstoffatome in MK-0518, die mit den Magnesiumkationen im aktiven Zentrum interagieren.
HIV-Integrase Typ 1 ist ein relativ neues und neuartiges Ziel für Inhibitoren. Im Jahr 2007 wurde der erste HIV-1-Integrase-Hemmer, Raltegravir, von der FDA für den Einsatz bei HIV-1 als Kombinationstherapie zugelassen. Strangtransfer-Inhibitoren wirken, indem sie die konzertierte Integration der viralen DNA in das Wirts-Chromosom verhindern. Nach dem Eintritt des Virus in die Wirtszelle wandelt die reverse Transkriptase die virale ssRNA in dsDNA um. An diesem Punkt bildet die Integrase einen Komplex mit der viralen DNA, wodurch der Prä-Integrationskomplex (Intasom) entsteht. Der Prä-Integrationskomplex wird dann in den Zellkern chaperoniert, wo zwei Nukleotide vom 3′-Ende abgeschnitten werden. Anschließend wird die DNA kovalent in die Wirts-DNA integriert. Die Strangtransfer-Inhibitoren unterbrechen diesen Prozess und verhindern die Integration der viralen DNA in das Wirts-Chromosom. Strang-Transfer-Inhibitoren wirken, indem sie an die Metallionen-Cofaktoren im aktiven Zentrum der retroviralen Integrase angreifen. Die metallchelatbildenden Sauerstoffatome in den Inhibitoren interagieren direkt mit den Metall-Cofaktoren, während die Halobenzylgruppe in die Tasche passt, die durch die verdrängte 3′-Virus-DNA im aktiven Zentrum entsteht.
HIV und AIDS

Im Jahr 2010 sind mehr als 25 Millionen Menschen an AIDS gestorben, und es wird geschätzt, dass etwa 33 Millionen Menschen mit HIV leben. Für retrovirale Integraseinhibitoren siehe Raltegravir und Retrovirale Integraseinhibitoren Pharmakokinetik.
Auswirkungen der Struktur
Dreidimensionale Strukturen für bestimmte Wirtszellproteine, die für das Verständnis des Mechanismus der HIV-Infektion und der Virulenz entscheidend sind, sind aus röntgenkristallographischen Analysen hervorgegangen. Die Strukturen der HIV-Protease und -Integrase gehören zu den am besten bewerteten Strukturen, die dazu beigetragen haben, viele Leben zu retten und die Lebensqualität vieler HIV-Infizierter zu verbessern. Sie wird im strukturbasierten Wirkstoffdesign zur Entwicklung von Protease- und Integrase-Inhibitoren eingesetzt und ist ein wichtiger Bestandteil der hochaktiven antiretroviralen Therapie (HAART).
Die bestehenden antiretroviralen Wirkstoffe verbessern zwar die Lebensqualität und verlängern das Leben vieler Patienten, können aber die Krankheit nicht ausrotten. Studien mit Integrase-Inhibitoren zeigen, dass die Kombination mit anderen antiretroviralen Medikamenten die viralen Anpassungen verringert und das Potenzial hat, für die Rettungstherapie von Patienten eingesetzt zu werden, die eine Resistenz gegen andere Medikamente erworben haben. Weitere Informationen finden Sie unter
- AIDS vor Protease-Inhibitoren & HIV-Protease-Inhibitoren: A Breakthrough
- Treatments:Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
Um die viralen DNA-Enden von HIV-1 zu imitieren, verwendeten Hare et al. (2010) lösliche und voll funktionsfähige Prototyp Foamy Virus (PFV) Intasom-Präparate, die mit rekombinanter PFV-Integrase und doppelsträngigen Oligonukleotiden hergestellt wurden.
Die bemerkenswerte Stabilität der Integrase-DNA-Komplexe wurde durch Beobachtung der in vitro-Strangtransferreaktionen ermittelt, die in drei Modi der Deproteinationsmigration unterteilt wurden: (1) einzelne konzertierte Ereignisse: linearisiertes Zielplasmid; (2) mehrfache konzertierte Ereignisse: Abstrich; (3) Halbstellenereignisse: offene zirkuläre DNA. Die weitere Charakterisierung des PFV-Intasoms zeigte auch strukturelle Substanzialität, was auf starke Protein-Protein- und Protein-DNA-Wechselwirkungen trotz längerer Inkubation unter Bedingungen mit hoher Ionenstärke schließen lässt. Umfassende Kristallisationsversuche ergaben eine brauchbare Kristallkonfiguration, die Röntgenstrahlen mit einer Auflösung von 2,9 Angström beugte. Schließlich wurde eine dreidimensionale Struktur bestimmt. Die asymmetrische Einheit enthielt ein einzelnes Integrase-Dimer mit einem stabil gebundenen viralen DNA-Molekül und ein Paar von Integrase-Dimeren, die mit der Symmetrie verbunden waren und ein längliches Tetramer bildeten. Die Dimer-Grenzfläche wird durch intermolekulare Wechselwirkungen zwischen dem Aminoterminal und den katalytischen Kerndomänen (innere Untereinheit – äußere Untereinheit) stabilisiert. Die Gesamtform des länglichen Tetramers ist einzigartig, auch wenn sie Ähnlichkeiten mit früher berichteten HIV-1-Integrase-Komplexen aufweist.
Kristallisationstechnik
Die Protein-DNA-Komplexe wurden unter Verwendung des PFV-IN in voller Länge und synthetischer dsDNA, die das virale Ende modellierte, gebildet.
Das Intasom wurde unter Verwendung der Dampf-Tropfen-Hängediffusionstechnik kristallisiert. Die Reservoirlösung bestand aus 1,35 M Ammoniumsulfat, 25% (v/v) Glycerin, 4,8% (v/v) 1,6-Hexandiol und 50mM 2-(N-Morpholino)-Ethansulfonsäure (MES) bei pH 6,5. Die Protein-DNA-Kristalle wurden auch in Gegenwart von MK0518, GS9137, Mg(II) und/oder Mn(II) eingeweicht. Die Kristallstruktur wurde durch molekulare Ersetzung gelöst.
Kristallographische und Verfeinerungsstatistiken
Hare et al. (2010) haben Daten zu sieben Kristallstrukturen veröffentlicht. Diese Daten umfassen den PFV-IN-Komplex (Apo-Form) und sechs weitere Strukturen, darunter den an Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137 und Mn/GS9137 gebundenen Komplex. Alle sieben Strukturen gehören der Raumgruppe P41212 an. Sie wurden mit einer Auflösung zwischen 2,85 und 3,25 Å verfeinert.
Gesamtarchitektur & Komponenten
Struktur
Die Gesamtstruktur des zusammengesetzten PFV-Intasoms ist ein Tetramer-Modell, das auf zwei Domänenstrukturen mit einer Dimer-Dimer-Schnittstelle basiert. Frühere Intasom-Modelle zeigen eine ähnliche, aber flexiblere Struktur, während sich das PFV-Intasom als stark eingeschränkt erwiesen hat. Unter Verwendung von Homologiemodellen schlagen Hare et al. (2010) vor, dass kürzere Interdomänen-Linker ein Faktor für die Flexibilität sein könnten, insbesondere bei der HIV-1-Integrase. Die inneren Untereinheiten des Tetramers sind an der gesamten Tetramerisierung und der viralen DNA-Bindung beteiligt. Die katalytischen Kerndomänen der äußeren Untereinheiten könnten als Stützen fungieren, aber da die amino- und carboxyterminalen Domänen in den Elektronendichtekarten nicht aufgelöst sind, bleibt ihre Funktion unklar. Der Linker der katalytischen Kerndomäne und der carboxyterminalen Domäne nimmt über den größten Teil seiner Länge eine verlängerte Konformation an und befindet sich parallel zur aminoterminalen Domäne und dem Linker der katalytischen Kerndomäne der inneren Untereinheit. Die Interdomänen-Linker Die Interdomänen-Linker (CCD-CTD-Linker und NTD-CCD-Linker) binden beide Hälften des Intasoms zusammen, und die Struktur wird durch ein Paar carboxyterminaler Domänen, die mit beiden inneren katalytischen Kerndomänen interagieren, weiter stabilisiert.
Integrase und DNA-Wechselwirkungen
Starke Protein-DNA-Wechselwirkungen finden sich innerhalb der terminalen sechs Nukleotide. Jede carboxyterminale Domäne interagiert mit dem Phosphodiester-Grundgerüst beider viraler DNA-Moleküle. Darüber hinaus interagieren die aminoterminale Domänen-Erweiterungsdomäne und die aminoterminale Domäne mit der viralen DNA an der aktiven Stelle der gegenüberliegenden katalytischen Kerndomäne.
Aktive Stelle
Die Carboxylate der aktiven Stelle sind Seitenketten von Asp 128, Asp 185, Glu 221.
Je ein Zinkatom befindet sich in der Nähe der aktiven Stellen.
- .
- .
Integrase-Inhibitoren
| Name | Marke | Firma | Patent | Anmerkungen |
| Raltegravir | Isentress | Merck & Co. | – | auch bekannt als MK-0518. Die Isopropyl- und Methyl-Oxadiazole von MK-0518 sind an hydrophoben und stapelnden Wechselwirkungen mit den Seitenketten von Pro 214 und Tyr 212 beteiligt, um dieses Medikament im aktiven Zentrum des PFV-Intasoms zu stabilisieren. Diese Art der Arzneimittel-Bindungsinteraktion bewirkt eine Verdrängung des reaktiven 3′-Virus-DNA-Endes aus dem aktiven Zentrum von PFV-Intasom. Nach der Bindung von MK-0518 an die aktive Stelle entfernt sich die reaktive 3′-Hydroxylgruppe um mehr als 6 Angström von der aktiven Stelle des PFV-Intasoms. Raltegravir wurde von der FDA am 12. Oktober 2007 für die Verwendung mit anderen Anti-HIV-Wirkstoffen bei der Behandlung von HIV-Infektionen bei Erwachsenen zugelassen. Es ist der erste von der FDA zugelassene Integrase-Inhibitor. |
| Elvitegravir | – | Gilead Science | – | GS-9137 interagiert mit Pro 214 des PFV-Intasoms durch seine Chinolon-Base und Isopropyl-Gruppe. Im Versuchsstadium; teilt die Kernstruktur von Chinolon-Antibiotika. Phase-II-Studien mit Elvitegravir bei behandlungserfahrenen Patienten sind abgeschlossen. Phase-III-Studien mit behandlungserfahrenen Patienten sind im Gange. Eine Phase-II-Studie mit Elvitegravir bei Patienten, die noch nie eine antiretrovirale Therapie erhalten haben, ist im Gange. In dieser Studie wird auch ein Verstärkungsmittel anstelle von Norvir, derzeit GS9350 genannt, untersucht. Elvitegravir ist vielversprechend für HIV-positive Patienten, die in der Vergangenheit andere HIV-Medikamente eingenommen haben. |
| MK-2048 | – | Merck & Co. | – | Ein Integraseinhibitor der zweiten Generation, der zur Bekämpfung der HIV-Infektion eingesetzt werden soll. Er ist dem ersten verfügbaren Integraseinhibitor, Raltegravir, insofern überlegen, als er das HIV-Enzym Integrase viermal länger hemmt. Er wird für den Einsatz im Rahmen der Präexpositionsprophylaxe (PrEP) untersucht. |
Siehe auch Pharmakokinetik von retroviralen Integrase-Hemmern.