Die Immunfluoreszenz (IF) ist ein gängiger morphologischer Ansatz zur Bestimmung der Verteilung subzellulärer Komponenten. Für den IF-Test werden Antikörper benötigt, die mit Fluoreszenzfarbstoffen konjugiert sind. Der Antikörper erkennt das Antigen spezifisch, indem er an das Epitop des Ziels bindet, und das Fluorophor wird unter einem Fluoreszenzmikroskop nachgewiesen. Auf diese Weise können subzelluläre Komponenten vor einem dunklen Hintergrund sichtbar gemacht werden. IF kann auch als alternative semiquantitative Analysemethode zur Überwachung der Expression des Ziels verwendet werden.
Es gibt drei Arten von IF: direkte IF, indirekte IF und kombinierte IF.
Direkte IF verwendet einen einzelnen primären Antikörper, der mit einem Fluoreszenzfarbstoff konjugiert ist.
Bei der indirekten IF werden zwei Antikörper für die Färbung verwendet: ein primärer Antikörper, der spezifisch an ein Epitop bindet, und ein passender sekundärer Antikörper, der mit einem Fluoreszenzfarbstoff konjugiert ist.
Die kombinierte IF ist eine Kombination aus direkter und indirekter IF-Färbung.
Tabelle 1. Vergleich von direkter, indirekter und kombinierter IF.
| IF-Typ | Direkt | Indirekt | Kombiniert |
|---|---|---|---|
| Schematische Darstellung | 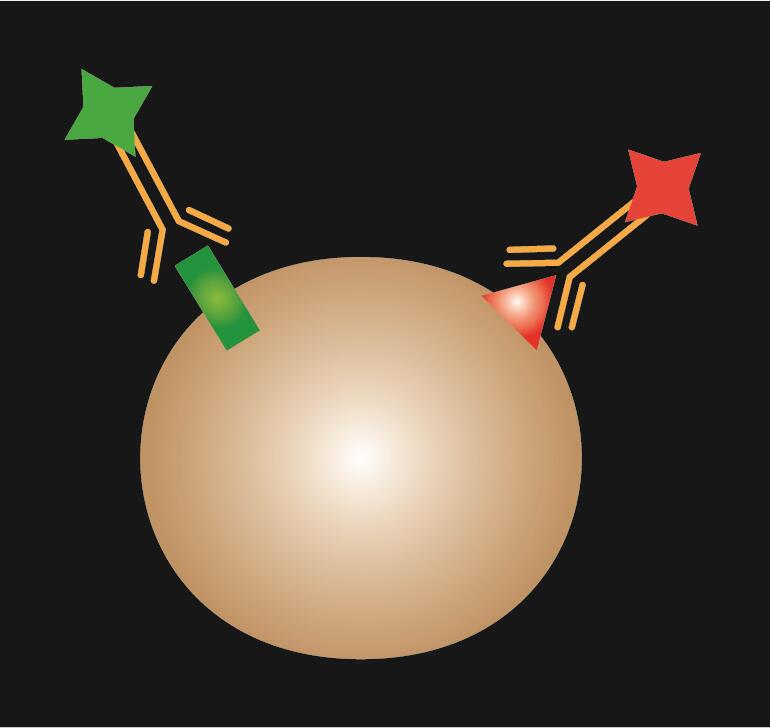 |
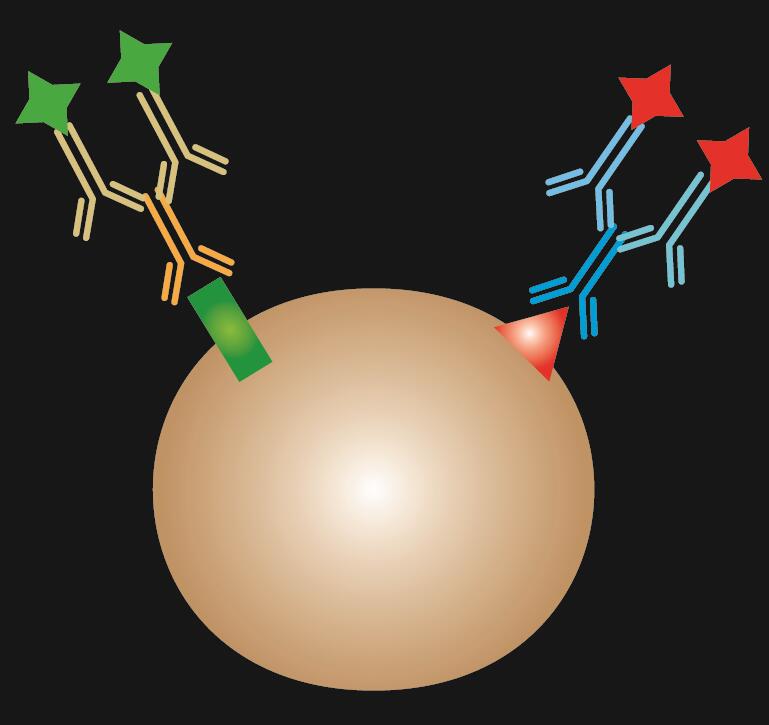 |
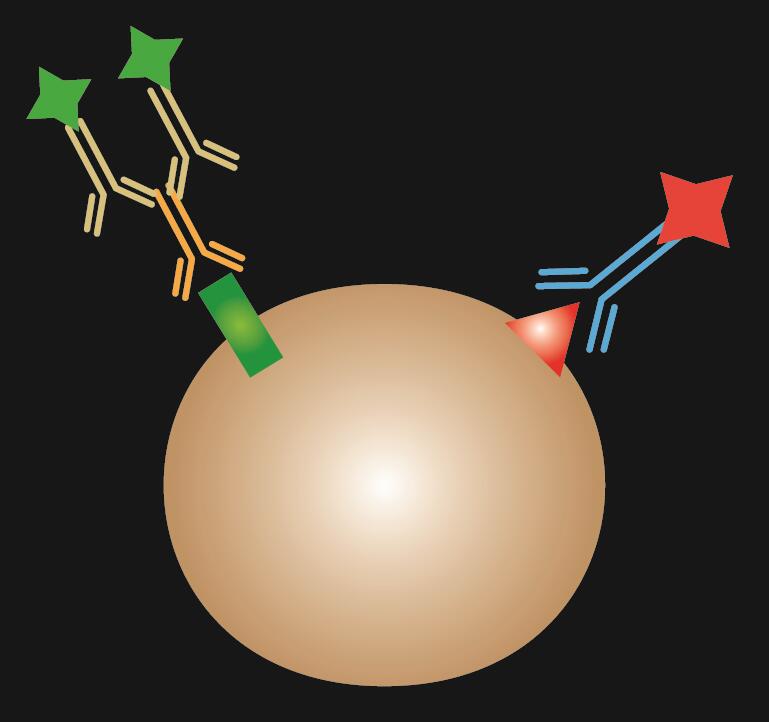 |
| Vorteile |
|
|
|
| Nachteile |
|
|
|
Unter den drei Arten der IF, ist die indirekte IF-Methode am weitesten verbreitet.
Die IF-Methode kann bei Gewebeschnitten, kultivierten Zelllinien und einzelnen Zellen angewendet werden. Das IF-Verfahren ähnelt der Immunhistochemie (IHC).
- Probenentnahme und Fixierung
Die Proben müssen nach der Gewebeentnahme schnell fixiert werden, und es ist besser, bei kleinen Tieren wie Nagetieren eine Vorfixierung durch Herzinfusion mit 4 % Formaldehyd oder Paraformaldehyd durchzuführen. Es wird empfohlen, dass das Gewebe nicht dicker als 10 mm ist und dass das Volumen des Fixiermittels mindestens 15-20 mal größer ist als das Volumen des Gewebes. Die Fixierung ist sehr wichtig, um die Morphologie und Struktur der Zellen sowie die Integrität des Antigens zu erhalten. Daher müssen die Fixierungslösungen für die verschiedenen Antigene und Gewebeproben sorgfältig ausgewählt werden.
Tabelle 2. Fixierungsstrategie für partielle Antigene.
| Antigen | Fixierungslösung | Fixierungsbedingungen |
|---|---|---|
| Most Protein | 95~100% Alkohol 4% Paraformaldehyd |
3~10 min bei 37℃ 4~24 h bei 4℃ |
| Enzym | Aceton | 15 min bei RT |
| Hormon | 95% Alkohol plus 1~5% Eisessig | 30 min bei 4℃ |
| Immunglobulin | 95% Alkohol Carbon Tetrachlorid |
10 min bei 37℃ dann 15 min bei 4℃ |
| Faserprotein | 95% Alkohol plus 1~5% Eisessig | 10 min bei 37℃ dann 15 min bei 4℃ |
| Virus | Aceton Kohlentetrachlorid Alkohol |
5~10 min bei RT dann 30~60 min bei 4℃ |
| Polysaccharid und Bakterien | Aceton 10% Formaldehyd Methanol |
3~10 min bei RT, dann 30~60 min bei 4℃ |
| Lipoid | 10% Formaldehyd | 3~10 min bei RT |
| Kultivierte Zellen | Erwärmt 4% Paraformaldehyd | 15~20 min bei RT |
- Dehydratisierung und Einbettung
Die Dehydratisierung ist bei der Vorbereitung von Gewebeschnitten aus folgenden Gründen erforderlich:
1. Paraffinschnitt: Paraffin ist mit Wasser nicht mischbar.
2. Gefrierschnitte: Aufgetaute Eiskristalle würden die Morphologie der Zellen zerstören.
Die Dehydratisierung erfolgt immer durch Eintauchen des Gewebes in eine seriöse Ethanol- oder Saccharoselösung mit ansteigendem Gradienten.
Danach können die Gewebeproben eingebettet werden, indem bei Paraffinschnitten geschmolzenes Paraffinwachs und bei Gefrierschnitten OCT-Mittel zugegeben wird. Dieser Schritt sorgt für die richtige Härte bei weichen Gewebeproben und ermöglicht es, das Gewebe leicht zu schneiden.
- Schnitt und Färbung
Eingebettete Gewebe können mit einem Mikrotom oder Gefriermikrotom in dünne Scheiben geschnitten werden. Die Dicke der Schnitte sollte entsprechend dem Zelldurchmesser und dem Zweck des IF-Tests festgelegt werden. Dünnere Schnitte (≤10 μm) sollten vor der Färbung direkt auf Objektträger aufgeklebt werden, da sie bei den zahlreichen Waschvorgängen leicht beschädigt werden können. Bei dickeren Schnitten (10~30 μm) lassen sich mit der Free Floating-Methode bessere Bilder erzielen, da der primäre Antikörper durch beide Seiten des Schnitts dringen kann. Frei schwebende Schnitte werden nach dem Färben auf Objektträger montiert. Frei schwebende Schnitte von kleinen Geweben wie der Dorsalganglienwurzel (DRG) der Maus sind schwierig durchzuführen und die Probe kann leicht verloren gehen. Daher wird bei einigen kleinen Gewebeproben die Methode der Stick-Section empfohlen. Die Färbeschritte sollten im Dunkeln durchgeführt werden, wenn es sich um einen mit einem Fluoreszenzfarbstoff konjugierten Antikörper handelt.
Zu den IF-Protokollen:
- Stäbchenschnitt
- Frei schwimmender Schnitt
- Kultivierte Zellen
- Bildgebung und Analyse
Positive Signale werden unter einem Fluoreszenzmikroskop vor einem dunklen Hintergrund dargestellt. Der Ort, der von Interesse ist, wird in der Regel durch Mitfärbung eines Proteins bestimmt, dessen Ort bereits bekannt ist. Alternativ kann zur quantitativen Analyse auch die Anzahl der positiven Zellen oder die Fluoreszenzintensität der positiven Signalisierung gemessen werden. Eine stärkere Fluoreszenzintensität weist beispielsweise auf eine relativ hohe Expression des Zielproteins hin.
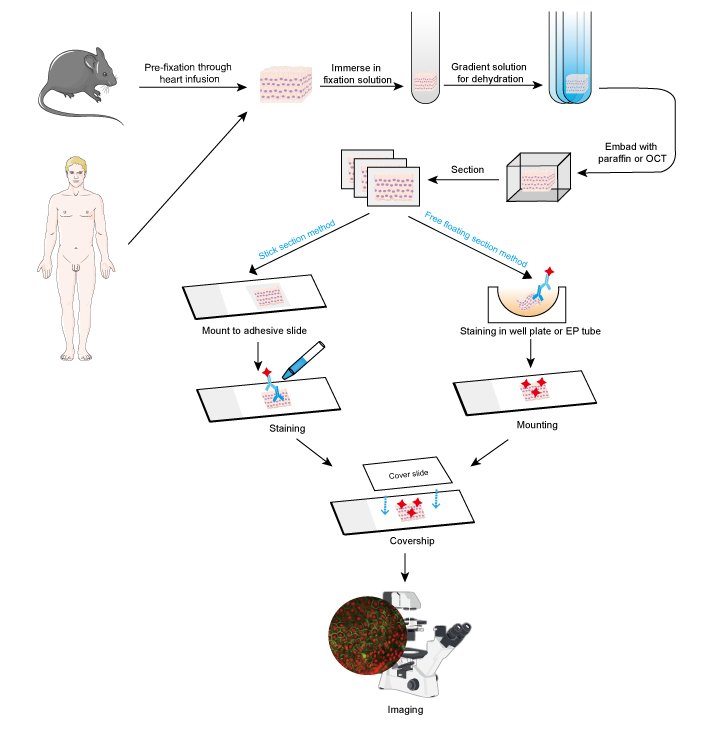
Abbildung 1. Arbeitsablauf der IF an Gewebeschnitten.
IF und IHC sind beides leistungsstarke Verfahren zur Morphologieanalyse mit wichtigen diagnostischen und prognostischen Anwendungen. Einige Unterschiede müssen in Ihrer Forschung berücksichtigt werden:
Tabelle 3. Vergleich zwischen IHC und IF
| IHC | IF | |
|---|---|---|
| Markierungsmethode | Chromogen | Fluoreszierend |
| Bearbeitungsschritt | Mehr als Substrat benötigt | Weniger |
| Bild |
|
|
| Mikroskop | Lichtmikroskop | Fluoreszenzmikroskop |
| Stabilität | Stabil für Jahre | weniger stabil wegen Photobleiche |
| Beispiel (Maus-Hippocampus) |
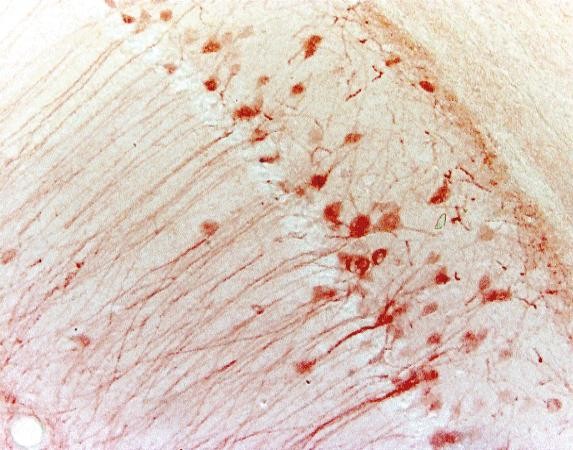 |
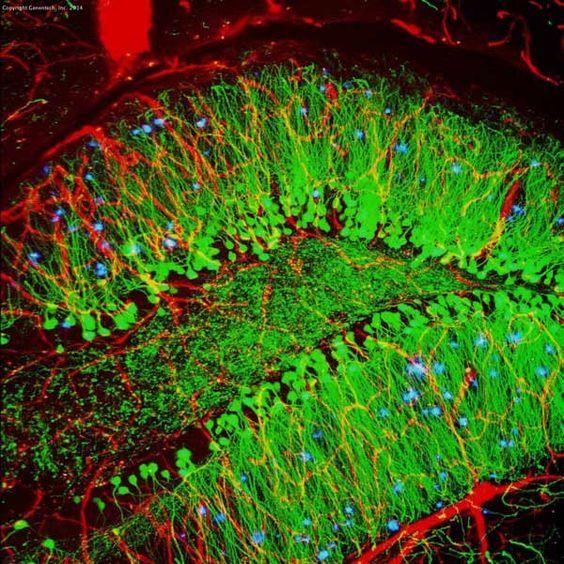 |