Der Perforin/Granzym-Apoptoseweg ist der primäre Signalweg, der von zytotoxischen Lymphozyten zur Beseitigung virusinfizierter und/oder transformierter Zellen genutzt wird. Studien an gengeschädigten Mäusen zeigen, dass Perforin in Kombination mit Granzym die Apoptose auslösen kann. Es ist von entscheidender Bedeutung für die zytotoxische Effektor-Funktion und spielt eine unverzichtbare, aber nicht definierte Rolle bei der Granzym-vermittelten Apoptose.
Perforin und Granzyme
Perforin ist ein porenbildendes Protein und auch als zytoplasmatische Granulat-Toxine bekannt. Granzyme sind eine Familie strukturell verwandter Serinproteasen, die in den zytotoxischen Granula zytotoxischer Lymphozyten (CLs) gespeichert sind. Perforin und Granzyme lösen gemeinsam die Apoptose der Zielzellen aus (Abbildung 1). Granzyme sind für die Auslösung der Apoptose von Zielzellen notwendig, aber sie sind davon abhängig, dass sie von Perforin in geeigneter Weise abgegeben werden. Sowohl Perforin als auch Granzym binden an die Oberfläche der Zielzelle als Teil eines einzigen makromolekularen Komplexes, der mit Serglycin assoziiert ist, was die Wahrscheinlichkeit einer passiven Diffusion der Granzyme weiter verringert.
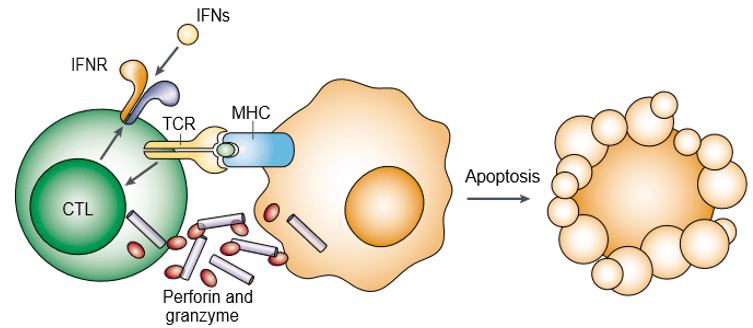
Abbildung 1. Perforin und Granzyme induzieren gemeinsam die Apoptose von Zielzellen.
Beim Menschen gibt es die Granzyme A, B, H, K und M, bei Mäusen die Granzyme A, B, C, D, E, F, G, K, L, M und N. Granzym A (GrA) und Granzym B (GrB) sind die am häufigsten vorkommenden Granzyme und wurden am besten untersucht. Die Funktionen der Granzyme A und B bei der Auslösung der Apoptose der Zielzellen wurden in vitro umfassend untersucht, und sie sind auf molekularer Ebene besser verstanden als die Rolle des Perforins.
Prozess und Regulierung des Perforin/Granzym-Apoptosewegs
Nach der Sekretion durch zytotoxische Lymphozyten dringen die Granzyme in die Zielzellen ein, was ein entscheidender Schritt beim Zelltod ist. Die wichtigsten lytischen Proteine, die in den Granula verpackt sind, sind verschiedene Granzyme und das porenbildende Protein Perforin, das die Internalisierung der Granzyme durch die Zellen erleichtert.
Granzym B löst die Caspase-Aktivierung hauptsächlich indirekt und nicht durch direkte Caspase-Verarbeitung aus. Es erreicht dies durch die direkte Aktivierung von pro-apoptotischen „BH3-only“-Mitgliedern der BCL-2-Familie, wie dem BH3-interacting domain death agonist (Bid). Bid führt zusammen mit den pro-apoptotischen Bax- und/oder Bak-Proteinen der BCL-2-Familie dazu, dass pro-apoptotische mitochondriale Mediatoren wie Cytochrom c in das Zytosol entweichen. Die Freisetzung von Cytochrom c aktiviert pro-Caspase-9, und durch Bindung an den apoptotischen Protease-Aktivierungsfaktor 1 (Apaf-1) wird pro-Caspase-9 zu reifer Caspase-9, die weiterhin das Apoptosom bildet und die nachgeschaltete Caspase-3 aktiviert. Die aktivierte Caspase-3 ist in der Lage, spezifische Substrate wie ICAD (Inhibitor der Caspase-aktivierten DNase, CAD) zu spalten, so dass CAD in den Zellkern wandern und die DNA fragmentieren kann. Neben Bid kann Granzym B auch Mcl-1, ein Mitglied der anti-apoptotischen Bcl-2-Familie, inaktivieren, um das pro-anti-apoptotische Bcl-2-Familienprotein Bim an der äußeren Mitochondrienmembran freizusetzen. Und Granzym B kann auch die Effektor-Caspase-3 und Initiator-Caspase-8 vermitteln, um den Apoptoseweg zu regulieren.
Im Gegensatz zu Granzym B ist Granzym M nicht auf die Mitochondrien angewiesen, um zu regulieren, aber Granzym M kann Granzym B durch die Spaltung von Proteinase-Inhibitor 9 (PI-9) aktivieren, der der Granzym-B-Inhibitor ist. Granzym M kann auch direkt das ICAD spalten, um wie Granzym B CAD freizusetzen.
Granzym A induziert den Verlust des mitochondrialen inneren Membranpotentials und die Freisetzung reaktiver Sauerstoffspezies (ROS). Es erzeugt einzelsträngige DNA-Kerben und keine oligonukleosomalen DNA-Fragmente. Als Reaktion auf ROS verlagert sich der ER-assoziierte SET-Komplex, zu dem SET, Ape1, pp32, HMG2, NM23-H1 und TREX1 gehören, in den Zellkern, wo Granzym A drei Mitglieder des SET-Komplexes spaltet, die an der DNA-Reparatur beteiligt sind: HMG2, Ape1 und SET.
Perforin/Granzyme Apoptosis Pathway in Disease
Studien an gengeschädigten Mäusen zeigen deutlich, dass der Perforin-Stoffwechselweg eng mit der Verteidigung gegen virale Krankheitserreger und transformierte Zellen verbunden ist. In vivo konnte jedoch auch gezeigt werden, dass Perforin eine entscheidende Rolle bei der Immunüberwachung spontan transformierter Zellen und bei der Regulierung der B-Zell-Homöostase und des T-Zell-Gedächtnisses spielt, was bisher nicht vermutet wurde. Paradoxerweise ist Perforin maßgeblich an der Pathogenese bestimmter Autoimmunkrankheitsmodelle beteiligt, wie z. B. an insulinabhängigem Diabetes bei nicht adipösen diabetischen Mäusen (NOD), könnte aber auch andere Autoimmunkrankheiten unterdrücken, wie z. B. die experimentelle autoimmune Enzephalomyelitis (EAE).
Die Perforin/Granzym-Apoptosewege, die die Granulatpolarisierung und -exozytose regulieren, werden derzeit bestimmt, und diese Wege könnten durch die Interaktion von Krebszellen mit einigen zytotoxischen Lymphozyten gestört werden. Die jüngsten Erkenntnisse, dass das Eindringen von Granzymen in Zielzellen die Bindung an spezifische Membranrezeptoren voraussetzt und dass einige Tumore Serinproteaseinhibitoren synthetisieren, die Granzyme neutralisieren können, haben mögliche neue Wege aufgezeigt, auf denen Tumore dem Angriff des Immunsystems entgehen könnten.