Patient mit einer subepithelialen Läsion des Magens
Martín Gómez Zuleta, MD (1)
(1) Abteilung Gastroenterologie, Abteilung für Innere Medizin, Nationale Universität von Kolumbien. Hospital Tunal. Bogotá, Kolumbien..
Eingegangen: 05-10-10 Angenommen: 25-11-10
Abstract
Obwohl subepitheliale Läsionen im oberen Gastrointestinaltrakt selten vorkommen, können sie zu Unsicherheiten bei der Diagnose und Behandlung führen. Anhand eines Falles werden die endosonographischen Befunde beschrieben und die aktuellen Empfehlungen überprüft, um ein rationales Vorgehen bei diesen Läsionen zu ermöglichen.
Schlüsselwörter
Submukosale Tumoren, endoskopischer Ultraschall, GIST.
Klinischer Fall
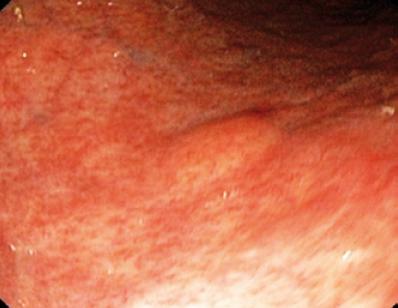
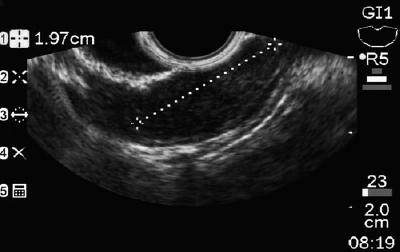
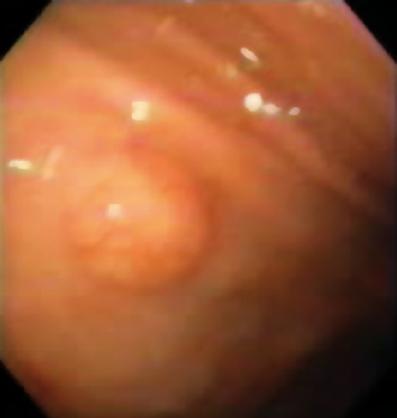
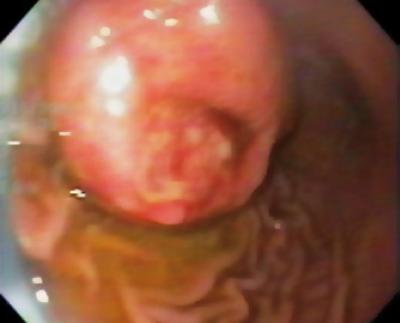
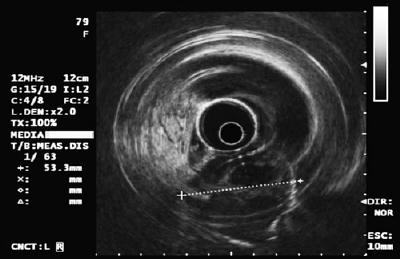
Ein 50-jähriger Mann mit Dyspepsie wurde zur oberen Endoskopie geschickt, bei der eine 9 mm große subepitheliale Läsion im Magenkorpus gefunden wurde (Abbildung 1). Die Biopsie der darüber liegenden Schleimhaut war normal. Der Patient hatte keine medizinische Vorgeschichte, und seine körperliche Untersuchung war normal.
Abbildung 1. Subepitheliale Läsion des Magens.
Initialer Ansatz: Was können wir dann tun?
Eine Masse oder Ausstülpung im Lumen eines Organs, das von normalem Epithel bedeckt ist, wird als subepitheliale Läsion bezeichnet. Es handelt sich um seltene Läsionen, die bei 1 von 300 Endoskopien auftreten dürften (1, 2). Ursachen können intrinsische gutartige oder bösartige Läsionen der Magen-Darm-Wand oder eine extrinsische Kompression durch normale oder pathologische Nachbarstrukturen sein (3).
Diese Läsionen werden in der Regel zufällig entdeckt und stehen oft in keinem Zusammenhang mit Symptomen, wie es bei unserem Patienten der Fall war. Dies kann den Arzt zu Zweifeln veranlassen, ob er spezifischere Untersuchungen durchführen und zusätzliche Untersuchungen vornehmen sollte (4). Unserer Meinung nach sollten alle diese Läsionen untersucht werden, um ihren Ursprung zu klären. Es sollte immer eine Biopsie der darüber liegenden Schleimhaut entnommen werden (es sei denn, wir vermuten einen vaskulären oder zystischen Ursprung), da viele dieser Läsionen ihren Ursprung in der Lamina propria oder der Muscularis mucosa haben können. In diesen Fällen können sie mit einer Pinzette erreicht werden, und es kann eine genaue Diagnose gestellt werden. Sind die Biopsien unauffällig, muss entschieden werden, ob die Untersuchung abgebrochen oder fortgesetzt werden soll.
Wenn die Endoskopie durchgeführt wurde und eine subepitheliale Läsion entdeckt wurde, kann sie sofort bewertet werden. Zunächst müssen wir ihre Größe, Form, Farbe und Beweglichkeit beschreiben und feststellen, ob sie pulsiert oder nicht. Schließlich können wir ihre Konsistenz mit einer geschlossenen Biopsiezange beurteilen und feststellen, ob sie zystisch, fest oder weich, eindrückbar und kissenförmig ist (eine Läsion, die sich langsam erholt). Kissenartige Läsionen mit gelben Lichthöfen sind ein deutlicher Hinweis auf Lipome. Handelt es sich bei der Läsion um eine leichte Unregelmäßigkeit der Schleimhaut, die eine zentrale Vertiefung aufweist, ist dies ein Hinweis auf eine ektopische Bauchspeicheldrüse. Normalerweise haben Zysten oder Varizen eine glatte, symmetrische Schleimhaut. GISTs (gastrointestinale Stromatumoren) können leicht ulzeriert sein, sind aber fest und beweglich (9). Es ist auch sinnvoll, die Position des Patienten zu ändern, um die Möglichkeit einer extrinsischen Läsion auszuschließen, deren endoskopisches Erscheinungsbild sich ändert, wenn der Patient seine Position ändert, einatmet oder wenn der Magen des Patienten mit Luft gefüllt ist (10-12).
Wie lautet die Differenzialdiagnose?
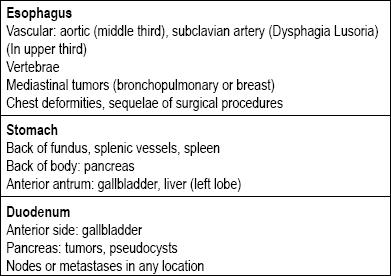
Es gibt viele Arten von Läsionen im Gastrointestinaltrakt, die als subepithelial eingestuft werden können. Ihre Ursachen hängen in der Regel davon ab, ob sich die Läsion in der Speiseröhre, im Magen, im Zwölffingerdarm oder im Enddarm befindet. Als Nächstes ist zu prüfen, ob es sich tatsächlich um eine Wandläsion oder um eine extrinsische Kompression handelt, da rund um den gesamten Gastrointestinaltrakt Strukturen vorhanden sind, die zu einer Kompression führen können (Tabelle 1) (5-8).
Tabelle 1. Primäre Ursachen für extraluminale Kompressionen des oberen Verdauungstrakts.
Sollten alle Läsionen mit endoskopischem Ultraschall (EUS) untersucht werden?
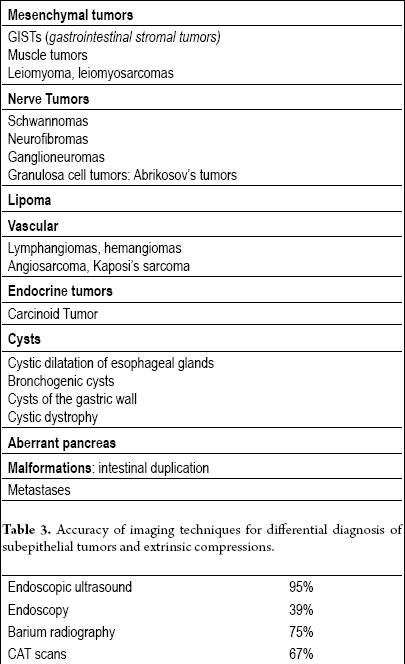
Eigentlich müssen alle subepithelialen Läsionen (Tabelle 2) mit zusätzlichen bildgebenden Verfahren untersucht werden, aber wenn die Läsion weniger als einen Zentimeter groß ist (insbesondere wenn sie gelb ist), ist eine Untersuchung nicht erforderlich, da es sich mit hoher Wahrscheinlichkeit um ein Lipom handelt.
Tabelle 2. Subepitheliale Tumoren des Gastrointestinaltrakts.
Der endoluminale oder endoskopische Ultraschall (EUS) ist die Technik der Wahl (13, 14). Die Genauigkeit des EUS bei der Unterscheidung zwischen einer extraluminalen Kompression und einem subepithelialen Tumor liegt bei über 95 %. Dies ist wesentlich besser als andere bildgebende Verfahren wie konventioneller Ultraschall oder CAT-Scans (15-17) (Tabelle 3).
Tabelle 3. Genauigkeit der bildgebenden Verfahren für die Differentialdiagnose von subepithelialen Tumoren und extrinsischen Verdichtungen.
Wenn wir festgestellt haben, dass die Läsion in der Wand liegt und keine extrinsische Verdichtung ist, müssen wir beurteilen, welcher Wandschicht sie entspricht. Normalerweise wird die Magenwand in Mukosa, Submukosa, Muscularis propria und Serosa unterteilt. Die Schleimhautschicht wird in Epithel, Basalmembran, Lamina propria und Muskelschleimhaut unterteilt. Mit EUS und mit dem Radiogerät kann die Wand in 5 Schichten unterteilt werden (18):
Die erste hyperechoische Schicht entspricht dem oberflächlichsten Teil der Magenschleimhaut.
Die zweite hypoechoische Schicht entspricht dem tiefsten Teil der Schleimhaut, der mit der Muskelschleimhaut korreliert werden kann.
Die dritte hyperechoische Schicht entspricht der submukösen Schicht.
Die vierte hypoechoische Schicht entspricht dem Muskel selbst.
Die fünfte hyperechoische Schicht entspricht der Serosa oder Adventitia.
Normalerweise gibt es keine Läsionen in den Schichten eins und fünf (19), so dass sie auf drei Schichten beschränkt sind. Sie sind in der Regel hypoechoisch, anechoisch oder hyperechoisch.
Diagnose mit endoskopischem Ultraschall
Wir werden jede Präsentation entsprechend ihrer Schicht beschreiben.
Echoschicht zwei
Entspricht dem tiefsten Teil der Schleimhaut oder der Lamina propria und der Muscularis mucosa. Die Läsionen, die in dieser Schicht entstehen, sind selten und in der Regel hypoechoisch.
Hypoechoische Läsionen: Die meisten Tumoren, die in dieser Schicht entstehen, sind muskulär, meist Leiomyome. Sie können Verkalkungen aufweisen und große Läsionen können heterogen sein und Knötchen aufweisen, im Gegensatz zu kleinen Läsionen, die homogen sind. (20).
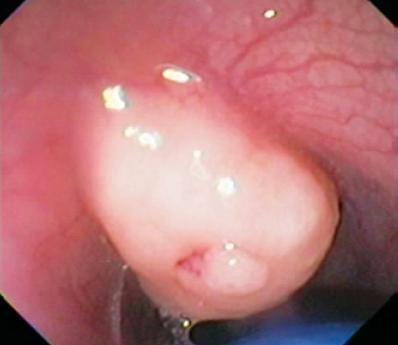
In dieser Schicht finden wir auch Abrikosovs-Tumore oder Granulatzellen. Sie sind in der Regel klein und verformen im Gegensatz zu Leiomyomen aufgrund ihrer Härte die Kugel des Endoskops (Abbildungen 2 und 3). Auch Karzinoide können ihren Ursprung in dieser Schicht haben, meist im Fundus oder im Rektum (Abbildung 4).
Abbildung 2. Gelb gefärbte subepitheliale Läsion im distalen Ösophagus.
Abbildung 3. Das EUS zeigt eine isoechoische Läsion in der dritten Echoschicht, die die Kugel verformt, was auf einen 2 cm großen Granularzelltumor hindeutet
Abbildung 4. Subepitheliale Läsion mit einem netzartigen Muster in der Mitte, das auf einen neuroendokrinen Tumor hindeutet.
Anechoische Läsionen: In der Regel sind in dieser Schicht Einschluss- oder Retentionszysten zu erkennen.
Echoschicht 3
Ein Gewebeband, das im EUS hyperechoisch erscheint. Zahlreiche Tumore können in dieser Schicht entstehen.
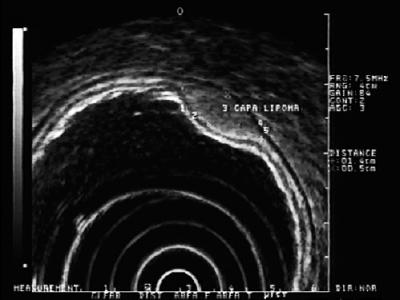
Hyperechoische Läsionen: Die am häufigsten gefundenen Läsionen in dieser Schicht sind Lipome. Sie sind als homogene hyperechoische Läsionen charakterisiert. Normalerweise sind sie kissenförmig, wenn sie mit einer endoskopischen Pinzette gedrückt werden (Abbildung 5) (9).
Abbildung 5. EUS: hyperechoische Läsion in der submukösen Schicht 3, die mit einem Lipom vereinbar ist.
Neurofibrome sind meist hyperechoisch. Sie haben ihren Ursprung in der Submukosa oder der Muscularis propria.
Hypoechoische Läsionen in dieser Schicht können ektopen oder aberranten Pankreata entsprechen. Diese Läsionen sind in der Regel heterogen, und gelegentlich sind in der Mitte echolose duktale Strukturen zu sehen, die Gängen entsprechen können. In der Endoskopie sieht man eine Läsion mit deprimiertem Zentrum (21).
Hypoechoische Läsionen können auch Karzinoidtumoren entsprechen. Obwohl es sich dabei nicht um subepitheliale Tumoren handelt, da sie eher neuroendokrin als mesenchymal sind, können sie in der Verdauungswand lokalisiert sein und dieselbe Art von Knötchen hervorrufen. In der Regel sind sie klein (weniger als ein Zentimeter), hypoechoisch (aber mehr echogen als muskulös) und siedeln sich in der Schleimhaut an. Eine histologische Untersuchung ist in der Regel durch eine Biopsie möglich (22, 23).
Gastrische Lymphome können auch als hypoechoische oder hyperechoische Läsionen der Submukosa auftreten (24).
Anechoische Läsionen in dieser Schicht sind wahrscheinlich vaskuläre Strukturen oder Zysten (25).
Echoschicht vier
entspricht der Muskelschicht. Daher sind die meisten Tumore in dieser Schicht muskulären Ursprungs.
Hyperechoische Läsionen sind sehr selten, können aber mit Lymphomen, neurogenen Tumoren oder Metastasen in Verbindung gebracht werden (26).
Hypoechoische Läsionen: Die meisten Tumoren dieser Schicht sind hypoechoisch, meist Stromatumoren (GIST), wenn sie sich im Magen befinden. Befinden sie sich jedoch in der Speiseröhre, werden sie gewöhnlich als Leiomyome bezeichnet. Andere Läsionen, die dieses Aussehen haben können, sind Metastasen, die von der Lunge oder der Brust ausgehen, und Glomustumore (27). Auch Lymphome können diese Schicht beeinträchtigen, gehen aber in der Regel mit einem Befall der oberen Schichten einher.
GIST (gastrointestinaler Stromatumor) ist die Bezeichnung für eine Läsion, über die sich unser Wissen in den letzten Jahren stark verbessert hat (28-30). Diese Tumoren scheinen ihren Ursprung in totipotentiellen Zellen zu haben, die auch die Ursprungspunkte der so genannten interstitiellen Zellen von Cajal sind. Sie können in Gruppen unterschieden werden: vorwiegend muskulär, vorwiegend neural oder eine Kombination aus beiden. Die Diagnose wird durch den immunhistochemischen Nachweis des CD-117-Proteins (auch bekannt als c-kit-Protein) gestellt, das ein Membranrezeptor mit Tyrosinkinase-Aktivität ist (31).
Die Bedeutung dieser Läsionen liegt darin, dass 30 % ein bösartiges Verhalten aufweisen und Metastasen bilden können. Allein in den Vereinigten Staaten werden jedes Jahr 5.000 bis 6.000 Fälle gemeldet (32). Die Verteilung im Magen-Darm-Trakt ist wie folgt: Magen (40-70%), Dünndarm (20-40%), Kolon und Rektum (5-15%) und Ösophagus (<5%) (33). Das bedeutet, dass es sich bei einer hypoechoischen Läsion der vierten Schicht in der Speiseröhre wahrscheinlich um ein Leiomyom handelt, während es sich bei einer Läsion im Magen in der Regel um einen GIST handelt (Abbildung 6, 7 und 8). Die meisten Patienten befinden sich in ihrem fünften oder sechsten Lebensjahrzehnt. In der Regel befindet sich die Läsion in der vierten Schicht oder in der Muscularis propria, obwohl sie auch in der Muscularis mucosa liegen kann (34). Die meisten Patienten sind asymptomatisch, bis der Tumor groß genug wird, um zu ulzerieren, zu bluten oder zu metastasieren.
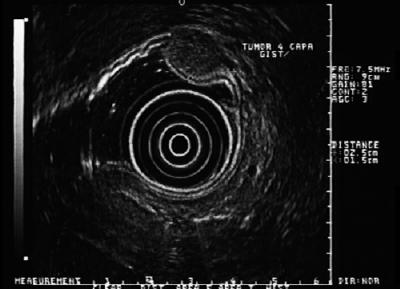
Abbildung 6. EUS zeigt eine hypoechoische Läsion in der vierten Schicht, die mit GIST vereinbar ist.
Abbildung 7. Ulzerierte Läsion, die auf GIST hinweist.
Abbildung 8. Das EUS von Abbildung 7 zeigt eine hypoechoische Läsion in der vierten Echoschicht, die auf einen GIST hindeutet und größer als 5 cm ist.
Aus diesem Grund ist ein GIST, der größer als 3 cm ist, eine Indikation für eine Operation, selbst wenn er asymptomatisch ist (andere Autoren empfehlen eine Grenze von 4 cm). (35). Läsionen von weniger als 3 cm stellen jedoch eine Herausforderung für das Management dar, da die meisten von ihnen gutartig sind. Es sollte jedoch klargestellt werden, dass alle GIST potenziell bösartig sind, und es wurde über kleine GIST berichtet, die Metastasen gebildet haben, insbesondere im unteren Gastrointestinaltrakt. Derzeit sind wir nicht in der Lage, mit endoskopischem Ultraschall das bösartige Potenzial eines GIST vorherzusagen. Wir wissen jedoch, dass Läsionen, die größer als 4 cm sind, unregelmäßige Ränder und/oder zystische Räume aufweisen oder echogene Herde haben, mit hoher Wahrscheinlichkeit bösartig sind (36).
Andererseits kann die endoskopische ultraschallgesteuerte Feinnadelaspiration (EUS-FNA) nicht nur GIST durch den Nachweis von CD-117 diagnostizieren, sondern auch das Vorhandensein des Ki-67-Proteins, das Proliferation anzeigt und auf bösartiges Verhalten schließen lässt (37). Es ist sehr wichtig zu betonen, dass GIST-Läsionen sehr gefährlich sind. Sie müssen kontinuierlich überwacht werden, wobei die Tumorgröße und die Proliferationsrate entsprechend den festgelegten Risiken zu beurteilen sind. Selbst nach einer vollständigen Resektion können diese Läsionen wieder auftreten, vor allem am Ursprungsort, aber auch im Peritoneum oder in der Leber. 40 bis 90 % der Läsionen treten trotz vollständiger Resektion erneut auf. 50 % der Rezidive betreffen die Leber. GIST haben ein viermal höheres Rezidivrisiko, wenn der Primärherd im Darm liegt, als wenn er im Magen liegt (38).
Wie genau ist der endoskopische Ultraschall?
Mehrere Studien haben gezeigt, dass die EUS sehr genau bestimmt, ob sich eine Läsion an der Wand befindet oder nicht und aus welcher Wandschicht die Läsion stammt. Dies ermöglicht uns die Wahl des besten diagnostischen Ansatzes. In einer Studie wurde die Ursprungsschicht bei 48 von 50 Patienten (96 %) mit chirurgischer Bestätigung festgestellt (39). Die Übereinstimmung zwischen den Beobachtern ist sehr gut, insbesondere bei der Identifizierung von Läsionen wie Leiomyomen und vaskulären Läsionen. Es ist wichtig, darauf hinzuweisen, dass das sonografische Erscheinungsbild von Läsionen es uns nicht erlaubt, ihre Ursachen mit 100 %iger Sicherheit zu bestimmen. Eine Studie von Karaca et al. (40) mit 22 Patienten, die sich einer EUS mit anschließender Mukosektomie unterzogen, zeigte, dass die Genauigkeit der EUS nur 45 % betrug. Allerdings waren die Läsionen meist kleiner als 20 mm, und die Genauigkeit des Ultraschalls bei der Unterscheidung von bösartigen und gutartigen Tumoren stieg auf 66 %. Da die sonographischen Kriterien ungenau sein können, scheint es vernünftig, dass wir, wenn möglich, versuchen sollten, eine spezifische Diagnose zu erhalten. Dies kann mit einer EUS-FNA oder einer Schleimhautresektion der Läsion erreicht werden, wie in dieser Arbeit gezeigt wurde. Mekky et al. untersuchten 141 Patienten, bei denen eine EUS-FNA chirurgisch kontrolliert wurde. Sie fanden eine Genauigkeit von 95,6 % für ihre Endergebnisse (41).
Überwachung, Punktionsbiopsie oder Resektion?
Die Entscheidung für Überwachung, Einsatz oder Resektion hängt von mehreren Faktoren ab, darunter die Größe der Läsion, ihr endoskopisches Erscheinungsbild, die Ursprungsschicht und ihre echogenen Eigenschaften. Wenn es sich um eine subepitheliale Läsion von weniger als 1 cm handelt, sind weitere Untersuchungen nicht gerechtfertigt, aber es sollte eine Folgeendoskopie durchgeführt werden. Ist die Läsion größer als 1 cm, ist ein EUS obligatorisch. Wenn die Läsion klein ist und von der ersten, zweiten oder dritten Echoschicht abhängt, kann eine diagnostische Mukosaresektion, die auch therapeutisch ist, durchgeführt werden. Befindet sich die Läsion jedoch in der vierten Schicht und ist weniger als 2 cm groß, wird eine alleinige endoskopische Überwachung empfohlen. Bei einer Größe zwischen 2 cm und 5 cm ist eine EUS-FNA ideal. Wenn festgestellt wird, dass es sich um eine gutartige Läsion handelt, kann nach 6 Monaten eine Nachuntersuchung durchgeführt werden. Wenn sie nicht gewachsen ist, ist keine weitere Überwachung erforderlich. Ist sie bösartig, hat sie ein bösartiges Potenzial oder ist sie größer als 5 cm, wird eine Behandlung empfohlen (42).
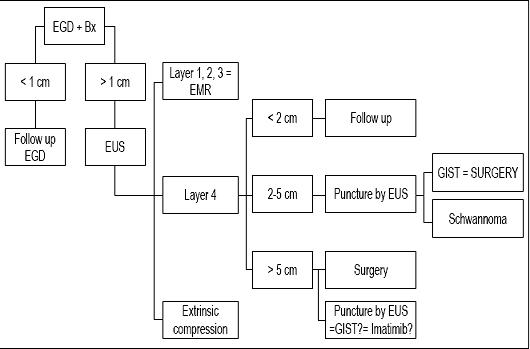
Abschließend lässt sich sagen, dass unser Patient eine Läsion hatte, die kleiner als 1 cm war, so dass wir der Meinung sind, dass seine Läsion nur eine Nachfolgeendoskopie verdient (siehe Algorithmus, Abbildung 9). Eine neue Nachuntersuchung wurde in einem Jahr vorgeschlagen. Wenn die Läsion nicht gewachsen ist, werden weitere Nachuntersuchungen alle 2 oder 3 Jahre angesetzt, aber wenn sie wächst, werden wir eine EUS-FNA und eine immunhistochemische Untersuchung vorschlagen.
Abbildung 9. Behandlungsalgorithmus bei subepithelialen Läsionen. EGD: obere Endoskopie. Bx: Biopsie. EUS: endoskopischer Ultraschall. EMR: Endoskopische Mukosaresektion.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoskopischer Zugang zu gastrointestinalen Stromatumoren. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosalen Tumoren. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskopischer Ultraschall und endoskopische ultraschallgesteuerte Feinnadelaspiration für die Diagnose maligner submuköser Tumoren. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonographic features of gastric ectopic pancreases distinguishable from mesenchymal tumors. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Role of endoscopic ultrasound in the management of submucosal tumours in the esophagus and stomach. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Feinnadelaspirationsbiopsie von Magenduplikationszysten mit endoskopischer Ultraschallführung. Acta Cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Eine Studie über myogene Tumoren des oberen Gastrointestinaltraktes mittels endoskopischer Ultraschalluntersuchung unter besonderer Berücksichtigung der Differentialdiagnose von gutartigen und bösartigen Läsionen. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskopische Ultraschalluntersuchung in der Diagnose von submukösen Tumoren des Magens. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektive Evaluierung einer Over-the-wire-Katheter-US-Sonde. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskopische Ultraschalluntersuchung zur Beurteilung von Tumoren der glatten Muskulatur im oberen Gastrointestinaltrakt: eine Erfahrung mit 42 Fällen. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinale Bildgebung: endoskopischer Ultraschall. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Ausbeute der Gewebeentnahme bei submukösen Läsionen, die mit EUS beurteilt werden. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskopische Sonographie für das initiale Staging und die Nachsorge bei Patienten mit niedriggradigem Magenlymphom des mukosa-assoziierten lymphatischen Gewebes, die medikamentös behandelt werden. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnose von Vormagen-Duplikationszysten durch endoskopische Ultraschalluntersuchung. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonographische Differenzierung von benignen und malignen Stromazelltumoren. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographische Merkmale zur Vorhersage gutartiger und bösartiger gastrointestinaler Stromazelltumoren. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Pathologie und diagnostische Kriterien von gastrointestinalen Stromazelltumoren (GISTs): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Gastrointestinale Stromatumoren und andere mesenchymale Läsionen des Darms. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinal stromal tumors: Von einem chirurgischen zu einem molekularen Ansatz. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management von bösartigen gastrointestinalen Stromatumoren. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Messung von Läsionen durch Endoskopie: ein Überblick. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Eine Studie über myogene Tumoren des oberen Gastrointestinaltrakts mittels endoskopischer Ultraschalluntersuchung unter besonderer Berücksichtigung der Differentialdiagnose von gutartigen und bösartigen Läsionen. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostische Beurteilung von gastrointestinalen Stromatumoren. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. Eine klinisch-pathologische Studie von 77 Fällen mit Korrelation der Merkmale mit nicht-aggressivem und aggressivem klinischen Verhalten. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. submucosal tumors and thick gastric fols. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonographic features of gastric ectopic pancreases distinguishable from mesenchymal tumors. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Role of endoscopic ultrasound in the management of submucosal tumours in the esophagus and stomach. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Feinnadelaspirationsbiopsie von Magenduplikationszysten mit endoskopischer Ultraschallführung. Acta Cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Eine Studie über myogene Tumoren des oberen Gastrointestinaltraktes mittels endoskopischer Ultraschalluntersuchung unter besonderer Berücksichtigung der Differentialdiagnose von gutartigen und bösartigen Läsionen. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskopische Ultraschalluntersuchung in der Diagnose von submukösen Tumoren des Magens. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektive Bewertung einer Over-the-wire-Katheter-US-Sonde. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskopische Ultraschalluntersuchung zur Beurteilung von Tumoren der glatten Muskulatur im oberen Gastrointestinaltrakt: eine Erfahrung mit 42 Fällen. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinale Bildgebung: endoskopischer Ultraschall. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Ausbeute der Gewebeentnahme bei submukösen Läsionen, die mit EUS beurteilt werden. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskopische Sonographie für das initiale Staging und die Nachsorge bei Patienten mit niedriggradigem Magenlymphom des mukosa-assoziierten lymphatischen Gewebes, die medikamentös behandelt werden. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnose von Vormagen-Duplikationszysten durch endoskopische Ultraschalluntersuchung. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographische Merkmale zur Vorhersage von gutartigen und bösartigen gastrointestinalen Stromazelltumoren. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Pathologie und diagnostische Kriterien von gastrointestinalen Stromazelltumoren (GISTs): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Gastrointestinale Stromatumoren und andere mesenchymale Läsionen des Darms. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinal stromal tumors: Von einem chirurgischen zu einem molekularen Ansatz. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management von bösartigen gastrointestinalen Stromatumoren. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Messung von Läsionen durch Endoskopie: ein Überblick. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Eine Studie über myogene Tumoren des oberen Gastrointestinaltrakts mittels endoskopischer Ultraschalluntersuchung unter besonderer Berücksichtigung der Differentialdiagnose von gutartigen und bösartigen Läsionen. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostische Beurteilung von gastrointestinalen Stromatumoren. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. Eine klinisch-pathologische Studie von 77 Fällen mit Korrelation der Merkmale mit nicht-aggressivem und aggressivem klinischen Verhalten. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. submucosal tumors and thick gastric fols. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.