Inhalt
- 1 Einleitung
- 2 Strukturelle Besonderheiten
- 3 Funktion
- 4 Relevanz für die menschliche Gesundheit & Krankheit
- 5 Externe Links
Einleitung
Humane Magenlipase (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) ist die Lipase, die für die Initiierung der Verdauung von Nahrungsfetten im Magen verantwortlich ist. Dieses säurestabile Enzym wird von den Fundushauptzellen des menschlichen Magens sezerniert und katalysiert 10-20 % der gesamten lipolytischen Prozesse (d. h. derjenigen, die den Fettabbau beinhalten) bei gesunden Erwachsenen. HGL katalysiert spezifisch die Hydrolyse von Triacylglycerin, um Diacylglycerin und ein Carboxylat-Nebenprodukt zu erzeugen, ein Prozess, der den anschließenden Fettabbau durch Pankreaslipase erleichtert. Was die Auswirkungen auf Krankheiten betrifft, so gibt es Hinweise darauf, dass die HGL-Sekretion bei Personen mit Gastritis (die häufigste Magenerkrankung, bei der die Magenschleimhaut entzündet ist) verändert ist. Darüber hinaus sind Personen mit eingeschränkter Bauchspeicheldrüsenfunktion (und daher verminderter Bauchspeicheldrüsenlipase) bei der Verdauung von Nahrungsfetten stark auf HGL angewiesen.
Strukturelle Besonderheiten
HGL, ein Hydrolase-Enzym, das aus zwei 379 Aminosäurereste langen Untereinheiten besteht, besitzt eine, die die Reste Ser-153, His-353 und Asp-324 enthält. Diese Struktur ist wesentlich für den Abbau von Lipiden, koordiniert mit einer an Leu-67 und Gln-154, die zur Stabilisierung des Übergangszustands dient. Strukturell weist die menschliche Magenlipase einen Komplex auf (Beta-Sheets in gelb, Alpha-Helices in orange, Coiled Coils in grün und aufgelöste Kohlenhydrate in lila). Die HGL an den Resten 215-244 gibt den Weg frei für die (in rot dargestellten) hydrophoben Regionen, die sowohl das aktive Zentrum als auch die Schnittstelle zum Deckel umgeben. Es wird angenommen, dass diese Bereiche Lipide anziehen und das Andocken fördern.
Funktion
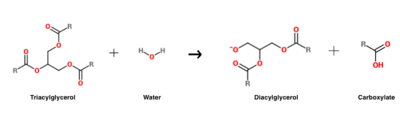
Die Hydrolysereaktion von Triacylglycerin, die von HGL katalysiert wird.
HGL funktioniert bei einem optimalen pH-Wert von etwa fünf und katalysiert in erster Linie die Hydrolyse von kurzkettigen Triacylglycerinen.
Als Esterase mit einem katalytisch aktiven Serin weist HGL einen Mechanismus auf, der dem bekannten Serinesterase-Mechanismus ähnelt. Das im aktiven Zentrum befindliche Serin wird zunächst durch die benachbarte Bildung einer Salzbrücke zwischen Asp-136 und His-152 gefördert, die die Aneignung eines Protons von Ser-153 bewirkt. Das nun stark nucleophile Ser-153 greift das Carbonylkohlenstoffatom der Acetatgruppe in einem Triacylglycerinmolekül an. Die tetraedrische Spezies wird durch das Oxyanion-Loch stabilisiert. Sobald die Spezies jedoch in das kovalent gebundene Acetat und die Lipase zerfällt, wird das Serin deacyliert, wobei Wasser als Nukleophil wirkt. Durch diesen letzten Schritt wird Ser-153 in seinen protonierten Zustand zurückversetzt.
Bedeutung für die menschliche Gesundheit & Krankheit
Die hydrolytische Wirkung von HGL ist bei gesunden Erwachsenen eher nebensächlich, bei denen HGL höchstens 10-20 % des Fettabbaus in der Nahrung steuert. Das Vorhandensein von HGL ist jedoch von entscheidender Bedeutung bei Frühgeborenen, die oft eine schlechte Pankreasfunktion aufweisen, sowie bei Erwachsenen mit pathologischer Pankreasinsuffizienz (z. B. chronische Pankreatitis). Diese Personen sind nicht in der Lage, ausreichende Mengen an Pankreaslipase zu produzieren und müssen sich daher bei der Verdauung von Nahrungsfetten hauptsächlich auf HGL verlassen. Bei diesen Personen ist HGL für die Hydrolyse von 30-60 % der Triglyceride in der Nahrung verantwortlich.
Tomasik et al. (2013) untersuchten die hormonelle Regulierung der HGL-Sekretion bei Kindern und Jugendlichen mit Gastritis. Die HGL-Aktivität wurde in drei Gruppen verglichen: eine Versuchsgruppe, bestehend aus Jugendlichen mit diagnostizierter Helicobacter pylori-Gastritis (n = 10), eine weitere Versuchsgruppe, bestehend aus Jugendlichen mit einer nicht durch H. pylori induzierten Form der Gastritis (n = 10), und eine Kontrollgruppe gesunder Jugendlicher (n = 14). Die HGL-Aktivität sowie die Plasmakonzentrationen von Glucagon-like Peptide-1, Cholecystokinin und glukoseabhängigem insulinotropem Peptid wurden durch die Analyse von Magensaftproben beobachtet, die durch endoskopische Messungen bei jedem Patienten entnommen worden waren.
Patienten, deren oberflächliche Gastritis durch andere Erreger als H. pylori ausgelöst wurde, wiesen sowohl im Vergleich zu gesunden Jugendlichen (p < .005) als auch zu Patienten, bei denen eine H. pylori-Gastritis diagnostiziert wurde (p < .005), niedrigere Werte der HGL-Aktivität auf. Die mittleren Plasmakonzentrationen des glukoseabhängigen insulinotropen Peptids waren bei gesunden Patienten (p < 0,005) niedriger als bei Patienten mit Nicht-H.-pylori-Gastritis (p < .003) und solchen mit H.-pylori-Gastritis (p < 0,01). Die Regulierung der HGL-Sekretion durch Glucagon-like Peptide-1 (GLP-1) und Cholecystokinin (CCK) wurde daher bei Jugendlichen mit Gastritis als verändert angesehen; zur Unterstützung dieses Ergebnisses wurde in der vorhandenen Literatur vorgeschlagen, dass GLP-1 und CCK die HGL-Sekretion hemmen. Darüber hinaus erwies sich glukoseabhängiges insulinotropes Peptid in allen Versuchs- und Kontrollgruppen als starker Aktivator der menschlichen Magenlipaseaktivität.
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG