- Was macht ein Molekül polar?
- Schauen wir uns die Strukturformel von Kohlendioxid an:
- Warum ist Wasser polar?
Wasser ist ein polares Molekül, weil sein Sauerstoff stark elektronegativ ist und als solcher das Elektronenpaar zu sich hinzieht (weg von den beiden Wasserstoffatomen), wodurch es eine leicht negative Ladung erhält.
Die Polarität eines Moleküls hängt nicht nur von seinen einzelnen Atomen ab, sondern auch davon, wie sie um das Zentralatom herum angeordnet sind, d.h. von der räumlichen Anordnung dieser Atome.
Was macht ein Molekül polar?
Die Polarität eines Moleküls hängt mit der Verschiebung der Elektronen in eine bestimmte Richtung zusammen. Diese wiederum hängt von der Polarität der im Molekül vorhandenen Bindungen ab, da diese Bindungen ebenfalls Elektronen enthalten.
In einem Molekül ist das Atom mit der höheren Anziehungskraft auf Elektronen (d.h., es ist elektronegativer als das andere Atom), erhält eine leichte negative Ladung, und die Bindung zwischen den beiden Atomen wird polar.
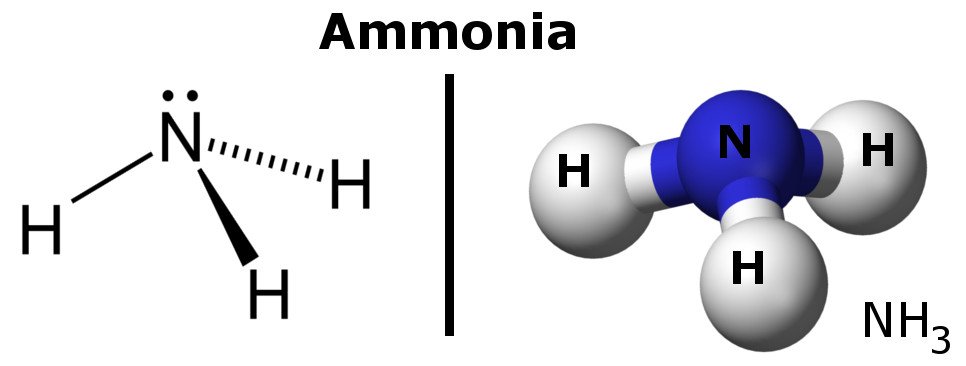
Ammoniak ist ein polares Molekül, weil es Bereiche mit leichten negativen und positiven Ladungen hat.
Insgesamt kann man sagen, dass sich die Elektronendichte einer polaren Bindung zu einem Ende der Bindung hin anhäuft, was dazu führt, dass dieses Ende eine leichte negative Ladung besitzt, während das andere Ende eine leichte positive Ladung hat. Dies macht ein Molekül polar.
Wenn ein Molekül keine Bereiche mit positiver und negativer Ladung aufweist, gilt es als unpolar.
Interessant ist jedoch, dass eine Bindung in einem Molekül umso polarer ist, je größer der Elektronegativitätsunterschied ist. Carbonylverbindungen sind polar, weil der Carbonylkohlenstoff leicht positiv ist. Müsste also Kohlendioxid, das einen positiven Kohlenstoff und zwei teilweise negative Sauerstoffatome enthält, nicht polar sein?
Nun, Kohlendioxid besteht aus zwei Sauerstoffatomen, die an ein Kohlenstoffatom gebunden sind. Sauerstoffatome sind viel elektronegativer als Kohlenstoffatome und müssten daher teilweise negativ geladen sein, während das Kohlenstoffatom leicht positiv geladen sein müsste. Interessanterweise ist das aber nicht der Fall.
Schauen Sie sich die Strukturformel von Kohlendioxid an:
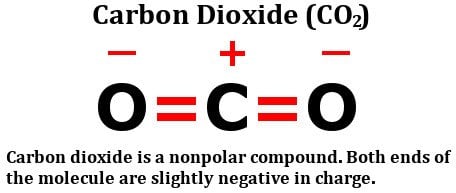
Es besteht aus zwei gleichmäßig elektronegativen Sauerstoffatomen, ja, aber schauen Sie sich an, wie diese Atome um das Kohlenstoffatom angeordnet sind. Sie stehen beide in einem perfekten 180-Grad-Winkel zum Kohlenstoff. Folglich ziehen sie die Elektronendichte des Kohlenstoffs mit gleicher Kraft in entgegengesetzte Richtungen. Das Ergebnis ist, dass die Elektronendichte am Kohlenstoffatom unberührt bleibt, was das Kohlendioxidmolekül unpolar macht.
Kohlendioxid ist ein großartiges Beispiel dafür, dass die Geometrie eines Moleküls eine entscheidende Rolle dabei spielt, ob es polar oder unpolar ist. Schauen wir uns nun ein Wassermolekül an:
Warum ist Wasser polar?
Die chemische Formel von Wasser ist H20, was bedeutet, dass es zwei Wasserstoffatome und ein Sauerstoffatom enthält. Die Wasserstoffatome haben nur ein Elektron in ihrer Schale, während das Sauerstoffatom 6 Valenzelektronen hat.
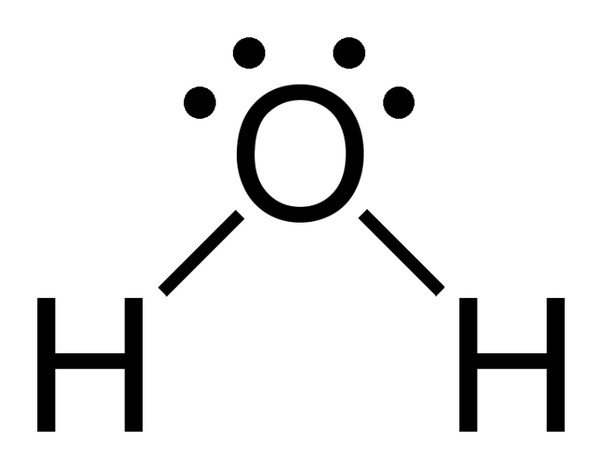
Beachte die 2 einsamen Elektronenpaare auf dem Sauerstoffatom im Wasser.
Da Sauerstoff 6 Elektronen in seiner Valenzschale hat, teilt er sich mit jedem Wasserstoffatom ein Elektron. Auf diese Weise bleiben ihm 4 ungebundene Elektronen in seinen 2 Orbitalen. Diese gebundenen und ungebundenen Elektronenpaare ordnen sich in einer tetraedrischen Form um den Sauerstoff an, weshalb die beiden Bindungen eine gebogene Form zu haben scheinen.
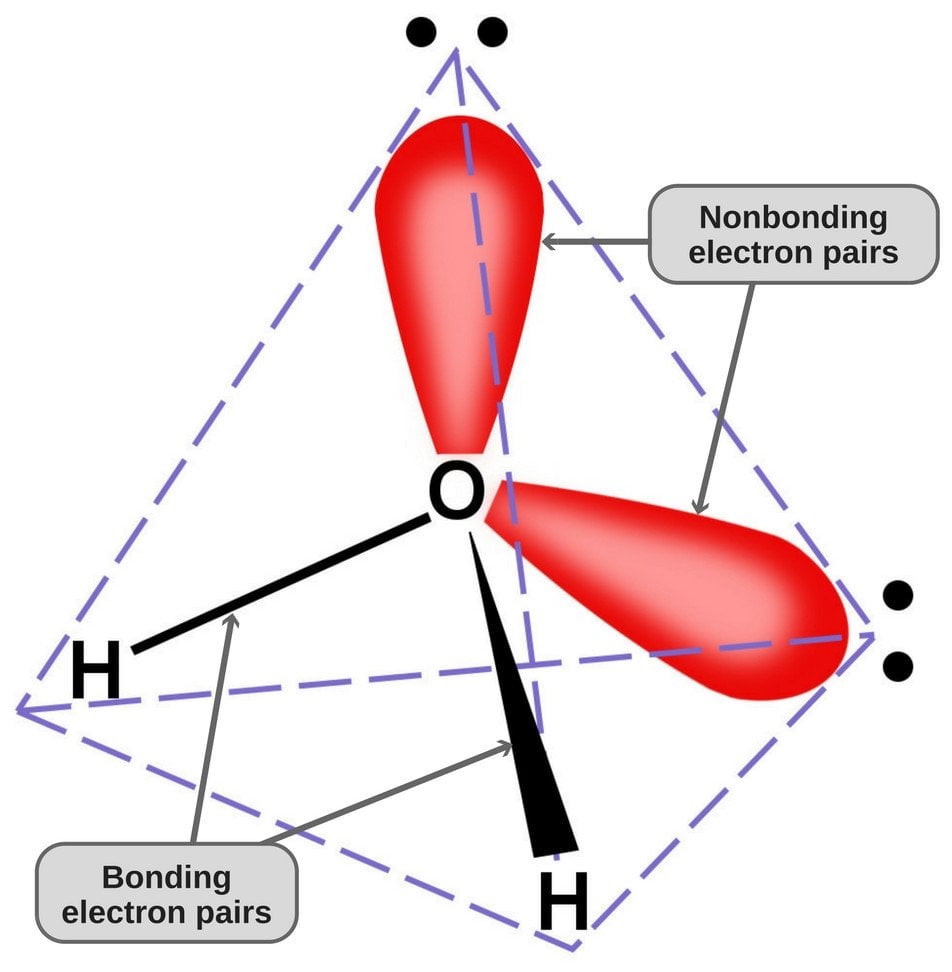
Die tetraedrische Geometrie des Wassermoleküls.
Nun haben sowohl Sauerstoff- als auch Wasserstoffatome unterschiedliche Elektronegativitäten (der Elektronegativitätswert von Wasserstoff ist 2,1, während die Elektronegativität von Sauerstoff 3,5 beträgt); daher sind beide Bindungen polar. Da Sauerstoff elektronegativer ist als Wasserstoff, verschiebt sich die Elektronendichte in diesen beiden Bindungen in Richtung Sauerstoff, wodurch der Bereich um den Sauerstoff negativer wird als die Bereiche um die beiden Wasserstoffatome.
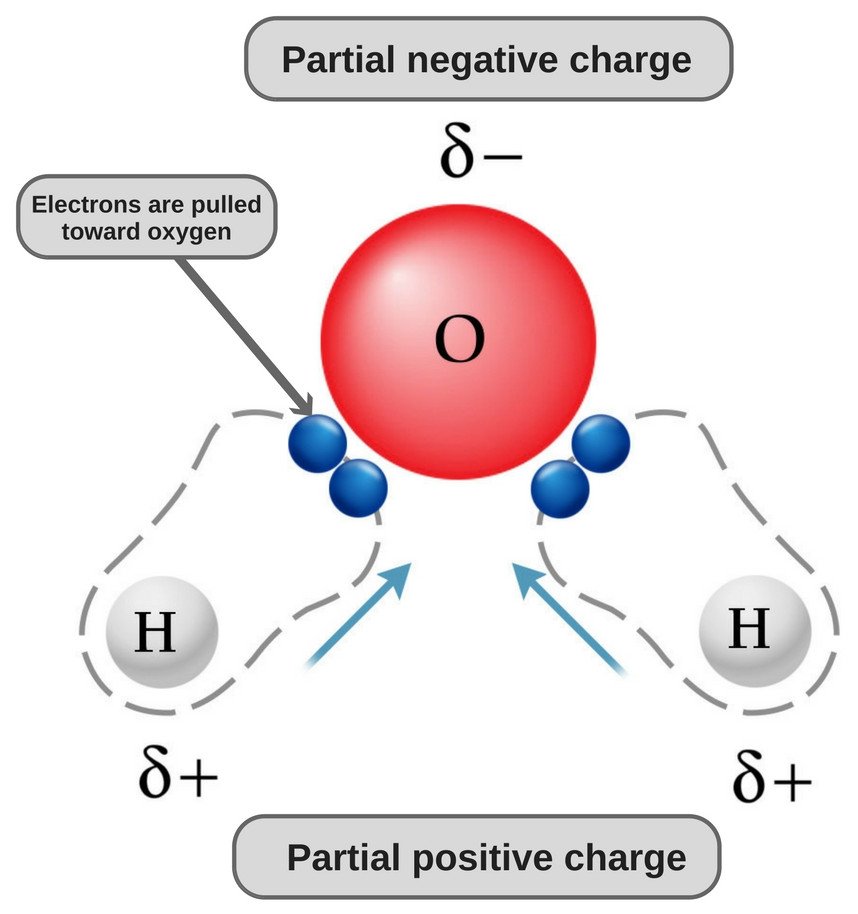
Deshalb wird das Wassermolekül polar!