Interleukin 12 (IL-12) ist ein proinflammatorisches Zytokin mit einem Molekulargewicht von 70 kDa, das aus zwei Untereinheiten besteht, IL-12p35 (35 kDa) und IL-12p40 (40 kDa). Die einzigartige heterodimere Struktur wird von drei Familienmitgliedern geteilt, nämlich IL-23 (p19/p40), IL-27 (p28/Ebi3) und IL-35 (p35/Ebi3).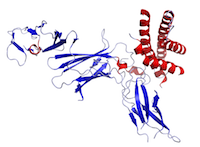
IL-12, auch IL-12p70 genannt, wurde 1989 von Kobayashi M. et al. unabhängig voneinander entdeckt (als natürlicher Killerzellen-stimulierender Faktor bezeichnet) und 1990 von Stern A.S. et al. entdeckt (als zytotoxischer Lymphozyten-Reifungsfaktor bezeichnet).
Abbildung Dies ist eine Struktur von IL-12, die unter Verwendung der Daten aus der Protein Data Bank (PDB: 1F45) erstellt und mit PyMOL gerendert wurde.
IL-12 induziert die Differenzierung naiver CD4+ T-Zellen in Th1-Zellen und aktiviert NK-Zellen. Nach der Aktivierung produzieren die NK-Zellen IFN-γ und IL-2, aber auch IL-12, was auf einen positiven Rückkopplungsmechanismus hinweist. IL-12 schützt CD4+ Th1-Zellen vor dem Antigen-induzierten apoptotischen Tod und es wurde festgestellt, dass es bei der Entwicklung von Th1-Zellen synergistische Effekte mit IL-18 hat. Darüber hinaus spielt IL-12 eine Rolle bei der Wanderung und Migration von T-Zellen, indem es die Expression funktioneller Adhäsionsmoleküle wie P- und E-Selektin-Liganden auf Th1-Zellen, nicht aber auf Th2-Zellen induziert. Daher werden Th1-Zellen selektiv an Stellen rekrutiert, die eine Th1-Immunantwort fördern. Funktionell helfen diese Zellen bei der Beseitigung intrazellulärer Krankheitserreger; im Gegensatz zu Th2-Zellen, die für die humorale Immunität zum Schutz vor extrazellulären Eindringlingen verantwortlich sind. Das Gleichgewicht zwischen IL-12, das Th1-Antworten begünstigt, und IL-4, das Th2-Antworten begünstigt, bestimmt die frühe Präferenz, die in der Immunantwort zum Ausdruck kommt.
IL-12p35 weisen eine erhebliche Sequenzhomologie mit dem Zytokin IL-6 auf, während die p40-Kette strukturell mit der extrazellulären Domäne der α-Kette des IL-6-Rezeptors (IL-6R) homolog ist. Dies deutet darauf hin, dass sich die Struktur von IL-12 aus einem ursprünglichen Zytokin der IL-6-Familie und einem seiner Rezeptoren entwickelt hat. Obwohl IL-12p35-Transkripte in vielen Zelltypen zu finden sind, wird freies IL-12p35 nicht ohne die IL-12p40-Untereinheit sezerniert. Letztere Untereinheit wird vor allem von aktivierten Monozyten, Makrophagen, Neutrophilen und dendritischen Zellen produziert. Die biologischen Aktivitäten von IL-12p70 werden über die Bindung an einen Membranrezeptorkomplex (IL-12R) vermittelt, der aus zwei Untereinheiten besteht: IL-12R-β1 und IL-12R-β2. Während die IL-12R-β1-Untereinheit konstitutiv exprimiert wird, wird die Expression von IL-12R-β2 auf Th1-Zellen durch IFN-γ hochreguliert und korreliert mit der Reaktionsfähigkeit auf IL-12. Nach der Bindung von IL-12 wird der JAK-STAT-Signalweg aktiviert, wobei STAT4 der vorherrschende Vermittler der T-Zell-Reaktionen ist.