Es ist wichtig, die Lewis-Struktur eines Moleküls zu kennen, um seine physikalischen Eigenschaften, die Hybridisierung und die Form des Moleküls zu verstehen. Heute werden wir die Lewis-Struktur von I3- oder auch Triodid-Ion genannt, da es eine negative Ladung trägt. Dieses Molekül besteht aus drei Jodmolekülen, daher der Name der Verbindung: Triodid. Um die Lewis-Struktur des Moleküls zu verstehen, sollten wir die Valenzelektronen des Jodmoleküls kennen.
Lewis-Struktur
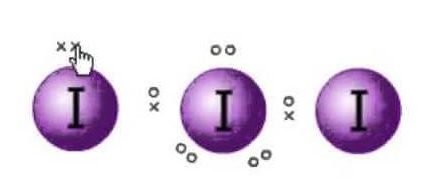
Die Lewis-Struktur ist die Darstellung der Elektronen der Moleküle. Es gibt einsame Paare und Valenzelektronen, die bei der Bestimmung der Hybridisierung und der Form des Moleküls helfen. Da es Jodmoleküle gibt, befindet sich ein Jodmolekül in der Mitte. Außerdem befindet sich Jod in der siebten Gruppe des Periodensystems und hat sieben Valenzelektronen in seiner äußeren Umlaufbahn.

Wir haben hier drei Jodmoleküle, die zusammen mit einem zusätzlichen Elektron eine negative Ladung haben. Die Gesamtzahl der Valenzelektronen ist also : 7×3 + 1= 22.
Insgesamt gibt es 22 Valenzelektronen in diesem Molekül. Nun gibt es eine Oktettregel, der jedes Atom folgt. Nach dieser Regel sollte jedes Atom acht Elektronen in seiner äußeren Umlaufbahn haben. Wenn sich 8 Elektronen in der äußeren Schale des Zentralatoms befinden, gibt es zwei weitere Atome, die ihr Oktett vervollständigen müssen. Da alle Atome acht Elektronen in ihrer äußeren Schale benötigen, um das Oktett zu vervollständigen, wird ein Elektron des zentralen Jodatoms von den beiden benachbarten Jodatomen aufgenommen. Das bedeutet 8-1-1=6.
Da die Elektronen von beiden Atomen eingenommen werden.
So werden die Valenzelektronen am Zentralatom des Jods nun sechs sein. Diese sechs Elektronen bilden die einsamen Elektronenpaare, die keine Bindungen eingehen. Da es nun das Elektronenpaar bildet, gibt es drei einsame Paare und zwei Bindungspaare der Elektronen, da jedes Iodatom eine Bindung mit dem Zentralatom hat, das sich jeweils ein Elektron teilt. Insgesamt gibt es 3 einsame Paare und 2 Bindungspaare am Zentralatom.
Hybridisierung
Für die Kenntnis der Hybridisierung eines beliebigen Moleküls gibt es eine einfache Formel, die verwendet werden kann. Diese Formel wird verwendet, um die Hybridisierungszahl herauszufinden, die dabei hilft, die Hybridisierung des Moleküls zu erkennen.
Die Hybridisierungszahlen und die durch sie bestimmte Hybridisierung werden wie folgt angegeben:
- 2: sp-Hybridisierung
- 3: sp2-Hybridisierung
- 4: sp3-Hybridisierung
- 5: Hybridisierung
Die Formel zur Ermittlung der Zahl lautet:
Hybridisierungszahl: Anzahl der Valenzelektronen + einwertig + (negative Ladung) – (positive Ladung)/2
Die Valenzelektronen des Jodatoms sind 7, da sich sieben Elektronen in der äußersten Schale befinden. Die Anzahl der einwertigen Atome ist zwei, da zwei von drei Jodatomen einwertig sind. Wenn wir nun zur Ladung des I3-Ions kommen, hat es eine negative Ladung, so dass der Wert dieser negativen Ladung 1 ist.
Setzen wir nun alle Werte entsprechend der Formel ein,
7+1+2/2
=10/2
=5
Die Hybridisierungszahl ist also 5, was bedeutet, dass die Hybridisierung sp3d ist.
Eine weitere Möglichkeit, die Hybridisierung eines gegebenen Moleküls zu bestimmen, ist mit Hilfe von Einzelpaaren und Valenzelektronen. Die Anzahl der einsamen Paare in diesem Molekül ist 3, und die Anzahl der Atome, die sich Valenzelektronen teilen, ist 2.
Daher ist 3+2=5, was auch die sp3d-Hybridisierung bestimmt.
Die Form des I3- Ions

Die Form des Moleküls I3- ist linear. Es gibt drei Iodatome, von denen eines eine zusätzliche negative Ladung hat. Aufgrund dieses einen zusätzlichen Elektrons gibt es 3 einsame Elektronenpaare und 2 Bindungspaare, so dass es eine sterische Zahl von 5 hat. Da es drei einsame Elektronenpaare am zentralen Iodidatom gibt, versuchen diese Paare, sich gegenseitig so weit wie möglich abzustoßen. Um also einen größeren Abstand zu haben, nehmen die Paare die Äquatorialpositionen ein, und die beiden anderen Iodatome sind um 180 Grad voneinander entfernt. Somit ist die Gesamtform des I3-Ions linear.
Polarität
So, hier ist der knifflige Teil über dieses Ion, zuerst einmal wie es eine Ladung auf es können wir es als ein polyatomares Ion statt nennen es ein Molekül. Ionen sind die Ladungen, die wir auf den Molekülen sehen. Da I3- ein Elektron hat, hat dieses Ion insgesamt eine negative Ladung. Moleküle haben eine Polarität, weil sie sowohl eine teilweise positive als auch eine teilweise negative Ladung aufweisen. Es gibt ein Dipolmoment auf den Molekülen, das vom Abstand der Ladungen auf dem Molekül abhängt. Wenn der Abstand zwischen den beiden Ladungen größer ist, ist auch das Dipolmoment größer.
Aber wenn wir über das I3- Ion sprechen, ist es ein negativ geladenes Ion. Selbst wenn wir seine Lewis-Struktur zeichnen, sehen wir weder ein Dipolmoment noch polare Bindungen, da die Gesamtladung des Ions negativ ist. Es ist also weder polar noch unpolar. Wenn man das Ion jedoch beschreiben muss, kann man den Ausdruck „wie ein polares Molekül“ verwenden, da I3- in Wasser löslich ist.
Abschließend, um diesen ganzen Artikel zusammenzufassen, ist I3- ein polyatomares Ion mit 22 Valenzelektronen, 3 einsamen Paaren, 2 Bindungspaaren und sp3d-Hybridisierung. Es hat eine lineare Form und besitzt keine Polarität.