Einführung: Defining Terms
Frühere Daten zur Taxonomie von Cannabis wurden bereits überprüft (Russo, 2007), die hier zusammengefasst und ergänzt werden. Cannabis ist eine zweihäusige einjährige Pflanze aus der Familie der Cannabaceae, zu der traditionell auch der Hopfen (Humulus spp.) gehört. Alternativ wurde Cannabis auch den Moraceae, Urticaceae oder sogar den Celtidaceae zugeordnet, und zwar auf der Grundlage von Chloroplasten-Restriktionsstellen-Karten (Weigreffe et al., 1998) und Chloroplasten-Mat-K-Gensequenzen (Song et al., 2001). In jüngerer Zeit wurden acht Gattungen unter die Cannabaceae subsumiert: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema und Parasponia, die etwa 170 Arten umfassen (McPartland, 2018), was durch die genetische Analyse von vier Plastiden-Loci bestätigt wird (Yang et al., 2013). Aktuelle Forschungen an fossilen Pollenproben, die mit den ökologischen Assoziationen von Cannabis mit Steppenbegleitarten (Poaceae, Artemisia, Chenopodiaceae) und Humulus (Hopfen) mit Waldgattungen (Alnus, Salix, Populus) in Verbindung stehen, haben ergeben, dass Cannabis zwar vor mindestens 19,6 Millionen Jahren auf dem tibetischen Plateau entstanden zu sein scheint, aber auch in Europa seit mindestens einer Million Jahren heimisch ist (McPartland et al, 2018), und widerlegt die herkömmliche Weisheit, dass dieser „Lagerbewohner“ vom Menschen dorthin gebracht wurde.
Die Artzuordnung von Cannabis selbst ist sehr umstritten. Cannabis sativa, was „kultiviertes Cannabis“ bedeutet, wurde unter anderem von Fuchs im Jahr 1542 so benannt (Fuchs, 1999), eine Zuordnung 211 Jahre vor der Systematisierung der botanischen Binomialien durch Linnaeus in seinem Species Plantarum (Linnaeus, 1753). Lamarck schlug daraufhin Cannabis indica, eine kleinwüchsigere, berauschende indische Pflanze aus Indien, als eigene Art vor (Lamarck, 1783). In den folgenden Jahrhunderten blieb die Frage mit zwei gegensätzlichen Philosophien ungelöst. Ernest Small hat sich für das Konzept einer einzigen Art eingesetzt (Small und Cronquist, 1976). Polytypische Behandlungen von Cannabis fanden ebenfalls Anhänger (Schultes et al., 1974; Anderson, 1980), und zwar aufgrund morphologischer Kriterien, die eine Trennung von Cannabis sativa L. Cannabis indica Lam. und Cannabis ruderalis Jan. nahelegen, ein Schema, das durch systematische Chemotaxonomie unterstützt wird. Die Hauptkomponentenanalyse (PCA) von 157 Cannabis-Akzessionen aus der ganzen Welt, bei der die Allozymhäufigkeiten an 17 Genorten bewertet wurden, legt eine Trennung nahe (Hillig, 2005b). „Sativa“-Genpools aus osteuropäischen Ruderalproben wurden mit schmalblättrigen europäischen und zentralasiatischen Faser- und Samenpflanzen in Verbindung gebracht, während eine „Indica“-Gruppierung Samen- und Faserpflanzen aus dem Fernen Osten sowie breitblättrige Drogenpflanzen aus den meisten anderen Teilen der Welt sowie Wildformen vom indischen Subkontinent umfasste. Die zentralasiatischen Proben vom Straßenrand (Cannabis ruderalis) sollten eine dritte Gruppe darstellen. Gaschromatographie- (GC) und Stärke-Gel-Elektrophorese-Studien legten ebenfalls eine Artentrennung von sativa und indica nahe (Hillig und Mahlberg, 2004).
Agronomische Faktoren in 69 Proben legten die Einbeziehung von östlichem Hanf und Drogenpflanzen in Cannabis indica nahe (Hillig, 2005a), eine Einteilung, die durch Fragmentlängenpolymorphismen unterstützt wurde (Datwyler und Weiblen, 2006).
In jüngerer Zeit schien die PCA auf den Terpenoid-Gehalt als überzeugendsten chemotaxonomischen Marker zur Unterscheidung zwischen vermeintlichen Sativa- und Indica-Arten hinzuweisen (Elzinga et al., 2015). In ähnlicher Weise war die PCA geeignet, die Droge Cannabis von Hanf zu unterscheiden (Sawler et al., 2015). In einer neueren Studie wurde die Abgrenzung von Drogen-Cannabis von Hanf-Akzessionen durch die Genotypisierung von 13 Mikrosatelliten-Loci im gesamten Genom nachgewiesen, nicht nur von Genen, die die Cannabinoid- oder Faserproduktion beeinflussen (Dufresnes et al., 2017). Professor Giovanni Appendino hat das Vorhandensein des cis-Δ9-THC-Stereoisomers nur in den Hanf-Akzessionen festgestellt (Giovanni Appendino, persönliche Mitteilung). Angesichts des aktuellen Trends, Hanf mit Drogensorten zu kreuzen, um gesetzliche Beschränkungen für den THC-Gehalt zu vermeiden, könnten diese Unterscheidungen jedoch auf der Strecke bleiben.
Die Kontroverse um Cannabis-Arten, Cannabis sativa vs. indica vs. afghanica, hält bis heute unvermindert an und wird von den Protagonisten mit leidenschaftlichen Argumenten geführt (Clarke und Merlin, 2013, 2016; Small, 2015; McPartland und Guy, 2017; Small, 2017). Dieser Autor, der auf jeder Seite des Themas stand, hat sich dafür entschieden, die unversöhnliche taxonomische Debatte als unnötige Ablenkung zu vermeiden (Piomelli und Russo, 2016) und stattdessen zu betonen, dass nur die biochemischen und pharmakologischen Unterschiede zwischen den Cannabis-Sorten relevant sind. In seiner kürzlich erschienenen bahnbrechenden Übersichtsarbeit stimmte McPartland zu: „Die Kategorisierung von Cannabis als ‚Sativa‘ oder ‚Indica‘ ist zu einer Übung in Vergeblichkeit geworden. Die allgegenwärtige Kreuzung und Hybridisierung macht ihre Unterscheidung bedeutungslos.“ (McPartland, 2018) (S. 210).
Eine weitere unsinnige Nomenklaturkontroverse bezieht sich im allgemeinen Sprachgebrauch auf Cannabis-„Stämme“, eine Bezeichnung, die für Bakterien und Viren, aber nicht für Pflanzen angemessen ist (Bailey und Bailey, 1976; Usher, 1996; Brickell et al., 2009), insbesondere bei Cannabis, wo die chemische Sorte, abgekürzt „Chemovar“, die angemessenste Bezeichnung ist (Lewis et al, 2018).
Das Cannabisgenom und die alternative biochemische Produktion des Wirts
2011 war ein Meilenstein für die Cannabisgenomik, als Medical Genomics und Nimbus Informatics einen Online-Bericht über die vollständige Genomsequenz mit 400 Millionen Basenpaaren veröffentlichten, dem sich kurz darauf ein Entwurf des Genoms und des Transkriptoms anschloss (van Bakel et al., 2011).
Diese Entwicklung löste große Aufmerksamkeit und Kontroversen darüber aus, was sie bedeuten könnte. Während das menschliche Genom etwa 20 Jahre zuvor analysiert worden war, waren die Auswirkungen auf Cannabis Gegenstand zahlreicher Spekulationen.
Die Nachricht löste eine Flut neuer Forschungsarbeiten aus, aber in der angewandten Cannabisgenetik waren bereits erhebliche Fortschritte erzielt worden. Die Identifizierung und Synthese von Δ9-Tetrahydrocannabinol (THC) gelang 1964 in Israel (Gaoni und Mechoulam, 1964), aber erst viel später gelang die Klonierung seines Biosyntheseenzyms, der Tetrahydrocannabinolsäure-Synthase (THCA-Synthase) (Sirikantaramas et al., 2004; Abbildung 1). Es folgte die Kristallisation des Enzyms (Shoyama et al., 2005). Die Cannabidiol-Säure-Synthase, die Cannabidiol-Säure (CBDA), den Vorläufer von Cannabidiol (CBD), katalysiert, war bereits zuvor identifiziert und in reiner Form hergestellt worden (Taura et al., 1996; Abbildung 1). Diese Entwicklungen gaben den Anstoß für weitere Entdeckungen, darunter die archäologisch-phytochemische Entdeckung der THCA-Synthase in einem 2700 Jahre alten Cannabis-Cache aus einem Grab in Zentralasien zusammen mit zwei bisher nicht gemeldeten Einzelnukleotid-Polymorphismen (SNPs) in der Gensequenz des Enzyms (Russo et al., 2008).
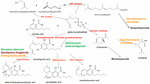
Abbildung 1. Biosynthesewege und Enzyme (rot) von Cannabis sativa unter Angabe der natürlichen Art Helichrysum umbraculigerum und alternativer Arten (in Farbe), die gentechnisch verändert wurden, um nachfolgende Produkte zu produzieren.
Bis 2011 waren die Enzyme für die Produktion der wichtigsten Phytocannabinoide identifiziert worden. In ähnlicher Weise hat die selektive, fortschrittliche Mendelsche Züchtung Cannabissorten hervorgebracht, die reich an spezifischen Einzelkomponenten sind. So wurden Pflanzen mit hohem THC- und CBD-Gehalt für die pharmazeutische Entwicklung gezüchtet (de Meijer et al., 2003; de Meijer, 2004), und analog dazu wurden Linien mit hohem Cannabigerol- (CBG) (de Meijer und Hammond, 2005) und Cannabichromen-Gehalt (CBC) gezüchtet (de Meijer et al., 2009a). Die selektive Züchtung erstreckte sich auch auf Propyl-Phytocannabinoid-Analoga, Tetrahydrocannabivarin (THCV), Cannabidivarin (CBDV), Cannabigerivarin (CBGV) und Cannabichromivarin (CBCV) (de Meijer, 2004). Die Verfügbarkeit von Pflanzen mit hohen Titern dieser „kleinen Cannabinoide“ verspricht interessante neue pharmazeutische Anwendungen (Russo, 2011; Russo und Marcu, 2017).
Der Zugang zum Cannabisgenom könnte die Herstellung von THC-Knockout-Pflanzen mittels CRISPR-Technologie (clustered regularly-interspaced short palindromic repeats) vereinfachen. Während dies für die industrielle Hanfzucht attraktiv sein könnte, hat eine frühere Generation der Pflanzenzucht bereits Hanfsorten hervorgebracht, die problemlos die internationalen Beschränkungen erfüllen, die einen THC-Gehalt von 0,1 % oder weniger verlangen (Wirtshafter, 1997; McPartland et al., 2000; Small und Marcus, 2003). Tatsächlich wurde auch cannabinoidfreies Cannabis ohne funktionelle Cannabigerolsäure-Synthase (Abbildung 1) auf konventionelle Weise hergestellt (de Meijer et al., 2009b). Somit bleibt unklar, ob eine gentechnische Veränderung von Cannabis überhaupt notwendig ist, da diese Pflanze mit ihrer unglaublichen Plastizität bereits eine große biochemische Vielfalt aufweist. Die Einführung von Cannabis mit gentechnisch veränderten Organismen (GVO) würde in bestimmten Teilen der Bevölkerung erhebliche Kontroversen auslösen und wahrscheinlich eine Reihe von rechtlichen Verwicklungen um Patent- und Züchtungsrechte nach sich ziehen.
Man kann sich leicht eine Vielzahl weiterer Science-Fiction-Szenarien vorstellen. In den 1990er Jahren verbreitete ein Internet-Hoax das Gerücht, ein apokrypher Professor Nanofsky habe Gene für die THC-Produktion in Orangen (Citrus x. sinensis (L.) Osbeck) eingeführt. Obwohl dies technologisch möglich wäre, wäre ein solcher Versuch angesichts der enormen Cannabinoid-Produktion von Cannabis selbst nicht mehr als eine Labor-Karnevalsnummer. Eine heimliche Pfefferminz-Chemovarie (Menthax piperita Lamiaceae) mit illegalen Phytocannabinoiden in den Drüsentrichomen ihrer Blätter könnte die logischere Wahl für solche subversiven Tagträume im Untergrund sein und Rhizome und Ausläufer entlang von Wasserläufen in die ganze Welt schicken.
Frühere Behauptungen über die Produktion von Cannabidiol aus Hopfen (Humulus lupulus L. Cannabaceae) und Flachs (Linum usitatissimum L. Linaceae) sind nicht belegt, aber Cannabigerolsäure und Cannabigerol wurden in südafrikanischem Helichrysum umbraculigerum Less. Asteraceae (Bohlmann und Hoffmann, 1979; Appendino et al., 2015; Russo, 2016; Abbildung 1), jedoch ohne Angabe der Konzentration. Diese Behauptung wurde kürzlich durch Spurenmengen bestätigt, die in getrockneten Proben von Pflanzenteilen beobachtet wurden (Mark Lewis, persönliche Mitteilung).
Da die Komplexität der rein biochemischen de-novo-Synthese von Cannabinoiden als nicht kosteneffizient erachtet wurde (Carvalho et al., 2017), wurden alternative mikrobielle Wirte vorgeschlagen (Zirpel et al., 2017). Im Jahr 2004 gelang die cDNA-Klonierung der THCA-Synthase, die die Umwandlung von Cannabigerolsäure (CBGA) in THC ermöglicht (Sirikantaramas et al., 2004), und es wurde eine 8%ige THCA-Produktion in Tabakhaarwurzeln (Nicotiana tabacum cv.Xanthi Solanaceae) bei CBGA-Fütterung nachgewiesen (Abbildung 1). Das Enzym wurde auch in dem Insekt Spodoptera frugiperda (J.E. Smith) Noctuidae (Herbstheerwurm) durch ein rekombinantes Baculovirus exprimiert. Anschließend wandte sich diese Forschungsgruppe der Hefe Pichia pastoris (jetzt Komagataella phaffii Phaff Saccharomycetaceae) zu (Taura et al., 2007; Abbildung 1) und erreichte eine Umwandlung von CBGA in THCA von 98 % innerhalb von 24 Stunden mit einer Ausbeute von 32,6 mg/L Medium. Eine rekombinante Form der THCA-Synthase erwies sich als 4,5-mal effizienter als in Cannabis und 12-mal effizienter als in S. frugiperda. Dieser Prozess wurde anschließend mit einer 64,5-fachen Verbesserung der Aktivität optimiert (Zirpel et al., 2018), wobei eine Produktion von 3,05 g/L THCA in K. phaffii nach 8 Stunden Inkubation bei 37 °C berichtet wurde. Eine einfache Berechnung zeigt, dass diese Ausbeute auch bei der Extraktion von nur 15 g 20% THCA aus Cannabiskraut erzielt werden könnte.
Die Produktion von Cannabis-Terpenoiden ist auch in anderen Wirten möglich. Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae-Mutanten, denen das Enzym Farnesyldiphosphat-Synthase fehlt, akkumulieren stattdessen Geranylpyrophosphat, das in die Produktion des medizinisch nützlichen Terpenoids Linalool umgelenkt wird (Oswald et al., 2007; Abbildung 1). In ähnlicher Weise haben andere Forscher die biosynthetischen Fähigkeiten der Mitochondrien in S. cerevisiae genutzt, um die Farnesyldiphosphat-Produktion von Sesquiterpenoiden zu steigern (Farhi et al., 2011), die allerdings nicht in Cannabis vorkommen.
Zurzeit sind die vorhandenen Cannabis-Genomsequenzen nicht vollständig annotiert. Folglich wird angewandtes Vorwissen und Detektivarbeit erforderlich sein, um praktische Daten über die genetische Funktion von Cannabis zu erhalten. Das größte Potenzial für derartige Untersuchungen liegt im Bereich der Epigenetik, die vererbbaren Veränderungen der Genexpression oder des Phänotyps der Pflanze zugrunde liegt. Der auffälligste Mangel ist das fehlende Wissen über die Regulierung der Cannabinoidproduktion. Das Verständnis der Biosynthesewege und der Regulierung der Terpensynthasen, die die Cannabis-Terpenoide produzieren, hat gerade erst begonnen (Booth et al., 2017) und ist nach wie vor ein reifes Ziel für zusätzliche Forschung (Russo, 2011).
Ein weiteres Problem bei der Cannabiszucht bleibt der Mangel an Belegexemplaren (die von der US Drug Enforcement Administration ohne Schedule I-Lizenz verboten sind) und die formale Hinterlegung von Chemovar-Zugängen in Saatgut- und Gewebedepots. Letzteres wurde von GW Pharmaceuticals und unabhängig davon von NaPro Research (Lewis et al., 2018) in der National Collection of Industrial, Food and Marine Bacteria (NCIMB) in Schottland durchgeführt. Viele Privatunternehmen scheuen die gemeinsame Nutzung von Keimplasma aufgrund rechtlicher Beschränkungen und der Angst vor dem Verlust des geistigen Eigentums.
Cannabis-Synergie
Im Jahr 1998 stellten die Professoren Raphael Mechoulam und Shimon Ben-Shabat die These auf, dass das Endocannabinoid-System einen „Entourage-Effekt“ aufweist, bei dem eine Vielzahl „inaktiver“ Metaboliten und eng verwandter Moleküle die Aktivität der primären endogenen Cannabinoide, Anandamid und 2-Arachidonoylglycerol, deutlich erhöht (Ben-Shabat et al., 1998). Sie postulierten auch, dass dies dazu beiträgt zu erklären, warum pflanzliche Drogen oft wirksamer sind als ihre isolierten Bestandteile (Mechoulam und Ben-Shabat, 1999). Obwohl die Einzelmolekülsynthese nach wie vor das vorherrschende Modell für die Arzneimittelentwicklung ist (Bonn-Miller et al., 2018), wurde das Konzept der pflanzlichen Synergie zeitgleich ausgiebig demonstriert, wobei die pharmakologischen Beiträge von „kleineren Cannabinoiden“ und Cannabis-Terpenoiden zur pharmakologischen Gesamtwirkung der Pflanze angeführt wurden (McPartland und Pruitt, 1999; McPartland und Mediavilla, 2001; McPartland und Russo, 2001, 2014; Russo und McPartland, 2003; Wilkinson et al., 2003; Russo, 2011). Mehrere einschlägige Beispiele für den Entourage-Effekt bei Cannabis sind anschaulich:
In einer randomisierten kontrollierten Studie mit oromukosalen Extrakten auf Cannabisbasis bei Patienten mit hartnäckigen Schmerzen trotz optimierter Opioidbehandlung konnte sich ein THC-dominierter Extrakt nicht positiv von Placebo abgrenzen, während sich ein Ganzpflanzenextrakt (Nabiximols, vide infra) mit sowohl THC als auch Cannabidiol (CBD) als statistisch signifikant besser erwies als beide (Johnson et al,
In Tierstudien zur Analgesie erzeugt reines CBD eine biphasische Dosis-Wirkungs-Kurve, bei der kleinere Dosen die Schmerzreaktionen reduzieren, bis ein Spitzenwert erreicht wird, nach dem weitere Dosissteigerungen unwirksam sind. Interessanterweise entfällt bei der Anwendung eines Cannabisextrakts mit vollem Spektrum und äquivalenten CBD-Dosen die biphasische Reaktion zugunsten einer linearen Dosis-Wirkungs-Kurve, so dass der Pflanzenextrakt bei jeder Dosis analgetisch wirkt, ohne dass ein Deckeneffekt beobachtet wird (Gallily et al, 2014).
Eine kürzlich durchgeführte Studie mit mehreren menschlichen Brustkrebszelllinien in Kultur und implantierten Tumoren zeigte die Überlegenheit einer Behandlung mit einem Cannabisextrakt gegenüber reinem THC, was bei ersterem offenbar auf das Vorhandensein von geringen Konzentrationen von Cannabigerol (CBG) und Tetrahydrocannabinolsäure (THCA) zurückzuführen ist (Blasco-Benito et al, 2018).
Antikonvulsive Wirkungen von Cannabidiol wurden in den 1970er Jahren bei Tieren festgestellt, die ersten Versuche am Menschen fanden 1980 statt (Cunha et al., 1980). In einem kürzlich durchgeführten Experiment an Mäusen mit durch Pentylenetetrazol ausgelösten Krampfanfällen wurden fünf verschiedene Cannabisextrakte mit gleichen CBD-Konzentrationen verwendet (Berman et al., 2018). Obwohl alle Extrakte im Vergleich zu unbehandelten Kontrollen Vorteile zeigten, wurden deutliche Unterschiede in den biochemischen Profilen der Nicht-CBD-Cannabinoide beobachtet, die wiederum zu signifikanten Unterschieden in der Anzahl der Mäuse, die tonisch-klonische Anfälle entwickelten (21,5 – 66,7 %), und in den Überlebensraten (85 – 100 %) führten, was die Relevanz dieser „kleinen“ Komponenten unterstreicht. Diese Studie unterstreicht die Notwendigkeit der Standardisierung in der pharmazeutischen Entwicklung, und obwohl sie als Unterstützung des therapeutischen Einzelmolekülmodells (Bonn-Miller et al., 2018) ausgelegt werden könnte, muss betont werden, dass komplexe pflanzliche Stoffe die amerikanischen FDA-Standards erfüllen können (Food and Drug Administration, 2015). Konkret haben zwei Medikamente auf Cannabisbasis die Zulassung erhalten, Sativex® (Nabiximols, US Adopted Name) in 30 Ländern und Epidiolex® in den Vereinigten Staaten.
Die Frage stellt sich also: Kann eine Cannabiszubereitung oder ein einzelnes Molekül zu rein sein und damit das Synergiepotenzial verringern? Jüngste Daten deuten darauf hin, dass dies durchaus möglich ist. Anekdotische Informationen von Ärzten, die Cannabisextrakte mit hohem CBD-Gehalt zur Behandlung schwerer Epilepsien wie dem Dravet- und dem Lennox-Gastaut-Syndrom verwenden, zeigten, dass ihre Patienten eine deutliche Verbesserung der Anfallshäufigkeit aufwiesen (Goldstein, 2016; Russo, 2017; Sulak et al., 2017), und zwar mit Dosen, die weit unter denen lagen, die in formellen klinischen Studien mit Epidiolex, einem 97 % reinen CBD-Präparat ohne THC, berichtet wurden (Devinsky et al., 2016, 2017, 2018; Thiele et al., 2018). Diese Beobachtung wurde kürzlich einer Meta-Analyse von 11 Studien mit insgesamt 670 Patienten unterzogen (Pamplona et al., 2018). Diese Ergebnisse zeigten, dass sich 71 % der Patienten mit CBD-haltigen Cannabisextrakten im Vergleich zu 36 % mit gereinigtem CBD verbesserten (p < 0,0001). Die Ansprechrate bei einer 50%igen Verbesserung der Anfallshäufigkeit war in den beiden Gruppen statistisch nicht unterschiedlich, und beide Gruppen erreichten bei etwa 10 % der Patienten einen anfallsfreien Status. Allerdings waren die mittleren Tagesdosen in den Gruppen sehr unterschiedlich: 27,1 mg/kg/d für reines CBD gegenüber nur 6,1 mg/kg/d für CBD-reiche Cannabisextrakte, eine Dosis, die nur 22,5 % derjenigen für CBD allein beträgt. Darüber hinaus war die Häufigkeit leichter und schwerer unerwünschter Ereignisse bei Patienten mit gereinigtem CBD im Vergleich zu Patienten mit CBD-reichen Extrakten nachweislich höher (p < 0,0001), ein Ergebnis, das die Autoren auf die niedrigere Dosis zurückführten, die ihrer Meinung nach durch die synergistischen Beiträge anderer Begleitstoffe erreicht wurde. Diese Beobachtungen unterstützen die Hypothese einer größeren Wirksamkeit von Cannabisextrakten, die mehrere krampflösende Komponenten wie CBD, THC, THCA, THCV, CBDV, Linalool und sogar Caryophyllen kombinieren (Lewis et al, 2018).
Diese und andere Studien bieten eine solide Grundlage für Cannabis-Synergien und unterstützen die Entwicklung von pflanzlichen Arzneimitteln im Vergleich zur Entwicklung von Einzelkomponenten (Bonn-Miller et al., 2018) oder der Herstellung durch Fermentationsmethoden in Hefe oder anderen Mikroorganismen. Ein Beispiel für die Leistungsfähigkeit der konventionellen selektiven Züchtung wird in Form einer Cannabis-Chemovarie mit dem Namen CaryodiolTM veranschaulicht (Abbildung 2), die einen erhöhten Caryophyllen-Gehalt (0,83 %) als CB2-Agonist sowie ein äußerst günstiges Typ-III-THC:CBD-Verhältnis von 1:39,4 aufweist. Ein solches Präparat könnte zur Behandlung zahlreicher klinischer Erkrankungen eingesetzt werden, darunter Schmerzen, Entzündungen, fibrotische Erkrankungen, Sucht, Angstzustände, Depressionen, Autoimmunerkrankungen, dermatologische Erkrankungen und Krebs (Pacher und Mechoulam, 2011; Russo, 2011; Xi et al., 2011; Russo und Marcu, 2017; Lewis et al., 2018). Die Herstellung einer solchen Kombination aus mikrobiellen Quellen könnte die Kombination von Cannabinoiden aus mehreren Hefearten erfordern und würde daher ein Kombinationsprodukt darstellen, das im Vergleich zu Cannabiszubereitungen aus Extrakten einer einzigen Art (z. B. Nabiximols), die in 30 Ländern weltweit als einheitliche Formulierung akzeptiert wurden (Food and Drug Administration, 2015), einem schwierigen regulatorischen Weg unterliegt.
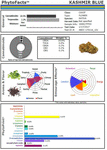
Abbildung 2. PhytoFactsTM-Darstellung des Cannabinoid- und Terpenoid-Gehalts von CaryodiolTM, auch bekannt als „Kashmir Blue“, einer Typ-III-, Cannabidiol- und Caryophyllen-prädominanten Chemovar. Siehe (Lewis et al., 2018) für Details zu PhytoFacts und konventioneller Züchtungsmethodik. Copyright© 2016 BHC Group, LLC. All rights reserved. Jegliche unbefugte Verwendung dieses Dokuments oder der oben genannten Bilder oder Marken kann gegen das Urheberrecht, das Markenrecht und andere geltende Gesetze verstoßen.
Dieser Artikel hat kurz die jüngsten technologischen Versuche skizziert, „das Phytocannabinoid-Rad neu zu erfinden.“ Stichhaltige Argumente sprechen dafür, dass dies möglich ist, aber sollte man es auch tun? Die Daten, die das Vorhandensein von Cannabis-Synergien und die erstaunliche Plastizität des Cannabis-Genoms belegen, legen eine Realität nahe, die die Notwendigkeit alternativer Wirte oder sogar gentechnischer Veränderungen von Cannabis sativa überflüssig macht und damit beweist, dass „die Pflanze es besser kann.“
Beiträge des Autors
Der Autor bestätigt, dass er der einzige Autor dieser Arbeit ist und sie zur Veröffentlichung freigegeben hat.
Erklärung zu Interessenkonflikten
Ich bin Forschungsdirektor des International Cannabis and Cannabinoids Institute. Wir betreuen Kunden, die im Cannabishandel tätig sind.
Danksagungen
Der Autor dankt den Mitarbeitern der Fernleihstelle der University of Montana in der Mansfield Library für die Bereitstellung von Forschungsmaterialien.
Anderson, L. C. (1980). Blattvariation zwischen Cannabisarten aus einem kontrollierten Garten. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum: der schlafende Riese der mediterranen Kräutermedizin. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., and Bailey, E. Z. (1976). Hortus Third: A Concise Dictionary of Plants Cultivated in the United States and Canada. New York, NY: Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). Ein Entourage-Effekt: Inaktive endogene Fettsäureglycerinester verstärken die Cannabinoid-Aktivität von 2-Arachidonoyl-Glycerol. Eur. J. Pharmacol. 353, 23-31. doi: 10.1016/S0014-2999(98)00392-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). A new ESI-LC/MS approach for comprehensive metabolic profiling of phytocannabinoids in Cannabis. Sci. Rep. 8:14280. doi: 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). Bewertung des „Entourage-Effekts“: Antitumorwirkung eines reinen Cannabinoids gegenüber einer pflanzlichen Arzneimittelzubereitung in präklinischen Modellen von Brustkrebs. Biochem. Pharmacol. 157, 285-293. doi: 10.1016/j.bcp.2018.06.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohlmann, F., and Hoffmann, E. (1979). Cannabigerol-ahnliche Verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi: 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S., and Vandrey, R. (2018). Cannabis- und Cannabinoid-Arzneimittelentwicklung: Bewertung botanischer und Einzelmolekül-Ansätze. Int. Rev. Psychiatry 30, 277-284. doi: 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E., and Bohlmann, J. (2017). Terpene synthases from Cannabis sativa. PLoS One 12:e0173911. doi: 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). Internationaler Code der Nomenklatur für Kulturpflanzen. Leuven: International Society for Horticultural Science.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S., and Stehle, F. (2017). Design von Mikroorganismen für die heterologe Biosynthese von Cannabinoiden. FEMS Yeast Res. 17:fox037. doi: 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., and Merlin, M. D. (2013). Cannabis: Evolution and Ethnobotany. Berkeley, CA: University of California Press.
Google Scholar
Clarke, R. C., and Merlin, M. D. (2016). Cannabis-Domestikation, Züchtungsgeschichte, heutige genetische Vielfalt und Zukunftsaussichten. Crit. Rev. Plant Sci. 35, 293-327. doi: 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Chronische Verabreichung von Cannabidiol an gesunde Freiwillige und Epilepsiepatienten. Pharmacology 21, 175-185. doi: 10.1159/000137430
PubMed Abstract | CrossRef Full Text | Google Scholar
Datwyler, S. L., and Weiblen, G. D. (2006). Genetische Variation bei Hanf und Marihuana (Cannabis sativa L.) anhand von amplifizierten Fragmentlängenpolymorphismen. J. Forensic Sci. 51, 371-375. doi: 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). „The breeding of cannabis cultivars for pharmaceutical end uses,“ in Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, and P. Robson (London: Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P., Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M., and Hammond, K. M. (2005). Die Vererbung des chemischen Phänotyps bei Cannabis sativa L. (II): Cannabigerol dominierende Pflanzen. Euphytica 145, 189-198. doi: 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M., Hammond, K. M., und Micheler, M. (2009a). Die Vererbung des chemischen Phänotyps bei Cannabis sativa L. (III): Variation im Cannabichromenanteil. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Sutton, A. (2009b). Die Vererbung des chemischen Phänotyps bei Cannabis sativa L. (IV): cannabinoidfreie Pflanzen. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). Studie mit Cannabidiol bei medikamentenresistenten Anfällen beim Dravet-Syndrom. N. Engl. J. Med. 376, 2011-2020. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Cannabidiol bei Patienten mit behandlungsresistenter Epilepsie: eine offene Interventionsstudie. Lancet Neurol. 15, 270-278. doi: 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Thiele, E. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). Randomisierte, dosisabhängige Sicherheitsstudie von Cannabidiol beim Dravet-Syndrom. Neurology 90, e1204-e1211. doi: 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J., and Fumagalli, L. (2017). Broad-scale genetic diversity of Cannabis for forensic applications. PLoS One 12:e0170522. doi: 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R., and Raber, J. C. (2015). Cannabinoide und Terpene als chemotaxonomische Marker in Cannabis. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Nutzbarmachung subzellulärer Hefekompartimente für die Produktion von pflanzlichen Terpenoiden. Metab. Eng. 13, 474-481. doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Food and Drug Administration (2015). Botanical Drug Development Guidance for Industry, ed. U.S.D.o.H.a.H. Services (Washington, DC: Food and Drug Administration). doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). The Great Herbal of Leonhart Fuchs: De Historia Stirpium Commentarii Insignes, 1542 (Notable Commentaries on the History of Plants). Stanford, CA: Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., and Hanus, L. (2014). Überwindung der glockenförmigen Dosis-Wirkung von Cannabidiol durch Verwendung eines mit Cannabidiol angereicherten Cannabisextrakts. Pharmacol. Pharm. 6, 75-85. doi: 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., and Mechoulam, R. (1964). Isolierung, Struktur und Teilsynthese eines aktiven Bestandteils von Haschisch. J. Am. Chem. Soc. 86, 1646-1647. doi: 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Cannabis in der Behandlung der pädiatrischen Epilepsie. Chicago, IL: O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). Eine kombinierte Analyse von agronomischen Merkmalen und Allozym-Allelhäufigkeiten für 69 Cannabis-Akzessionen. J. Ind. Hemp 10, 17-30. doi: 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Genetische Beweise für die Artbildung bei Cannabis (Cannabaceae). Genet. Resour. Crop Evol. 52, 161-180. doi: 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., und Mahlberg, P. G. (2004). Eine chemotaxonomische Analyse der Cannabinoidvariation bei Cannabis (Cannabaceae). Am. J. Bot. 91, 966-975. doi: 10.3732/ajb.91.6.966
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R., and Fallon, M. T. (2010). Multizentrische, doppelblinde, randomisierte, placebokontrollierte, parallele Gruppenstudie zur Wirksamkeit, Sicherheit und Verträglichkeit von THC:CBD-Extrakt und THC-Extrakt bei Patienten mit hartnäckigen krebsbedingten Schmerzen. J. Pain Symptom Manage. 39, 167-179. doi: 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris: Chez Panckoucke.
Lewis, M. A., Russo, E. B., and Smith, K. M. (2018). Pharmakologische Grundlagen von Cannabis-Chemovars. Planta Med. 84, 225-233. doi: 10.1055/s-0043-122240
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnaeus, C. (1753). Species Plantarum. Holmiae: Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., and Hegman, W. (2018). Cannabis ist in Europa heimisch und der Anbau begann während der Kupfer- oder Bronzezeit: eine probabilistische Synthese fossiler Pollenstudien. Veg. His. Archaeobot. 27, 635-648. doi: 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). Cannabis-Systematik auf den Ebenen der Familie, Gattung und Art. Cannabis Cannabinoid Res. 3, 203-212. doi: 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., and Watson, D. P. (2000). Hemp Diseases and Pests: Management und biologische Kontrolle. Wallingford: CABI. doi: 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., and Guy, G. W. (2017). Modelle der Cannabis-Taxonomie, kulturelle Voreingenommenheit und Konflikte zwischen wissenschaftlichen und umgangssprachlichen Namen. Bot. Rev. 83, 327-381. doi: 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., and Mediavilla, V. (2001). „Non-cannabinoids in cannabis,“ in Cannabis and Cannabinoids, eds F. Grotenhermen and E. B. Russo (Binghamton, NY: Haworth Press), 401-409.
Google Scholar
McPartland, J. M., and Pruitt, P. L. (1999). Nebenwirkungen von Arzneimitteln, die durch vergleichbare pflanzliche Arzneimittel nicht hervorgerufen werden: der Fall von Tetrahydrocannabinol und Marihuana. Altern. Ther. Health Med. 5, 57-62.
Google Scholar
McPartland, J. M., and Russo, E. B. (2001). Cannabis und Cannabisextrakte: mehr als die Summe ihrer Teile? J. Cannabis Ther. 1, 103-132. doi: 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., and Russo, E. B. (2014). „Non-phytocannabinoid constituents of cannabis and herbal synergy“, in Handbook of Cannabis, ed. R. G. Pertwee (Oxford: Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., and Ben-Shabat, S. (1999). Von gan-zi-gun-nu zu Anandamid und 2-Arachidonoylglycerol: die fortlaufende Geschichte von Cannabis. Nat. Prod. Rep. 16, 131-143. doi: 10.1039/a703973e
PubMed Abstract | CrossRef Full Text | Google Scholar
Oswald, M., Fischer, M., Dirninger, N., and Karst, F. (2007). Monoterpenoid-Biosynthese in Saccharomyces cerevisiae. FEMS Yeast Res. 7, 413-421. doi: 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P., and Mechoulam, R. (2011). Ist die Lipidsignalisierung durch Cannabinoid-2-Rezeptoren Teil eines Schutzsystems? Prog. Lipid Res. 50, 193-211. doi: 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., and Coan, A. C. (2018). Potenzielle klinische Vorteile von CBD-reichen Cannabisextrakten gegenüber gereinigtem CBD bei behandlungsresistenter Epilepsie: Beobachtungsdaten-Metaanalyse. Front. Neurol. 9:759. doi: 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., and Russo, E. B. (2016). Die Debatte zwischen Cannabis sativa und Cannabis indica: ein Interview mit Ethan Russo, MD. Cannabis Cannabinoid Res. 1, 44-46. doi: 10.1089/can.2015.29003.ebr
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2007). Die Geschichte des Cannabis und seiner Zubereitungen in Sage, Wissenschaft und Bezeichnung. Chem. Biodivers. 4, 1614-1648. doi: 10.1002/cbdv.200790144
PubMed Abstract |Ref Full Text | Google Scholar
Russo, E. B. (2011). Zähmung von THC: Potenzielle Cannabis-Synergie und Phytocannabinoid-Terpenoid-Effekte. Br. J. Pharmacol. 163, 1344-1364. doi: 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract |Ref Full Text | Google Scholar
Russo, E. B. (2016). Jenseits von Cannabis: Pflanzen und das Endocannabinoidsystem. Trends Pharmacol. Sci. 37, 594-605. doi: 10.1016/j.tips.2016.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2017). Cannabis und Epilepsie: eine uralte Behandlung kehrt in den Vordergrund zurück. Epilepsy Behav. 70(Pt B), 292-297. doi: 10.1016/j.yebeh.2016.09.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., Jiang, H. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Phytochemische und genetische Analysen von altem Cannabis aus Zentralasien. J. Exp. Bot. 59, 4171-4182. doi: 10.1093/jxb/ern260
PubMed Abstract |Ref Full Text | Google Scholar
Russo, E. B., and Marcu, J. (2017). Cannabis-Pharmakologie: die üblichen Verdächtigen und einige vielversprechende Hinweise. Adv. Pharmacol. 80, 67-134. doi: 10.1016/bs.apha.2017.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., and McPartland, J. M. (2003). Cannabis ist mehr als nur Delta(9)-tetrahydrocannabinol. Psychopharmacology 165, 431-432. doi: 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). Die genetische Struktur von Marihuana und Hanf. PLoS One 10:e0133292. doi: 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., and Lockwood, T. (1974). Cannabis: ein Beispiel für taxonomische Vernachlässigung. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). Kristallisation der Delta1-Tetrahydrocannabinolsäure (THCA)-Synthase aus Cannabis sativa. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 61(Pt 8), 799-801. doi: 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., et al. (2004). Das Gen, das die Psychoaktivität von Marihuana steuert: molekulares Klonen und heterologe Expression der Delta1-Tetrahydrocannabinolsäure-Synthase aus Cannabis sativa L. J. Biol. Chem. 279, 39767-39774. doi: 10.1074/jbc.M403693200
PubMed Abstract | CrossRef Full Text | Google Scholar
Small, E. (2015). Evolution und Klassifizierung von Cannabis sativa (Marihuana, Hanf) in Bezug auf die menschliche Nutzung. Bot. Rev. 81, 189-294. doi: 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis: A Complete Guide. Boca Raton, FL: CRC Press.
Google Scholar
Small, E., and Cronquist, A. (1976). A practical and natural taxonomy for Cannabis. Taxon 25, 405-435. doi: 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., and Marcus, D. (2003). Tetrahydrocannabinol-Gehalte in Hanf (Cannabis sativa) Keimplasma-Ressourcen. Econ. Bot. 57, 545-558. doi: 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., and Hong, D.-Y. (2001). Furnter evidence for the paraphyly of the Celtidaceae from the chloroplast gene mat K. Plant Syst. Evol. 228, 107-115. doi: 10.1007/s006060170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., and Goldstein, B. (2017). Der aktuelle Status von handwerklich hergestelltem Cannabis für die Behandlung von Epilepsie in den Vereinigten Staaten. Epilepsy Behav. 70(Pt B), 328-333. doi: 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y., and Morimoto, S. (2007). Produktion von Delta(1)-Tetrahydrocannabinolsäure durch das biosynthetische Enzym, das von transgenem Pichia pastoris sezerniert wird. Biochem. Biophys. Res. Commun. 361, 675-680. doi: 10.1016/j.bbrc.2007.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S., and Shoyama, Y. (1996). Purification and characterization of cannabidiolic-acid synthase from Cannabis sativa L. Biochemical analysis of a novel enzyme that catalyzes the oxidocyclization of cannabigerolic acid to cannabidiolic acid. J. Biol. Chem. 271, 17411-17416. doi: 10.1074/jbc.271.29.17411
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Cannabidiol in patients with seizures associated with Lennox-Gastaut syndrome (GWPCARE4): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 391, 1085-1096. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). The Wordsmith Dictionary of Botany. Ware: Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). Der Entwurf des Genoms und Transkriptoms von Cannabis sativa. Genome Biol. 12:R102. doi: 10.1186/gb-2011-12-10-r102
PubMed Abstract | CrossRef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J., and Guries, R. P. (1998). Die Ulmaceae, eine Familie oder zwei? Evidence from chloroplast DNA restriction site mapping. Plant Syst. Evol. 210, 249-270. doi: 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Medizinisches Cannabis: Ist Delta9-Tetrahydrocannabinol für alle seine Wirkungen notwendig? J. Pharm. Pharmacol. 55, 1687-1694. doi: 10.1211/0022357022304
PubMed Abstract | CrossRef Full Text | Google Scholar
Wirtshafter, D. (1997). „Nutritional value of hemp seed and hemp seed oil“, in Cannabis in Medical Practice, ed. M. L. Mathre (Jefferson, NC: McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Cannabinoid-CB(2)-Rezeptoren im Gehirn modulieren die Wirkung von Kokain bei Mäusen. Nat. Neurosci. 14, 1160-1166. doi: 10.1038/nn.2874
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z., and Yi, T.-S. (2013). Molekulare Phylogenetik und Charakterentwicklung der Cannabaceae. Taxon 62, 473-485. doi: 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., and Stehle, F. (2017). Engineering yeasts as platform organisms for cannabinoid biosynthesis. J. Biotechnol. 259, 204-212. doi: 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). Optimierung der Delta(9)-Tetrahydrocannabinolsäure-Synthase-Produktion in Komagataella phaffii durch posttranslationale Engpassidentifikation. J. Biotechnol. 272-273, 40-47. doi: 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text