- Einführung
- Epidemiologie
- Der Organismus und die Pathophysiologie der C. difficile-Diarrhö
- Klinische Manifestationen
- Diagnose
- Praktische Leitlinien für die Diagnose von C. difficile Durchfallerkrankungen
- Endoskopische Diagnose von C. difficile Diarrhoe und Colitis
- Behandlung
- Behandlung von rezidivierenden C. difficile-Durchfällen
- Schwere C.-difficile-Kolitis
- Schlussfolgerung
Einführung
Clostridium difficile-assoziierte Diarrhöe (CDAD) ist immer häufiger als Ursache nosokomialer Erkrankungen erkannt worden. Die Häufigkeit und Inzidenz von CDAD ist sehr unterschiedlich und wird von mehreren Faktoren beeinflusst, darunter nosokomiale Ausbrüche, Muster der Verwendung von antimikrobiellen Mitteln und individuelle Empfindlichkeit. Es gibt keine Berichte über prospektive Studien von Krankenhäusern, in denen positives Toxin A oder A/B und die Folgen von CDAD und deren Komplikationen verfolgt wurden.
Die Centers for Disease Control and Prevention (CDC) haben säkulare Trends in der Inzidenz von CDAD analysiert und einen stetigen Anstieg von 1987 bis 2001 festgestellt (1). In diesem Bericht gaben 30 % von 440 Ärzten für Infektionskrankheiten, die an einer webbasierten Umfrage teilnahmen, an, dass sie höhere Raten von CDAD, schwerere CDAD und mehr rezidivierende CDAD als in der Vergangenheit sehen. Insgesamt besteht der Eindruck, dass der Anteil der Fälle mit schweren und tödlichen Komplikationen zugenommen hat und die Rückfallquote bei den betroffenen Patienten gestiegen ist.
Neben der Morbidität und Mortalität ist auch die wirtschaftliche Belastung durch C. difficile-Infektionen in Form von verzögerten Entlassungen und anderen Krankenhauskosten beträchtlich.
Epidemiologie
Die Häufigkeit und Inzidenz von CDAD variiert zwischen Krankenhäusern und innerhalb einer bestimmten Einrichtung im Laufe der Zeit. Das Erkrankungsrisiko steigt bei Patienten mit Antibiotikaexposition, gastrointestinalen Eingriffen, zunehmender Verweildauer in Gesundheitseinrichtungen, schweren Grunderkrankungen, immunschwächenden Bedingungen und fortgeschrittenem Alter.
C. difficile wird mit dem Stuhl ausgeschieden. Jede Oberfläche, jedes Gerät oder Material (z. B. Kommode, Badewanne und elektronisches Rektalthermometer), das mit Fäkalien kontaminiert wird, kann als Reservoir für C. difficile-Sporen dienen. Die Sporen werden hauptsächlich über die Hände des Gesundheitspersonals, das eine kontaminierte Oberfläche oder einen kontaminierten Gegenstand berührt hat, auf Patienten übertragen (2-6).
 Klicken Sie für große Version
Klicken Sie für große Version
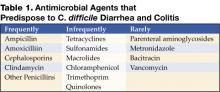
Abbildung 1 . Digitales Röntgenbild aus einer CT-Aufnahme zeigt eine knotige Hausteverdickung im Colon transversum.
Der Organismus und die Pathophysiologie der C. difficile-Diarrhö
C. difficile ist ein gram-positiver, anaerober, sporenbildender Bazillus, der für die Entwicklung von Antibiotika-assoziierter Diarrhöe und Colitis verantwortlich ist. C. difficile wurde erstmals 1935 als Bestandteil der fäkalen Flora gesunder Neugeborener beschrieben und wurde zunächst nicht als pathogen angesehen (7). Der Bazillus erhielt den Namen difficile, weil er langsam wächst und schwer zu kultivieren ist. C. difficile ist gegenwärtig für fast alle Ursachen der pseudomembranösen Kolitis und bis zu 20 % der Fälle von antibiotikaassoziierter Diarrhö ohne Kolitis verantwortlich. Obwohl er im Stuhl von nur 5 % der Allgemeinbevölkerung gefunden wird, sind bis zu 21 % der Erwachsenen während eines Krankenhausaufenthalts mit diesem Organismus kolonisiert (2,6).
Eine Veränderung der normalen Kolonmikroflora, die in der Regel durch eine Antibiotikatherapie verursacht wird, ist der Hauptfaktor, der für eine Infektion mit C. difficile prädisponiert. Fast alle Antibiotika wurden mit C. difficile-Diarrhö und -Kolitis in Verbindung gebracht. Zu den am häufigsten assoziierten Antibiotika gehören Clindamycin, Cephalosporine, Ampicillin und Amoxicillin (Tabelle 1) (8).
Neben der Antibiotikatherapie sind ein höheres Alter und die Schwere der Grunderkrankung wichtige Risikofaktoren für eine C. difficile-Infektion. Weitere Risikofaktoren sind das Vorhandensein einer nasogastralen Sonde, gastrointestinale Eingriffe, säurehemmende Medikamente, der Aufenthalt auf der Intensivstation und die Dauer des Krankenhausaufenthalts (9).
C. difficile-Diarrhöe wird in erster Linie durch die Bildung der Toxine A und B verursacht, die durch die bakterielle Vermehrung im Darmlumen entstehen. Diese Toxine binden an die Dickdarmschleimhaut und üben dort ihre schädliche Wirkung aus. Der Organismus schädigt den Dickdarm nur selten durch direkte Invasion, und die Diarrhöe wird durch die Wirkung der im Darmlumen produzierten Toxine verursacht, die an der Schleimhautoberfläche haften. Die meisten toxigenen Isolate produzieren beide Toxine, und etwa 5-25 % der Isolate produzieren weder Toxin A noch B und verursachen weder Kolitis noch Durchfall (3-5).
Klinische Manifestationen
Eine Infektion mit C. difficile kann ein breites Spektrum klinischer Manifestationen hervorrufen, einschließlich asymptomatischer Infektion, leichter bis mittelschwerer Diarrhö und fulminanter Erkrankung mit pseudomembranöser Kolitis (10). Bei Patienten, die eine CDAD entwickeln, beginnen die Symptome in der Regel kurz nach der Kolonisierung. Die Kolonisierung kann während einer Antibiotikabehandlung oder bis zu mehreren Wochen nach einer Antibiotikabehandlung erfolgen. CDAD geht in der Regel mit häufigem, lockerem Stuhlgang einher, der einer Proktokolitis entspricht. Schleim oder okkultes Blut kann vorhanden sein, sichtbares Blut ist jedoch selten.
Diagnose
Die Diagnose von CDAD basiert auf einer kürzlichen oder aktuellen Antibiotikatherapie, dem Auftreten von Durchfall oder anderen Anzeichen einer akuten Kolitis und dem Nachweis einer Infektion mit toxigenem C. difficile, gewöhnlich durch den Nachweis von Toxin A oder Toxin B in einer Stuhlprobe.
 Klick für große Version
Klick für große Version
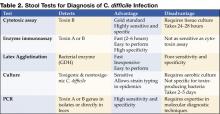
Abbildung 1 . Digitales Röntgenbild aus einem CT-Scan zeigt eine knotige Hausteverdickung im Colon transversum.
Praktische Leitlinien für die Diagnose von C. difficile Durchfallerkrankungen
- Die Diagnose sollte bei allen Personen mit Durchfall vermutet werden, die innerhalb der letzten 2 Monate Antibiotika erhalten haben und/oder deren Durchfall 72 Stunden oder mehr nach einem Krankenhausaufenthalt beginnt.
- Wenn die Diagnose vermutet wird, sollte eine einzige Stuhlprobe an das Labor geschickt werden, um auf das Vorhandensein von C. difficile und/oder seiner Toxine getestet zu werden.
- Wenn der Durchfall trotz eines negativen Stuhltoxin-Ergebnisses anhält, können eine oder zwei weitere Proben zur Untersuchung mit denselben oder anderen Tests eingesandt werden (4). Die Endoskopie ist besonderen Situationen vorbehalten, z. B. wenn eine schnelle Diagnose erforderlich ist und die Testergebnisse sich verzögern oder der Test nicht hochempfindlich ist, wenn der Patient einen Ileus hat und kein Stuhl zur Verfügung steht oder wenn auch andere Kolonerkrankungen in Betracht kommen.
Es gibt noch keinen einfachen, kostengünstigen, schnellen, empfindlichen und spezifischen Test zur Diagnose von C. difficile Diarrhoe und Colitis, noch sind alle verfügbaren Tests geeignet, von jedem Labor übernommen zu werden (Tabelle 2) (11).
Endoskopische Diagnose von C. difficile Diarrhoe und Colitis
Sigmoidoskopie und Koloskopie sind bei den meisten Patienten mit CDAD nicht indiziert (10,12). Die Endoskopie ist jedoch in besonderen Situationen hilfreich, etwa wenn die Diagnose zweifelhaft ist oder die klinische Situation eine schnelle Diagnose erfordert. Die Ergebnisse der endoskopischen Untersuchung können bei Patienten mit leichtem Durchfall normal sein oder in mittelschweren Fällen eine unspezifische Kolitis zeigen. Der Befund von Kolonpseudomembranen bei einem Patienten mit Antibiotika-assoziierter Diarrhö ist praktisch pathognomonisch für eine C. difficile-Kolitis. Einige wenige Patienten ohne diagnostische Merkmale im Rektosigmoid weisen Pseudomembranen in den proximaleren Bereichen des Kolons auf (13). Andere endoskopische Befunde sind Erythem, Ödem, Brüchigkeit und unspezifische Kolitis mit kleinen Ulzerationen oder Erosionen.
Behandlung
Der erste Schritt bei der Behandlung von C. difficile-Durchfall und Kolitis ist das Absetzen der auslösenden Antibiotika, wenn möglich (10,12). Bei etwa 15-25 % der Patienten verschwindet die Diarrhö ohne spezifische Anti-C.-difficile-Therapie (14,15). Bei Patienten, die systemisch krank sind oder mehrere medizinische Probleme haben, ist eine konservative Behandlung allein jedoch möglicherweise nicht angezeigt, da es schwierig ist vorherzusagen, bei welchen Patienten eine spontane Besserung eintritt. Wenn es aufgrund anderer aktiver Infektionen nicht möglich ist, das auslösende Antibiotikum abzusetzen, sollte das Antibiotikaregime des Patienten nach Möglichkeit so geändert werden, dass Wirkstoffe verwendet werden, die weniger wahrscheinlich CDAD verursachen (z. B., Aminoglykoside, Trimethoprim, Rifampin oder ein Chinolon).
Antiperistaltika wie Diphenoxylat plus Atropin (Lomotil) oder Loperamid (Imodium) und narkotische Analgetika sollten vermieden werden, da sie die Ausscheidung von Toxinen aus dem Dickdarm verzögern und dadurch toxininduzierte Dickdarmschäden verschlimmern oder einen Ileus und eine toxische Dilatation auslösen können (12,16). Eine spezifische Therapie zur Eradikation von C. difficile sollte bei Patienten mit anfänglich schweren Symptomen und bei Patienten, deren Symptome trotz Absetzen der Antibiotikabehandlung fortbestehen, durchgeführt werden. Obwohl die Diagnose einer C.-difficile-Kolitis idealerweise gestellt werden sollte, bevor eine antimikrobielle Therapie eingeleitet wird, empfehlen die aktuellen ACG-Leitlinien, dass eine empirische Therapie in hochgradig suggestiven Fällen von schwer erkrankten Patienten eingeleitet werden sollte (Tabelle 3 auf Seite 54) (12).
Zurzeit werden orales Vancomycin oder Metronidazol, das 7 bis 10 Tage lang angewendet wird, von den meisten Autoren und den aktuellen Leitlinien als Erstlinientherapie angesehen. Metronidazol in einer Dosis von 250 mg viermal täglich wird von den meisten Autoren und den ACG-Leitlinien als Mittel der Wahl für die Erstbehandlung der C. difficile-Kolitis empfohlen (12). Diese Empfehlungen beruhen im Wesentlichen auf der Wirksamkeit, den niedrigeren Kosten und den Bedenken hinsichtlich der Entwicklung von Vancomycin-resistenten Stämmen. Zu den größten Nachteilen von Metronidazol gehören ein weniger wünschenswertes Arzneimittelprofil und Kontraindikationen bei Kindern und Schwangeren.
Vancomycin hingegen ist in einer Dosis von 125 mg viermal täglich sicher und gut verträglich und erreicht Stuhlkonzentrationen, die das 20fache der für die Behandlung von C. difficile erforderlichen minimalen Hemmkonzentration betragen. Nachteile der Verwendung von Vancomycin sind die Kosten und die mögliche Entwicklung von Vancomycin-resistenten Stämmen. Die aktuellen ACG-Leitlinien betrachten Vancomycin als Mittel der Wahl bei schwer erkrankten Patienten und in Fällen, in denen der Einsatz von Metronidazol ausgeschlossen ist.
Kontrollierte klinische Studien für Patienten mit fulminanter Kolitis, die eine orale Therapie möglicherweise nicht vertragen, liegen nicht vor. Die intravenöse Verabreichung von Metronidazol oder die Verabreichung von Vancomycin über eine nasogastrale Sonde oder einen rektalen Einlauf wurde in kleinen Fallserien beschrieben (17-20). Die intravenöse Verabreichung von Vancomycin wird nicht empfohlen, da das Medikament im Dickdarm nicht ausgeschieden wird (17).
Behandlung von rezidivierenden C. difficile-Durchfällen
Trotz erfolgreicher Erstbehandlung von CDAD kommt es bei 15-20 % der Patienten zu einem Wiederauftreten der Diarrhöe in Verbindung mit einem positiven Stuhltest auf C. difficile-Toxin. Ein symptomatisches Wiederauftreten ist selten auf ein Versagen der Behandlung oder eine Resistenz gegen Metronidazol oder Vancomycin zurückzuführen. Zu den Behandlungsansätzen gehören die konservative Therapie (viele Patienten sind jedoch alt und gebrechlich und können den Durchfall nicht ertragen), die Therapie mit spezifischen Anti-C.-difficile-Antibiotika, die Verwendung von anionenbindenden Harzen, die Therapie mit Mikroorganismen (Probiotika) und die Immunglobulintherapie.
Die häufigste Therapie für rezidivierende C.-difficile-Diarrhöe ist eine zweite Behandlung mit demselben Antibiotikum, das zur Behandlung der ersten Episode verwendet wurde (12). In einer großen Beobachtungsstudie in den Vereinigten Staaten sprachen 92 % der Patienten mit rezidivierender CDAD erfolgreich auf eine einzige wiederholte Therapie an, meist mit Metronidazol oder Vancomycin (14). Es gibt Anhaltspunkte dafür, dass bei Patienten, bei denen in der Vergangenheit ein Rezidiv aufgetreten ist, nach Absetzen der Antibiotikatherapie ein hohes Risiko für weitere CDAD-Episoden besteht. Es gibt keine Daten, die darauf hindeuten, dass aufeinanderfolgende Episoden progressiv schwerer oder komplizierter werden (21). Für Patienten mit mehrfach wiederkehrenden C.-difficile-Durchfällen wurde eine Reihe von Behandlungsschemata vorgeschlagen. Ein Ansatz ist die Verabreichung einer verlängerten Vancomycin- (oder Metronidazol-) Kur mit abnehmender Dosierung, gefolgt von einer Impulstherapie (Tabelle 4).
Cholestyramin, ein Anionenaustauscherharz, das in einer Dosis von 4 Gramm drei- oder viermal täglich über einen Zeitraum von 1 bis 2 Wochen verabreicht wird, bindet C. difficile-Toxine und kann in Verbindung mit Antibiotika zur Behandlung wiederholter Schübe eingesetzt werden. Da Cholestyramin sowohl Vancomycin als auch Toxine binden kann, sollte es in einem Abstand von mindestens 2 bis 3 Stunden zum Vancomycin eingenommen werden.
Schwere C.-difficile-Kolitis
Die Inzidenz der fulminanten C.-difficile-Kolitis wurde mit 1,6-3,2 % angegeben (22). Obwohl keine genauen Zahlen aus anderen Zentren vorliegen, wird sie als eine zunehmende Ursache für Komplikationen und Todesfälle anerkannt. Das klinische Syndrom der fulminanten C.-difficile-Kolitis kann mit der richtigen Kenntnis des Spektrums der Krankheitspräsentation erkannt werden.
A. Diarrhöe: Obwohl Durchfall das Kennzeichen der C. difficile-Kolitis ist, ist er nicht immer vorhanden, und sein Fehlen kann zu diagnostischer Verwirrung führen. Wenn kein Durchfall vorhanden ist, scheint dies auf eine schwere Dysmotilität des Kolons zurückzuführen zu sein. Selbst wenn Durchfall vorhanden ist, kann er als unbedeutender Bestandteil eines unspezifischen septischen Bildes wahrgenommen werden.
 Nachgedruckt mit Genehmigung aus BUMC Proceedings 1999; 12:249-250
Nachgedruckt mit Genehmigung aus BUMC Proceedings 1999; 12:249-250
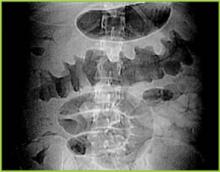
Abbildung 1 . Digitales Röntgenbild aus dem CT-Scan zeigt eine knotige Verdickung der Hauste im Querkolon.
 Abgedruckt mit Genehmigung aus BUMC Proceedings 1999; 12:249-250
Abgedruckt mit Genehmigung aus BUMC Proceedings 1999; 12:249-250
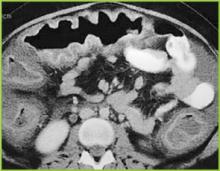
Abbildung 2 . Die CT-Aufnahme des Oberbauches bestätigt eine ausgeprägte haustrale Verdickung im Querkolon.
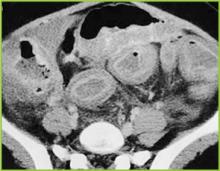 Abgedruckt mit Genehmigung von BUMC Proceedings 1999; 12:249-250
Abgedruckt mit Genehmigung von BUMC Proceedings 1999; 12:249-250
Abbildung 3 . Die CT-Aufnahme des Mittelbauches zeigt eine deutliche Verdickung des gesamten Dickdarms. Leichte entzündliche Veränderungen sind im perikolonischen Fett vorhanden.
B. Schwere Erkrankung: Die fulminante Kolitis ist eine ungewöhnliche Form der C.-difficile-Infektion, die nur bei 3 % der Patienten auftritt, aber für praktisch alle schwerwiegenden Komplikationen verantwortlich ist. Patienten mit schwereren Formen der Erkrankung können mit oder ohne Durchfall auftreten. Wenn die Patienten eine Kolitis entwickeln, die auf das Zökum und die rechte Seite des Dickdarms beschränkt ist, kann der Durchfall minimal sein oder ganz fehlen. Bleibt der Durchfall aus, können die einzigen Anhaltspunkte für die Diagnose systemische Toxizitätszeichen sein (Fieber, Tachykardie, Leukozytose und/oder Volumenmangel).
Eine erhöhte Anzahl weißer Blutkörperchen kann ein wichtiger Hinweis auf eine drohende fulminante C. difficile Kolitis sein. Der rasche Anstieg der Zahl der weißen Blutkörperchen in der Peripherie (häufig 30.000 bis 50.000) mit einem deutlichen Überschuss an Bändern und manchmal auch an unreifen Formen geht häufig einer hämodynamischen Instabilität und der Entwicklung von Organfunktionsstörungen voraus. Selbst bei Patienten, die über einen längeren Zeitraum hinweg nur geringe Symptome aufweisen, kann es zu einer plötzlichen und unerwarteten Schockentwicklung kommen. Es ist schwierig vorherzusagen, welche Patienten auf eine medizinische Behandlung nicht ansprechen. Daher können Frühwarnzeichen wie eine leukämische Reaktion von unschätzbarem Wert sein.
Hypotension ist ein Spätbefund und kann resistent gegenüber vasopressorischer Unterstützung sein. Die abdominalen Anzeichen reichen von einer Dehnung bis hin zu einer generalisierten Empfindlichkeit mit Abwehrhaltung. Eine Kolonperforation geht in der Regel mit abdominaler Rigidität, unwillkürlicher Abwehrspannung, Rebound-Zärtlichkeit und fehlenden Darmgeräuschen einher. Auf abdominalen Röntgenbildern kann freie Luft sichtbar werden. Bei Verdacht auf eine Perforation sollte sofort ein Chirurg hinzugezogen werden. Der Tod tritt im Allgemeinen ein, bevor freie Luft und Perforation auftreten können. In einer Studie wurde im Gegensatz zu den meisten anderen Studien festgestellt, dass Perforationen selten sind (22).
Abdominales Röntgen kann ein erweitertes Kolon (>7 cm im größten Durchmesser) zeigen, das mit einem toxischen Megakolon übereinstimmt. Bei Patienten mit Megakolon kann ein Dünndarmileus mit dilatiertem Dünndarm auf Röntgenbildern zu sehen sein, wobei die Luft-Flüssigkeits-Konzentration eine Dünndarmobstruktion oder Ischämie vortäuscht. Ein CT ohne Kontrastmittel und eine Endoskopie können eine fulminante C.-difficile-Kolitis schnell diagnostizieren oder zumindest stark vermuten lassen. Zu den CT-Befunden gehören Anzeichen von Aszites, Verdickung und/oder Dilatation der Kolonwand. Diese Befunde können bei der Einstufung des Schweregrads der Kolitis hilfreich sein.
Ein aggressiveres Vorgehen bei Patienten, die nicht auf Medikamente ansprechen, einschließlich der raschen Identifizierung von Patienten, die nicht auf die medikamentöse Therapie ansprechen, ist für ein positives Ergebnis entscheidend, und bei dieser Gruppe sollte ein frühzeitiger chirurgischer Eingriff vorgenommen werden (Abbildungen 1-3).
Es ist wichtig, dass alle an der Patientenversorgung in Krankenhäusern, Pflegeheimen und qualifizierten Pflegeeinrichtungen Beteiligten über den Organismus und seine Epidemiologie, rationale Ansätze für die Behandlung und Pflege von Patienten mit C. difficile-Durchfall, die Bedeutung des Händewaschens zwischen den Kontakten mit Patienten, die Verwendung von Handschuhen bei der Pflege von Patienten mit C. difficile-Durchfall und die Vermeidung des unnötigen Einsatzes von antimikrobiellen Mitteln.
Schlussfolgerung
In den letzten Jahren wurde die Besorgnis über die steigende Inzidenz und die schwerwiegenden Komplikationsraten von CDAD in nordamerikanischen Krankenhäusern laut (22,23). Die Zeitschrift Canadian Medical Association veröffentlichte 2004 einen Bericht über einen Ausbruch von CDAD in mehreren Krankenhäusern in Montreal. Die Einführung neuer hypervirulenter und hochgradig übertragbarer Stämme von C. difficile wurde als mögliche Ursache für den Ausbruch postuliert (24). Eine sich verschlechternde Infrastruktur, unzureichende Infektionskontrollpraktiken, die zunehmende Zahl geschwächter Patienten, eine alternde Bevölkerung und hypervirulente Stämme wurden als wahrscheinliche Ursachen für die jüngsten Ausbrüche in Kanada angesehen (25).
Zwei epidemiologische Untersuchungen in den Vereinigten Staaten und Kanada (24,26) untersuchten unabhängig voneinander Proben von C. difficile und stellten fest, dass eine mutierte Version des „wilden“ Stammes für die Ausbrüche in Quebec und die erhöhten Raten von CDAD in Krankenhäusern in den Vereinigten Staaten in letzter Zeit verantwortlich war (22,23). Klinische Epidemiologen der CDC untersuchten C. difficile-Isolate aus Krankenhäusern in den Vereinigten Staaten, in denen in jüngster Zeit (d. h. 2001-2004) CDAD-Ausbrüche aufgetreten waren (22,23). Der Bericht deutet auf das Auftreten eines neuen epidemischen Stammes, „BI“ (im Unterschied zum „J“-Stamm von 1989-1992), hin, der für den jüngsten Anstieg der Raten und den offensichtlichen Schweregrad von CDAD verantwortlich sein könnte (26).
CDAD und Kolitis können in den meisten Fällen durch die Verabreichung von Metronidazol oder Vancomycin behandelt werden. Bei einigen Patienten entwickelt sich trotz angemessener und rechtzeitiger medizinischer Behandlung eine schwere, lebensbedrohliche Toxizität, so dass ein chirurgischer Eingriff erforderlich ist. Systemische Symptome einer Infektion mit C. difficile sind Berichten zufolge nicht auf eine Bakteriämie, Kolonperforation oder Ischämie zurückzuführen, sondern auf toxininduzierte Entzündungsmediatoren, die aus dem Kolon freigesetzt werden (27-29). In refraktären Fällen einer schweren Erkrankung sollte ein frühzeitiger chirurgischer Eingriff vorgenommen werden. Die chirurgische Intervention ist jedoch alles andere als ideal und birgt eine sehr hohe Komplikationsrate und ein erhebliches Sterberisiko (22). Der künftige klinische Ansatz für die Behandlung der nosokomialen C.-difficile-Kolitis wird möglicherweise spezifische Antitoxin-Hyperimmunglobuline und Inhibitoren der Entzündungskaskade umfassen (28, 30, 31).
- Archibald LK, Banerjee SN, Jarvis WR. Säkularer Trend bei im Krankenhaus erworbenen Clostridium difficile-Erkrankungen in den Vereinigten Staaten; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotika-assoziierte Kolitis. In: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Pathogenese, Epidemiologie und Behandlung. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Die Geschichte seiner Rolle als Darmpathogen und der aktuelle Wissensstand über den Organismus. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosokomialer Erwerb von Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: With a description of a new pathogenic anaerobe, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Behandlung von Clostridium-difficile-Diarrhöe und Kolitis. In: Wolfe MM, ed. Gastrointestinal Pharmacotherapy. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Risikofaktoren für eine Clostridium difficile-Infektion. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Gastrointestinal Infections: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rektale Schonung bei Antibiotika-assoziierter pseudomembranöser Kolitis: A prospective study. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Zehn Jahre prospektive Überwachung und Behandlung von Clostridium difficile-assoziierten Krankheiten im Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Zusätzliches intrakolonisches Vancomycin bei schwerer Clostridium-difficile-Kolitis: Fallserie und Überblick über die Literatur. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intravenöses Metronidazol zur Behandlung von Clostridium difficile colitis. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Wiederkehrende Clostridium-difficile-Diarrhöe: Merkmale und Risikofaktoren bei Patienten, die an einer prospektiven, randomisierten Doppelblindstudie teilnahmen. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile colitis: eine zunehmend aggressive iatrogene Erkrankung? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4: Mögliche Rolle von Virulenzfaktoren und antimikrobiellen Resistenzmerkmalen. 42. Jahrestagung der Infectious Diseases Society of America. Boston, MA, September 30 – Oktober 3, 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Increased substance P responses in dorsal root ganglia, intestinal macrophages during Clostridium difficile toxin A enteritis in rats. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimuliert die Produktion von Makrophagen-entzündlichem Protein-2 in Darmepithelzellen der Ratte. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survival of anti-Clostridium difficile bovine immunoglobulin concentrate in the human gastrointestinal tract. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenöse Immunglobulintherapie für schwere Clostridium difficile Colitis. Gut. 1997;41:366-70.