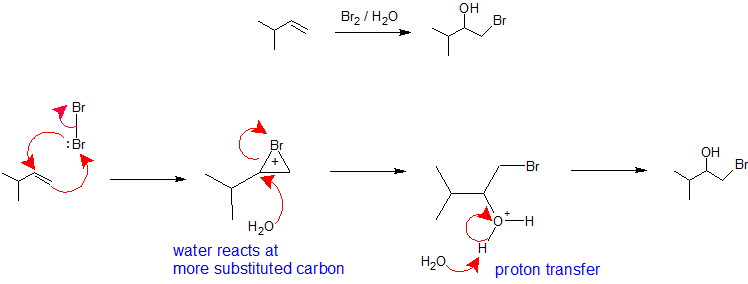
Mechanismen erklären die Regioselektivität
X2/H2O oder X2/ROH: Die Regioselektivität der Bildung von Halohydrinen aus einer Reaktion eines Alkens mit einem Halogen in einem nukleophilen Lösungsmittel ist analog zum Oxymercuration-Demercuration-Weg. Das Halogenmolekül übernimmt die Rolle des Elektrophils, indem es nukleophile pi-Elektronen aus dem Alken aufnimmt und gleichzeitig eine Bindung mit dem anderen Vinylkohlenstoff bildet, um ein Bromonium- (oder Chloroium-) Ion zu erzeugen. Die Bildung des Bromonium- (oder Chloronium-) Ions stabilisiert die positive Ladung und verhindert eine Carbokation-Umlagerung. Das Lösungsmittel übernimmt die Rolle des Nukleophils, da es zu einem viel größeren Prozentsatz vorhanden ist als die Abgangsgruppe, und reagiert mit dem am stärksten substituierten Kohlenstoff des zyklischen Bromonium- (oder Chloronium-) Ions, um eine Regiochemie zu erzeugen. Die Stereochemie dieser Reaktion ist anti-additionell, da das Lösungsmittel sich dem Bromonium-Ion mit rückseitiger Orientierung nähert, um das Additionsprodukt zu erzeugen. Da die Wechselwirkung des Halogens mit dem Alken jedoch von oben oder von unten erfolgen kann, gibt es bei dieser Reaktion keine stereochemische Kontrolle, und es wird gegebenenfalls ein Enantiomerengemisch gebildet. Der letzte Schritt dieses Mechanismus ist eine Protonenübertragung auf ein Wassermolekül im Lösungsmittel, um das Additionsprodukt zu neutralisieren.
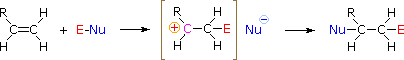
HOX oder RSCl: Die Regioselektivität der Reaktionen mit Halogenwasserstoffsäuren und Sulfenylchlorid kann durch denselben Mechanismus erklärt werden, den wir zur Erklärung der Markovnikov-Regel verwendet haben. Die Bindung einer elektrophilen Spezies an die Doppelbindung eines Alkens führt bevorzugt zur Bildung des stabileren (höher substituierten) Carbokations. Dieses Zwischenprodukt sollte sich dann schnell mit einer nukleophilen Spezies verbinden, um das Additionsprodukt zu erzeugen.
Um diesen Mechanismus anzuwenden, müssen wir den elektrophilen Anteil in jedem der Reagenzien bestimmen. Anhand der Elektronegativitätsunterschiede können wir gängige Additionsreagenzien in elektrophile und nukleophile Anteile zerlegen, wie rechts dargestellt. Im Fall von unterchlorigen und unterbromigen Säuren (HOX) reagieren diese schwachen Brønsted-Säuren (pKa ca. 8) nicht als Protonendonatoren; und da Sauerstoff elektronegativer ist als Chlor oder Brom, wird das Elektrophil ein Halogenidkation sein. Die nukleophile Spezies, die sich an das intermediäre Carbokation bindet, ist dann ein Hydroxidion oder, was wahrscheinlicher ist, Wasser (das übliche Lösungsmittel für diese Reagenzien), und die Produkte werden Halohydrine genannt. Sulfenylchloride addieren auf umgekehrte Weise, da das Elektrophil ein Schwefelkation, RS(+), ist, während die nukleophile Einheit ein Chloridanion ist (Chlor ist elektronegativer als Schwefel).
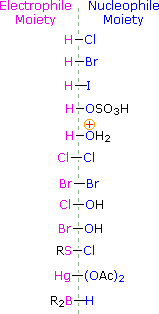
Nachstehend sind einige Beispiele aufgeführt, die die Addition verschiedener elektrophiler Halogenreagenzien an Alkengruppen veranschaulichen. Beachten Sie die spezifische Regiochemie der Produkte, wie oben erklärt.
Aufgabe
1. Sagen Sie das Produkt der folgenden Reaktion voraus:

2. Wenn Buten mit NBS in Gegenwart von Wasser behandelt wird, zeigt das Produkt, dass das Brom am am wenigsten substituierten Kohlenstoff sitzt, ist dies Markovnikov oder Anti-Markovnikov?
Antwort

2. Da das Brom die erste Addition an das Alken ist, wäre diese Addition eine Anti-Markovnikov-Addition.
Mitwirkende
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professor Emeritus (Michigan State U.), Virtuelles Lehrbuch der Organischen Chemie