Triacylglycerid/Phospholipid Stereochemie
Glycerin ist ein achirales Molekül, da C2 zwei identische Substituenten hat, -CH2OH. Glycerin kann im Körper chemisch in Triacylglyceride und Phospholipide (PL) umgewandelt werden, die chiral sind und in einer enantiomeren Form vorliegen. Wie kann dies möglich sein, wenn die beiden CH2OH-Gruppen des Glycerins identisch sind? Obwohl diese Gruppen stereochemisch gleichwertig sind, können wir sie wie folgt unterscheiden. Richten Sie Glycerin so aus, dass das OH von C2 nach links zeigt. Ersetzen Sie dann das OH von C1 durch OD, wobei D für Deuterium steht. Nun sind die beiden Alkoholsubstituenten an C1 und C3 nicht mehr identisch und das resultierende Molekül ist chiral. Dreht man das Molekül so, dass das H an C2 nach hinten zeigt, und ordnet den anderen Substituenten an C2 folgende Prioritäten zu: OH = 1, DOCH2 = 2 und CH2OH = 3, so zeigt sich, dass das resultierende Molekül in der S-Konfiguration vorliegt. Wir sagen also, dass C1 der proS-Kohlenstoff ist. Wenn wir das OH an C3 durch OD ersetzen, bilden wir das R-Enantiomer. C3 ist also das proR-Kohlenstoffatom. Dies zeigt, dass wir in der Realität zwischen den beiden identischen CH2OH-Substituenten unterscheiden können. Wir sagen, dass Glycerin nicht chiral, sondern prochiral ist. (Stellen Sie sich das so vor, dass Glycerin das Potenzial hat, chiral zu werden, indem einer der beiden identischen Substituenten verändert wird.)
Abbildung: Glycerin – Ein prochirales Molekül
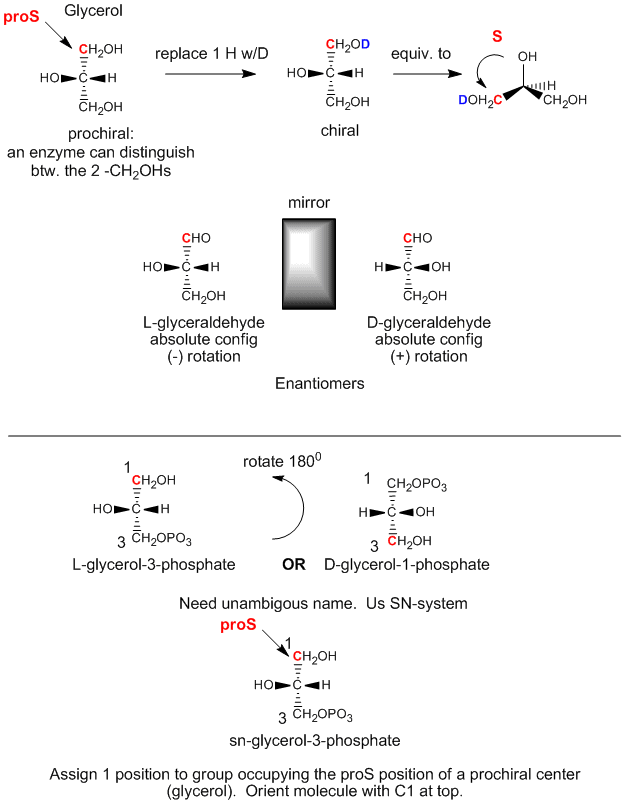
Wir können die obige Konfiguration von Glycerin (wenn OH auf C2 nach links zeigt) mit der absoluten Konfiguration von L-Glyceraldehyd, einem Einfachzucker (einem Polyhydroxyaldehyd oder Keton), einem weiteren 3C-Glycerinderivat, vergleichen. Dieses Molekül ist chiral, wobei das OH an C2 (dem einzigen chiralen Kohlenstoff) nach links zeigt. Es ist leicht zu merken, dass bei jedem L-Zucker das OH am letzten chiralen Kohlenstoff nach links zeigt. Das Enantiomer (spiegelbildliches Isomer) von L-Glyceraldehyd ist D-Glyceraldehyd, bei dem das OH an C2 nach rechts zeigt. Biochemiker verwenden L und D für die Stereochemie von Lipiden, Zuckern und Aminosäuren anstelle der in der organischen Chemie üblichen R,S-Nomenklatur. Die stereochemische Bezeichnung aller Zucker, Aminosäuren und Glycerolipide lässt sich aus der absoluten Konfiguration von L- und D-Glyceraldehyd bestimmen.
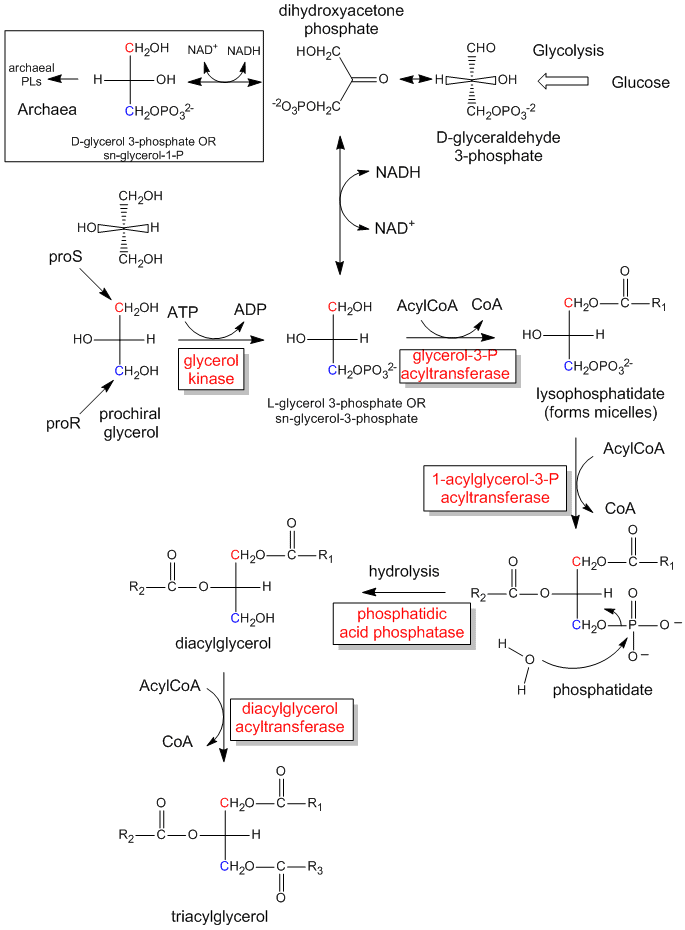
Der erste Schritt bei der In-vivo-Synthese (im Körper) von chiralen Derivaten aus dem achiralen Glycerin besteht in der Phosphorylierung des OH an C3 durch ATP (ein Phosphoanhydrid, das in seiner Struktur dem Essigsäureanhydrid ähnelt, einem ausgezeichneten Acetylierungsmittel), um das chirale Molekül Glycerinphosphat herzustellen. Ausgehend von der absoluten Konfiguration von L-Glycerinaldehyd und unter Verwendung dieser Konfiguration zum Zeichnen von Glycerin (wobei das OH an C2 nach links zeigt), können wir sehen, dass das phosphorylierte Molekül L-Glycerin-3-phosphat genannt werden kann. Dreht man dieses Molekül jedoch um 180 Grad, ohne die Stereochemie des Moleküls zu verändern, so ändert sich das Molekül überhaupt nicht, sondern man würde das gedrehte Molekül unter Verwendung der obigen D/L-Nomenklatur als D-Glycerin-1-phosphat bezeichnen. Wir können ein und demselben Molekül nicht zwei verschiedene Namen geben. Daher haben Biochemiker das stereospezifische Nummerierungssystem (sn) entwickelt, das die 1-Position eines prochiralen Moleküls der Gruppe zuordnet, die die proS-Position einnimmt. Anhand dieser Nomenklatur können wir sehen, dass das oben beschriebene chirale Molekül, Glycerinphosphat, eindeutig als sn-Glycerin-3-phosphat bezeichnet werden kann. Der Hydroxylsubstituent am proR-Kohlenstoff wurde phosphoryliert.
Abbildung: Die biologische Synthese von Triacylglyceriden und Phosphatidsäure aus prochiralem Glycerin
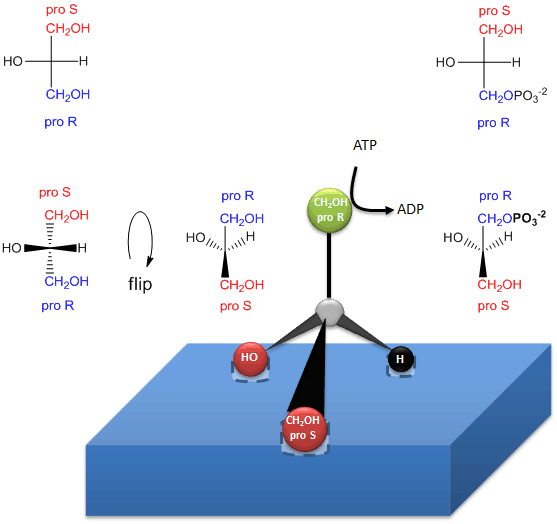
Die enzymatische Phosphorylierung von prochiralem Glycerin am OH des proR-Kohlenstoffs zur Bildung von sn-Glycerin-3-phosphat ist im unten stehenden Link dargestellt. So wie wir in der Lage waren, die beiden identischen CH2OH-Substituenten entweder dem proS- oder dem proR-Kohlenstoff zuzuordnen, kann dies auch das Enzym. Das Enzym kann identische Substituenten an einem prochiralen Molekül unterscheiden, wenn das prochirale Molekül an drei Punkten mit dem Enzym interagiert. Ein weiteres Beispiel für ein prochirales Reaktanden/Enzymsystem ist die Oxidation des prochiralen Moleküls Ethanol durch das Enzym Alkoholdehydrogenase, bei der nur das proR H der 2 H’s auf C2 entfernt wird. (Wir werden dies später diskutieren.)
Abbildung: Wie ein Enzym (Glycerinkinase) bei der Bildung von chiralen Triacylglycerinen und Phosphatidsäure ein PO4 von ATP auf das proR CH2OH von Glycerin überträgt.