Abstract
Arsen stimulerer proliferation ved lave koncentrationer og hæmmer cellevækst ved høje koncentrationer, hvilket viser en bifasisk virkning på den biologiske proces. Den bifasiske effekt kræver, at arsenkoncentrationen skal holdes på en passende tærskelværdi for at hæmme kræftceller under kemoterapi. Apoptosen kan være en primær mekanisme relateret til arsens dobbelte egenskaber.
Nøgleord
arsen, bifasisk effekt, endemisk arsenisme, carcinogenese, kemoterapi
Highlights
- Arsen er et carcinogen, der kan stimulere celleproliferation ved lave niveauer.
- Arsenik er også en kræftundertrykker, der hæmmer cellevækst ved høje koncentrationer.
- Arsens biologiske rolle viser en bifasisk effekt på cellevækst.
- Apoptose kan være en potentiel mekanisme relateret til arsens dobbelte egenskaber.
Kommentar
Arsenelementet (As) er vidt udbredt i naturen, som ofte kombineres med ilt eller svovl for at danne forbindelser. Arsen er også tæt forbundet med den biologiske proces. Dets patofysiologiske egenskaber er indarbejdet i følgende aspekter: (a) lav dosis arsen stimulerer celleproliferation og carcinogenese. Når natriumarsenit blev anvendt til behandling af humane HepG2 kræftceller eller ikke-tumor HHI-5 hepatocytter, fandt vi, at procentdelen af celledød var negativ i den indledende fase, hvilket betyder, at lavdosisarsenit fremmer cellevækst (figur 1). Arsenit kunne øge cellens levedygtighed ved et snævert interval af lave koncentrationer. Efterhånden som arsenitniveauet blev øget til et kritisk punkt, begyndte det at hæmme proliferationen og fremskynde celledøden. Det samme resultat er også blevet rapporteret af andre undersøgelser . I forskellige geologiske områder overstiger arsenkoncentrationen i drikkevand det standardindhold (0,01 mg/L), der anbefales af Verdenssundhedsorganisationen. Lokale beboere, der drikker det arsenberigede vand, lider af endemisk arsenisme . Forekomsten af kræft i forskellige organer (f.eks. hud, lunge, nyre, urinblære, lever osv.) i de endemiske områder er betydeligt højere end i de ikke endemiske områder. Arsen er blevet identificeret som kræftfremkaldende for mennesker af Det Internationale Kræftforskningscenter. b) Høje koncentrationer af arsen hæmmer cellevæksten. I klinisk praksis anvendes arsenforbindelser (f.eks. As2O3, As2S2 osv.) almindeligvis til at dræbe kræftceller under kemoterapi. Desuden har arsenid været førstevalgsmedicin til behandling af visse kræftformer som f.eks. leukæmi og solide viscerale neoplasmer . Nogle gange anvendes arsenforbindelser i kombination med andre lægemidler for at opnå den bedste terapeutiske virkning. Arsenidet fremkalder ikke kun tumorudvikling, men dræber også kræftceller som grundlæggende lægemiddel i klinisk behandling. Arsen har dobbelte egenskaber som kræftfremkaldende og kræftundertrykkende stof. Der foreslås således et nyt begreb “bifasisk effekt” for at beskrive dets tovejsrolle i cellevækst.
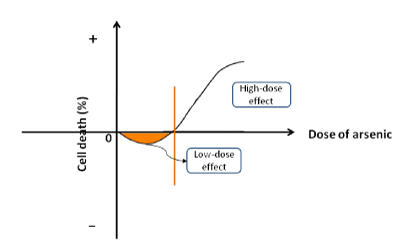
Figur 1. Skematisk diagram over den bifasiske effekt. Arsen stimulerer celleproliferation ved lave doser, mens det fremskynder celledød ved høje koncentrationer
Hvad er den præcise mekanisme, der giver anledning til arsenets dobbelte egenskaber? På nuværende tidspunkt er der ikke noget klart svar på dette spørgsmål. De foreliggende data understøtter imidlertid, at apoptose spiller en afgørende rolle. Apoptose er en genkontrolleret, energiforbrugende, selvmordsproces, der har til formål at opretholde vævsstrukturen. En balance mellem apoptotiske og anti-apoptotiske kompetencer bestemmer ikke kun cellens levedygtighed, men påvirker også direkte vævsfunktionen. Hidtil er apoptose blevet betragtet som den primære mekanisme til at forbinde carcinogenese og kræftbekæmpelse. Inhibitor of apoptoseproteiner (IAP’er) har en stærk funktion i reguleringen af celleoverlevelsen og kontrollen af apoptosekaskaden . Endvidere moduleres ekspressionen af IAP’er af flere nukleare faktorer, såsom NF-kappa B, FoxA2, C/EBP-beta osv. Forholdet mellem arsen og apoptose er værd at undersøge nøje. Vi har brug for flere beviser for at påvise, at a) lavdosis arsen hæmmer apoptose og stimulerer celleproliferation. Det er velkendt, at carcinogenese skal overvinde apoptosemodstanden, b) arsen i høje doser udløser apoptose og dræber kræftceller. Den centrale strategi for kræftbehandling er at fremkalde apoptose af kræftceller. En rimelig hypotese er, at arsen hæmmer apoptose ved lave koncentrationer, mens det fremmer apoptose ved høje koncentrationer. Der spekuleres også i, at IAP’er og deres reguleringsnetværk kan være ansvarlige for arsenids dobbelte egenskaber.
En udforskning af den bifasiske virkning af arsen (arsenid) har særlig betydning for den kliniske behandling af kræft. Når arsenforbindelse indgives sammen med andre lægemidler sammen, reduceres doseringen af arsenforbindelserne ofte. På grund af arsens dobbelte egenskaber bør vi vurdere arsenforbindelsens medicinske værdi, når vi tager lægemidler i kombination. På dette tidspunkt skal den lokale koncentration af arsenid holdes på et bestemt niveau for at inducere apoptose af kræftceller. Ellers kan arsenidet fremme kræftcellers spredning. Der er ingen terapeutisk virkning, endda et modsat resultat. Derfor er vi nødt til at overveje arsenidets tovejsreaktion, især i kombination med andre lægemidler. Hvad er den nøjagtige tærskel for, hvornår arsenid kan hæmme tumoren? Hvordan skal arsenidet administreres for at nå tærskelkoncentrationen og holde den konstant? Hvilke biomarkører er rimelige til overvågning af koncentrationen af arsenid i blodet? Indtil nu er der ikke fundet svar på ovenstående spørgsmål. Arsens biologiske egenskaber giver også anledning til et nyt emne inden for toksikologien. I den traditionelle definition af toksikologi anses det generelt for toksikologisk adfærd at dræbe celler eller at øge dødsraten. Men en forøgelse af kræftcellers spredning er også giftig for kroppen. Så opførsel af lavdosis arsenik er et andet aspekt af toksikologi. Måske kan det defineres som omvendt toksikologi eller omvendt toksikologi. I øjeblikket arbejder vi på molekylære markører, der kan vurdere koncentrationen af arsenid i blodet og evaluere dets terapeutiske virkning. Leukæmi og solide tumorer kan kræve forskellige koncentrationer af arseniklægemidler (4). Der er behov for kliniske forsøg med store prøver for at afprøve arsenidets sande rolle i behandlingen af forskellige kræftformer. Desuden er kvantificering af cellernes funktionelle tilstand det aktuelle fokus.
Sammenfattende har arsenik en bifasisk virkning på cellevækst, som manifesteres ved proliferation ved lave koncentrationer og hæmning ved høje koncentrationer. På grund af den bifasiske virkning skal der opretholdes en tærskelværdi for arsenkoncentrationen for at dræbe kræftceller under kræftbehandling. Ellers kan arsenidet stimulere kræftcellers spredning, hvorved der opnås en omvendt effekt. Foreløbige undersøgelser viser, at den anti-apoptotiske IAP-familie og dens reguleringsnetværk spiller en vigtig rolle i arsenets biologi. Apoptose kan være en væsentlig mekanisme relateret til arsenets dobbelte egenskaber.
Interesseerklæring
Forfatterne har intet at afsløre.
Akkreditering
Dette arbejde blev støttet af “The National Natural Science Foundation of China”, projektnummer 81773367. Vi takker professor Yang Jianbos forslag og råd i forbindelse med udarbejdelsen af manuskriptet.
- Yedjou C, Tchounwou P, Jenkins J, McMurray R (2010) Basic mechanisms of arsenic trioxide (ATO)-induced apoptosis in human leukemia (HL-60) cells. J Hematol Oncol 3: 28.
- Tseng CH, Chong CK, Tseng CP, Centeno JA (2007) Blackfoot disease in Taiwan: its link with inorganic arsenic exposure from drinking water. Ambio. 36: 82-84.
- Smith AH, Marshall G, Roh T, Ferreccio C, Liaw J, et al. (2018) Lunge-, blære- og nyrekræftdødelighed 40 år efter reduktion af arseneksponering. Journal of the National Cancer Institute 110: 241-249.
- Gill H, Yim R, Lee HKK, Lee HKK, Mak V, Lin SY, et al. (2018) Long-term outcome of relapsed acute promyelocytic leukemia treated with oral arsenic trioxide-based reinduction and maintenance regimens: En 15-årig prospektiv undersøgelse. Cancer 124: 2316-2326.
- Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, et al. (2007) IAP-antagonister inducerer autoubiquitination af c-IAPs, NF-kappaB-aktivering og TNFalpha-afhængig apoptose. Cell 131: 669-681.