- Indhold
- Funktion
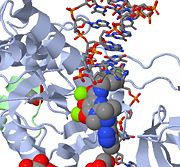
- Mekanisme for strandoverførselshæmning actio Caption Overst ses et JMOL-billede af MK-0518, der blokerer den 3′-ende af viral-DNA’et fra at binde det aktive sted. Bemærk de metalchelaterende oxygenatomer i MK-0518, der interagerer med de magnesiumkationer, der findes i det aktive sted.
- HIV og AIDS
- Strukturens betydning
- PFV intasomkrystallisering
- Krystalliseringsteknik
- Krystallografisk og raffineringsstatistik
- Samlet arkitektur Komponenter
- Struktur
- Integrase og DNA-interaktioner
- Aktivt sted
- Integrasehæmmere
Indhold
- 1 Funktion
- 2 Mekanisme for strand-transfer inhibition actio
- 3 HIV og AIDS
- 4 Indflydelse af struktur
- 5 PFV Intasomkrystallisering
- 5.1 Krystalliseringsteknik
- 5.2 Krystallografiske og raffineringsstatistikker
- 6 Overordnet arkitektur & Komponenter
- 6.1 Struktur
- 6.2 Integrase- og DNA-interaktioner
- 6.3 Aktivt sted
- 7 Integrase-inhibitorer
- 7.1 Yderligere ressourcer
- 8 3D-strukturer af retroviral integrase
Funktion
Retroviral integrase er et essentielt retroviralt enzym, der binder sig til viralt DNA og indsætter det i et værtscellekromosom. Det omvendt transskriberede cDNA af humant immundefektvirus type 1 (HIV-1) indsættes i værtscellens genom for at øge patogenets fitness og virulens. Integrase produceres af en klasse af retrovirus (som HIV) og bruges af virussen til at inkorporere sit genetiske materiale i værtscellens DNA. Værtscellens maskineri producerer derefter mRNA og derefter protein ud fra det inkorporerede genetiske materiale og replicerer dermed virussen. Selv om der er blevet undersøgt adskillige integrasehæmmende lægemidler, er den mekanisme, der er ansvarlig for virkningen af hæmningen af strengoverførslen, endnu ikke blevet belyst . Hare el al (2010) har imidlertid bestemt de strukturelle bestanddele af retroviral integration. Yderligere opklaring af den komplette struktur af retroviral integrase og dens anvendelse til regulering af funktionelle og enzymatiske aktiviteter kunne potentielt sætte forskere i stand til at forsinke udviklingen af retrovirale sygdomme. Desuden kan undersøgelsen af HIV-1-integration føre til et lovende nyt mål og bidrage til at skabe farmakoformodeller for antiviral terapi.
HIV Integrase-inhibitorer: Raltegravir, der markedsføres som Isentress, er i øjeblikket godkendt som en terapeutisk hiv-integrasehæmmer. Det blev godkendt den 12. oktober 2007. for fage-integrase se fage-integrase.
HIV integrase type 1 er et relativt nyt og nyt mål for inhibitorer. I 2007 blev den første hiv-1 integrasehæmmer, Raltegravir, godkendt af FDA til brug ved hiv-1 som en kombinationsterapi . Strandoverførselsinhibitorer virker ved at forhindre den samordnede integration af viral DNA i værtskromosomet. Efter viral indtrængen i værtscellen omdanner den omvendte transkriptase det virale ssRNA til dsDNA. På dette tidspunkt danner integrase et kompleks med det virale DNA og skaber præintegrationskomplekset (intasome). Præ-integrationskomplekset bliver derefter chaperoneret ind i kernen, hvor to nukleotider udskilles fra 3′-enden. Dernæst integreres DNA’et kovalent i værts-DNA’et. Strengoverførselsinhibitorer afbryder denne proces og forhindrer integrationen af virus-DNA’et i værtskromosomet. Strengoverførselsinhibitorer virker ved at engagere de metalioncofaktorer, der findes i det aktive sted for retroviral integrase. De metalchelaterende oxygenatomer, der findes i inhibitorerne, interagerer direkte med metalkofaktorerne, mens halobenzylgruppen passer ind i den lomme, der er skabt af det forskudte 3′-virale DNA i det aktive sted.
HIV og AIDS

I 2010 er der mere end 25 millioner mennesker er døde af aids, og det anslås, at ca. 33 millioner mennesker lever med hiv.
I dag er der mere end 25 millioner mennesker døde af aids, og det anslås, at ca. 33 millioner mennesker lever med hiv i dag. For retrovirale integrasehæmmere se Raltegravir og Retroviral Integrase Inhibitor Pharmacokinetics.
Strukturens betydning
Tredimensionelle strukturer for visse værtscelleproteiner, der er afgørende for forståelsen af mekanismen for HIV-infektion og virulens, er fremkommet ved hjælp af røntgenkrystallografiske analyser. HIV-protease- og integrase-strukturer er blandt de højest rangerede strukturer, som har bidraget til at redde mange liv og øget livskvaliteten for mange HIV-smittede personer. Den er implementeret i strukturbaseret lægemiddeldesign til udvikling af proteasehæmmere og integrasehæmmere og anvendes som en væsentlig komponent i højaktiv antiretroviral terapi (HAART).
Mens de eksisterende antiretrovirale midler forbedrer livskvaliteten samt forlænger livet for mange patienter, lykkes det ikke at udrydde sygdommen. Undersøgelser af integrasehæmmere viser, at kombinationen med andre antiretrovirale lægemidler mindsker de virale tilpasninger og kan have potentiale til at blive anvendt til salvage therapy for patienter, der har erhvervet resistens over for andre lægemidler. For yderligere oplysninger, se
- AIDS før proteasehæmmere & HIV-proteasehæmmere: Et gennembrud
- Behandlinger: Retroviral integrasehæmmer Farmakokinetik Referencer.
PFV intasomkrystallisering
For at efterligne de virale DNA-ender af HIV-1 anvendte Hare et al (2010) opløselige og fuldt funktionelle prototype foamy virus (PFV) intasompræparater, der blev fremstillet ved hjælp af rekombinant PFV integrase og dobbeltstrengede oligonukleotider.
Den bemærkelsesværdige stabilitet af integrase-DNA-komplekserne blev bestemt ved at observere in vitro strandoverførselsreaktionerne, som blev klassificeret i tre former for deproteineringsmigration: (1) enkelte samordnede hændelser: lineariseret målplasmid; (2) flere samordnede hændelser: smear; (3) hændelser på halvt sted: åbent cirkulært DNA. Yderligere karakterisering af PFV-intasomet viste også strukturel substantialitet, hvilket indebar stærke protein-protein- og protein-DNA-interaktioner på trods af langvarig inkubation under forhold med høj ionisk styrke. Omfattende krystalliseringsundersøgelser resulterede i en levedygtig krystalkonfiguration, der bøjede røntgenstråler med en opløsning på 2,9 Angstromer. I sidste ende blev der bestemt en tredimensionel struktur. Den asymmetriske enhed indeholdt en enkelt integrase-dimer med et stabilt bundet viralt DNA-molekyle og et par integrase-dimere, der var forbundet med symmetri, og som dannede en aflang tetramer. Dimergrænsefladen er stabiliseret af intermolekylære interaktioner mellem amineterminale og katalytiske kernedomæner (indre underenhed- ydre underenhed). Den overordnede form af den aflange tetramer er unik, om end den har lighedspunkter med tidligere rapporterede HIV-1 integrase-komplekser.
Krystalliseringsteknik
Protein-DNA-komplekserne blev dannet ved hjælp af den fulde længde, wild-type PFV IN og syntetisk dsDNA, der modellerede den virale ende.
Intasomet blev krystalliseret ved hjælp af damp-drop hængende diffusionsteknik. Reservoiropløsningen bestod af 1,35 M ammoniumsulfat, 25% (v/v) glycerol, 4,8% (v/v) 1,6-hexandiol og 50mM 2-(N-morpholino) ethanesulfonsyre (MES) ved pH 6,5. Protein-DNA-krystallerne blev også lagt i blød i nærvær af MK0518, GS9137, Mg(II) og/eller Mn(II). Krystalstrukturen blev løst ved hjælp af molekylær udskiftning.
Krystallografisk og raffineringsstatistik
Hare et al (2010) har offentliggjort data om syv krystalstrukturer. Disse data omfatter PFV IN-komplekset (apo-form) og seks yderligere strukturer, herunder komplekset bundet til Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137 og Mn/GS9137. Alle syv strukturer hører til rumgruppen P4121212. De er blevet raffineret til en opløsning på mellem 2,85 og 3,25 Å.
Samlet arkitektur Komponenter
Struktur
Den samlede struktur af det samlede PFV intasome er en tetramer-model baseret på to domænestrukturer med en dimer-dimer grænseflade. Tidligere intasom-modeller skildrer en lignende, men mere fleksibel struktur, mens PFV-intasomet har vist sig at være stærkt begrænset. Ved hjælp af homologimodellering foreslår Hare et al (2010), at kortere interdomænelinkere kan være en faktor for fleksibilitet, specielt i HIV-1 integrase. De indre underenheder af tetrameren er impliceret i den overordnede tetramerisering og viral DNA-binding. De katalytiske kernedomæner i de ydre underenheder kan fungere som støtte, men da de amino- og carboxy-terminale domæner ikke er opløst i elektrondensitetskort, er deres funktion fortsat ukonklusiv. Det katalytiske kerne-domæne og den carboxy-terminale domæneforbindelse antager en udvidet konformation i det meste af sin længde og er placeret parallelt med det amino-terminale domæne og den indre underenheds katalytiske kerne-domæneforbindelse. Interdomænelinkerne Interdomænelinkerne (CCD-CTD-linker og NTD-CCD-linker) binder begge halvdele af intasomet sammen, og strukturen stabiliseres yderligere af et par carboxy-terminale domæner, der interagerer med begge indre katalytiske kerne-domæner.
Integrase og DNA-interaktioner
Stærke protein-DNA-interaktioner er placeret inden for de terminale seks nukleotider. Hvert carboxyterminalt domæne interagerer med fosfodiester-rygsøjlen i begge virale DNA-molekyler. Desuden interagerer det aminoterminale domæne-udvidelsesdomæne og det aminoterminale domæne med det virale DNA på det aktive sted i det modsatte katalytiske kerne-domæne.
Aktivt sted
Aktivt sted carboxylater er sidekæder af Asp 128, Asp 185, Glu 221.
Et zinkatom hver er placeret nær de aktive steder.
- .
- .
Integrasehæmmere
| Navn | Varemærke | Selskab | Patent | Noter |
| Raltegravir | Isentress | Merck & Co. | – | også kendt som MK-0518. Isopropyl- og methyl-oxadiazol i MK-0518 er involveret i hydrofobiske og stablende interaktioner med sidekæderne Pro 214 og Tyr 212 for at stabilisere dette lægemiddel i det aktive PFV-intasomsted. Denne måde at interagere med lægemiddelbinding på forårsager forskydning af den reaktive 3′-virale DNA-ende fra det aktive sted i PFV-intasomet. Efter binding af MK-0518 til det aktive sted bevæger den reaktive 3′-hydroxylgruppe sig væk fra det aktive sted i PFV-intasomet med mere end 6 Angström. Raltegravir blev godkendt af FDA den 12. oktober 2007 til brug sammen med andre anti-HIV-midler til behandling af HIV-infektion hos voksne. Det er den første integrasehæmmer, der er godkendt af FDA. |
| Elvitegravir | – | Gilead Science | – | GS-9137 interagerer med Pro 214 af PFV intasome gennem sin quinolonbase og isopropylgruppe. Er på forsøgsstadiet; har samme kernestruktur som quinolonantibiotika. Fase II-undersøgelser af elvitegravir hos personer, der har behandlingserfaring, er blevet afsluttet. Fase III-undersøgelser hos patienter med behandlingserfaring er i gang. En fase II-undersøgelse af elvitegravir hos personer, der aldrig har været i antiretroviral behandling, er i gang. I denne undersøgelse vil også blive evalueret et boostingmiddel i stedet for Norvir, der i øjeblikket hedder GS9350. Elvitegravir er lovende for HIV-positive patienter, der tidligere har taget andre anti-HIV-præparater. |
| MK-2048 | – | Merck & Co. | – | En andengenerations integrasehæmmer, beregnet til brug mod HIV-infektion. Den er bedre end den første tilgængelige integrasehæmmer, raltegravir, idet den hæmmer hiv-enzymet integrase 4 gange længere. Det undersøges til brug som en del af præ-eksponeringsprofylakse (PrEP). |
Se også Retroviral Integrase Inhibitor Pharmakokinetik.