Immunofluorescens (IF) er en almindelig morfologisk metode, der anvendes til at bestemme fordelingen af subcellulære komponenter. Antistoffer, der er konjugeret med fluorescerende farvestoffer, er nødvendige i IF-analyser. Antistoffet genkender specifikt antigenet ved at binde sig til målets epitop, og fluoroforen vil blive detekteret under et fluorescerende mikroskop. Subcellulære komponenter kan derfor visualiseres i en mørk baggrund. IF kan også anvendes som en alternativ semikvantitativ analysemetode til overvågning af ekspressionen af det pågældende emne.
Der findes tre typer IF: direkte IF, indirekte IF og kombineret IF.
Direkte IF anvender et enkelt primært antistof, der er konjugeret med et fluorescerende farvestof.
Indirekte IF anvender to antistoffer til farvningen: et primært antistof, der specifikt binder til epitopen, og et matchet sekundært antistof, der er konjugeret med fluorescensfarvestof.
Kombineret IF er en kombination af direkte og indirekte IF-farvning.
Tabel 1. Sammenligning af direkte, indirekte og kombineret IF.
| IF-type | Direkte | Indirekte | Kombineret | |
|---|---|---|---|---|
| Skematisk diagram | 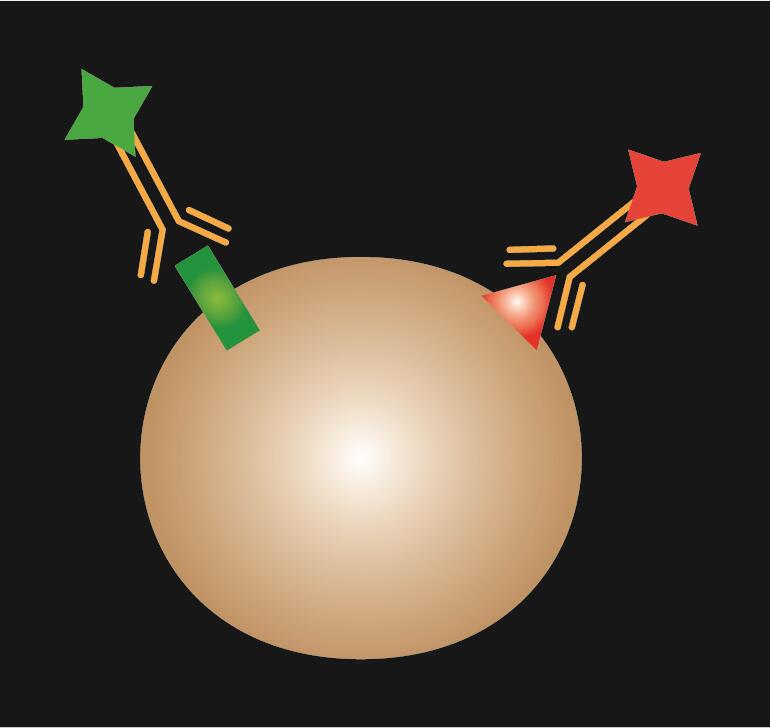 |
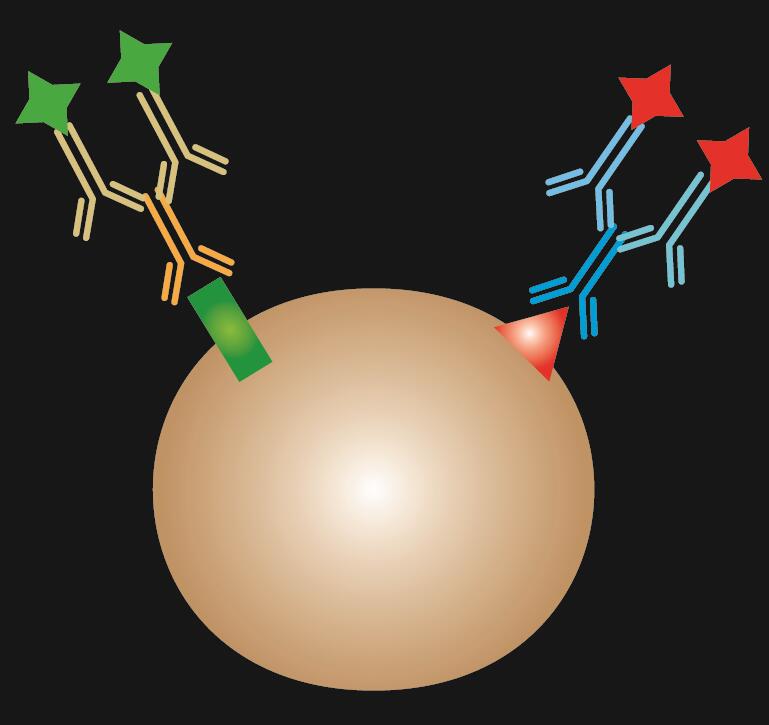 |
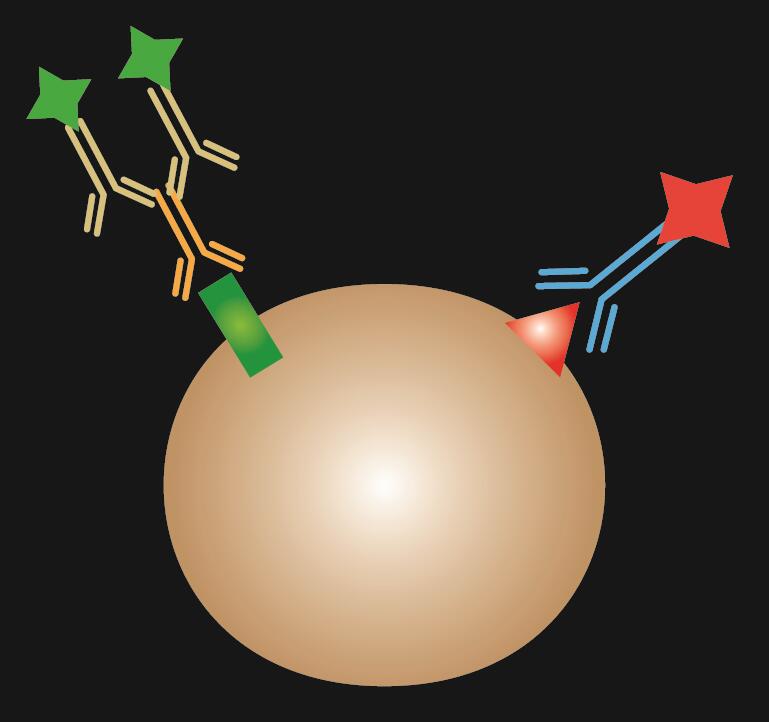 |
|
| Fordele |
|
|
|
|
| Ulemper |
|
|
|
Med hensyn til de tre typer IF, er den indirekte IF-metode mest populær.
IF-metoden kan anvendes på vævsafsnit, dyrkede cellelinjer og individuelle celler. IF-processen svarer til immunohistokemi (IHC).
- Prøveindsamling og fiksering
Prover skal fikseres hurtigt efter fjernelse af væv, og det er bedre at foretage præfiksering gennem hjerteinfusion med 4 % formaldehyd eller paraformaldehyd i små dyr som gnavere. Det anbefales, at vævene ikke er tykkere end 10 mm, og volumenet af fiksationsmidlet bør være mindst 15-20 gange større end vævets volumen. Fiksering er meget vigtig for at bevare cellens morfologi og struktur samt antigenets integritet. Fixeringsopløsningerne skal derfor vælges omhyggeligt i forhold til forskellige antigener og vævsprøver.
Tabel 2. Fixeringsstrategi for partielle antigener.
| Antigen | Fixeringsopløsning | Fixeringsbetingelse | ||
|---|---|---|---|---|
| Mest protein | 95~100% alkohol 4% paraformaldehyd |
3~10 min ved 37℃ 4~24 timer ved 4℃ |
||
| Enzym | Aceton | 15 min ved RT | ||
| Hormon | 95% alkohol plus 1~5% iseddikesyre | 30 min ved 4℃ | ||
| Immunglobulin | 95% alkohol Kulstof tetrachlorid |
10 min. ved 37℃ og derefter 15 min. ved 4℃ | ||
| Fibret protein | 95% alkohol plus 1~5% iseddikesyre | 10 min ved 37℃ derefter 15 min ved 4℃ | ||
| Virus | Aceton Carbon tetrachlorid Alkohol |
5~10 min ved RT derefter 30~60 min ved 4℃ | ||
| Polysaccharid og bakterier | Aceton 10% formaldehyd Methanol |
3~10 min ved RT derefter 30~60 min ved 4℃ | ||
| Lipoid | 10% formaldehyd | 3~10 min ved RT | ||
| Kulturcelle | Varme 4% paraformaldehyd | 15~20 min ved RT |
- Dehydrering og indlejring
Dehydrering er påkrævet ved fremstilling af vævssnit af følgende årsager:
1. Paraffinsnit: Paraffin er ikke blandbar med vand.
2. Frosset snit: Frosne optøede iskrystaller ville ødelægge cellernes morfologi.
Dehydrering udføres altid ved at nedsænke vævet i en alvorlig opløsning med stigende gradient af ethanolopløsning eller saccharoseopløsning.
Derpå kan vævsprøverne indlejres ved at tilsætte smeltet paraffinvoks til paraffinsnit, mens der tilsættes OCT-forbindelse til frosne snit. Dette trin giver en passende hårdhed til bløde vævsprøver og gør det muligt at skære vævet let.
- Snit og farvning
Indlejrede væv kan skæres til tynde skiver med mikrotom eller frysemikrotom. Tykkelsen af skiverne bør bestemmes i overensstemmelse med cellediameteren og formålet med IF-analysen. Tyndere skiver (≤10 μm) foreslås at blive monteret direkte på klæbende objektglas før farvning, da de er lette at blive stavnsbundet i de mange vasketrin. Tykkere skiver (10-30 μm) vil give bedre billeder ved at anvende free floating-metoden, da det primære antistof kan trænge igennem begge sider af skiven. Og frit flydende sektioner monteres på objektglas efter farvning. Frit flydende snit af små væv som f.eks. musens dorsalganglierod (DRG) er vanskelige at udføre, og det er let at miste prøven. Derfor anbefales det at anvende stiksnitsmetoden på nogle små vævsprøver. Farvningstrinene bør udføres i mørke, når der er tale om et antistof, der er konjugeret med et fluorescerende farvestof.
Rejs ud til IF-protokoller:
- Stick section
- Free floating section
- Cultured cells
- Imaging and analysis
Positiv signalering virtualiseres under et fluorescerende mikroskop i en mørk baggrund. Den interessante placering bestemmes normalt ved samfarvning af et protein, hvis placering er kendt. Alternativt kan mængden af positive celler eller fluorescensintensiteten af positiv signalering måles med henblik på kvantitativ analyse. F.eks. henviser en stærkere fluorescensintensitet til en relativ høj ekspression af målproteinet.
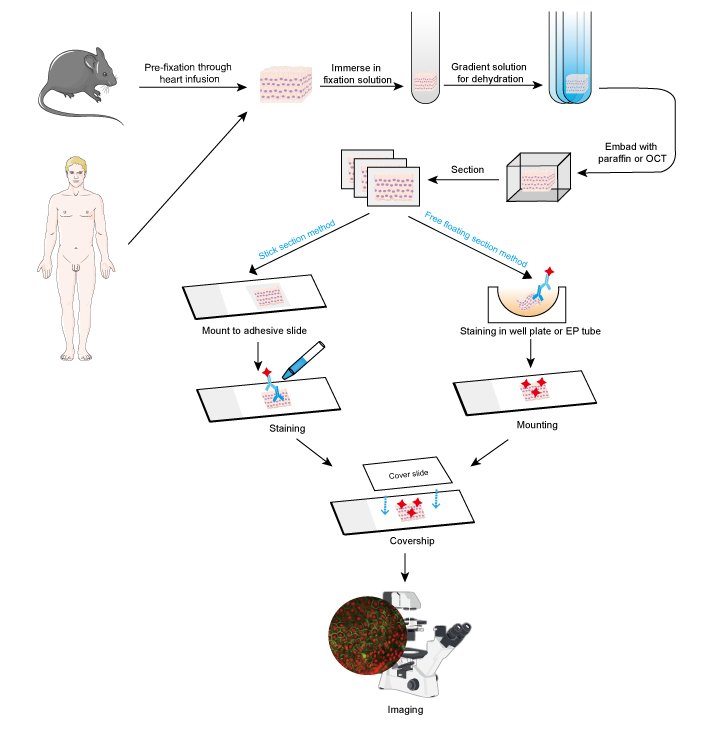
Figur 1. Arbejdsgang for IF på vævssnit.
IF og IHC er begge effektive metoder til morfologisk analyse med vigtige diagnostiske og prognostiske anvendelser. Der er flere forskelle, der skal tages hensyn til i din forskning:
Tabel 3. Sammenligning mellem IHC og IF
| IHC | IF | |
|---|---|---|
| Mærkningsmetode | Kromogen | Fluorescerende |
| Bearbejdningstrin | Mere som substrat kræves | Mindre |
| Billede |
|
|
| Mikroskop | Lysmikroskop | Fluorescensmikroskop |
| Stabilitet | Stabil til år | Mindre stabilt på grund af fotoblegning |
| Eksempel (musens hippocampus) |
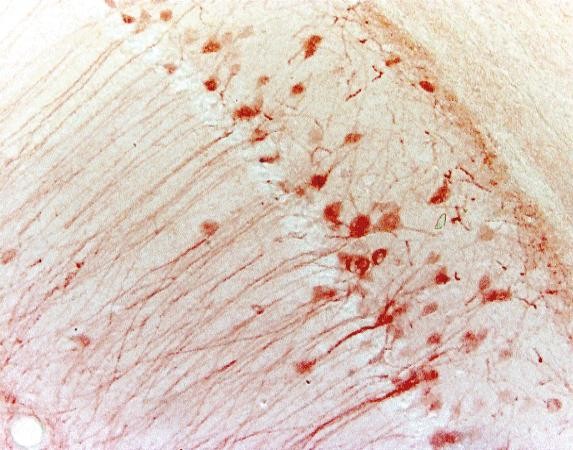 |
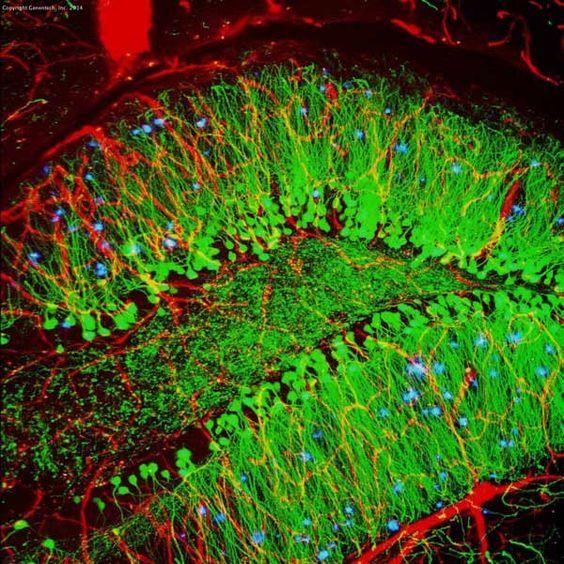 |