Perforin/granzym-apoptosevejen er den primære signalvej, som anvendes af cytotoksiske lymfocytter til at fjerne virusinficerede og/eller transformerede celler. Undersøgelser i genforstyrrede mus viser, at perforin i kombination med granzym kan fremkalde apoptose. Det er afgørende for den cytotoksiske effektorfunktion og har en uundværlig, men udefineret rolle i granzym-medieret apoptose.
Perforin og granzym
Perforin er et poredannende protein og er også kendt som cytoplasmatisk granulat-toksin. Granzym er en familie af strukturelt beslægtede serinproteaser, der opbevares i de cytotoksiske granula af cytotoksiske lymfocytter (CL’er). Perforin og granzym fremkalder i samarbejde apoptose af målcellerne (figur 1). Granzym er nødvendigt for at udløse apoptose af målceller, men de er afhængige af at blive leveret på passende vis af perforin. Både perforin og granzym binder sig til målcellens overflade som en del af et enkelt makromolekylært kompleks, der er associeret med serglycin, hvilket yderligere mindsker sandsynligheden for passiv diffusion af granzymer.
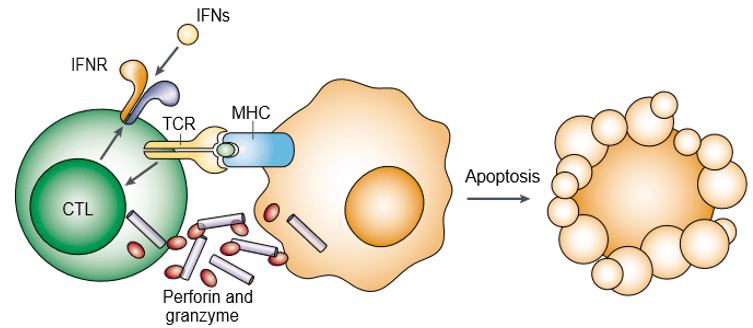
Figur 1. Perforin og granzym inducerer målcelleapoptose i samarbejde.
I mennesker findes der granzym A, B, H, K og M, mens der i mus findes granzym A, B, C, D, E, F, G, K, L, M og N. Granzym A (GrA) og granzym B (GrB) er de mest udbredte granzymer og er de mest undersøgte. Granzym A og B’s funktioner i forbindelse med induktion af målcelleapoptose er blevet undersøgt indgående in vitro, og de er bedre forstået end perforins rolle på molekylært niveau.
Proces og regulering af perforin/granzym-apoptosevejen
Når de er udskilt af cytotoksiske lymfocytter, trænger granzymerne ind i målcellerne, hvilket er et afgørende trin i celledøden. De vigtigste lytiske proteiner, der er pakket i granulerne, er forskellige granzymer og det poredannende protein perforin, som letter internaliseringen af granzymer i cellerne.
Granzym B udløser hovedsageligt caspaseaktivering indirekte, snarere end ved direkte caspasebehandling. Det opnår dette ved direkte at aktivere pro-apoptotiske “BH3-only”-medlemmer af BCL-2-familien, såsom BH3-interagerende domænedødsagonist (Bid). Bid sammen med pro-apoptotiske Bax- og/eller Bak-proteiner fra BCL-2-familien resulterer i udsivning af pro-apoptotiske mitokondrielle mediatorer, såsom cytochrom c, til cytosolen. Frigivelse af cytokrom c aktiverer pro caspase-9, og ved at binde sig til apoptotisk proteaseaktiverende faktor 1 (Apaf-1) bliver pro caspase-9 til moden caspase-9, som fortsætter med at danne apoptosomet og aktiverer downstream caspase-3. Aktiveret caspase-3 er i stand til at spalte specifikke substrater som ICAD (inhibitor of the caspase-activated DNase, CAD), hvilket gør det muligt for CAD at translocere til kernen for at fragmentere DNA. Ud over Bid kan granzym B inaktivere Mcl-1, som er et medlem af den antiapoptotiske Bcl-2-familie, så det pro-antiapoptotiske Bcl-2-familieprotein Bim frigives på den ydre mitokondriemembran. Og granzym B kan også formidle effektoren caspase-3 og initiatoren caspase-8 for at regulere apoptosevejen.
I modsætning til granzym B er granzym M ikke afhængig af mitokondrier for at regulere, men granzym M kan aktivere granzym B ved spaltning af proteinaseinhibitor 9 (PI-9), som er granzym B-inhibitoren. Granzym M kan også direkte kløve ICAD for at udløse CAD ligesom granzym B.
Granzym A inducerer tab af mitokondriernes indre membranpotentiale og frigivelse af reaktive oxygenarter (ROS). Det frembringer enkeltstrengede DNA-snit i stedet for oligonukleosomale DNA-fragmenter. Som reaktion på ROS translokaliseres det ER-associerede SET-kompleks, herunder SET, Ape1, pp32, HMG2, NM23-H1 og TREX1, til kernen, hvor granzym A spalter tre medlemmer af SET-komplekset, der er involveret i DNA-reparation: HMG2, Ape1 og SET.
Perforin/Granzym Apoptosevej i sygdom
Undersøgelser i genforstyrrede mus viser klart, at perforinvejen er tæt involveret i forsvaret mod virale patogener og transformerede celler. Men der er også påvist uanede roller for perforin som en afgørende mediator i immunovervågningen af spontant transformerede celler og i reguleringen af B-cellehomeostase og T-cellehukommelse in vivo. Paradoksalt nok er perforin medvirkende til patogenese af visse autoimmune sygdomsmodeller, såsom insulinafhængig diabetes hos ikkeobesdiabetiske (NOD) mus, men det kan undertrykke andre autoimmune sygdomme, herunder eksperimentel autoimmun encephalomyelitis (EAE).
De perforin/granzyme-apoptoseveje, der regulerer granulatpolarisering og exocytose, er ved at blive fastlagt, og disse veje kan blive forstyrret ved interaktion mellem kræftceller og nogle cytotoksiske lymfocytter. De nylige opdagelser, at granzyme, der trænger ind i målceller, involverer binding til specifikke membranreceptorer, og at nogle tumorer syntetiserer serinproteaseinhibitorer, der kan neutralisere granzymer, har indikeret potentielle nye måder, hvorpå tumorer kan undslippe immunangrebet.