Patient med en subepithellæsion i maven
Martín Gómez Zuleta, MD (1)
(1) Gastroenterologisk afdeling, Institut for intern medicin, Colombias nationale universitet. Hospital Tunal. Bogotá, Colombia..
Received: 05-10-10-10 Accepteret: 25-11-10
Abstract
Og selv om subepithellæsioner sjældent findes i den øvre del af mave-tarmkanalen, kan de forårsage usikkerhed i den diagnostiske tilgang og behandling. Endosonografiske fund beskrives, og de nuværende anbefalinger gennemgås i lyset af et enkelt tilfælde for at muliggøre en rationel tilgang til disse læsioner.
Nøgleord
Submukosale tumorer, endoskopisk ultralyd, GIST.
Klinisk tilfælde
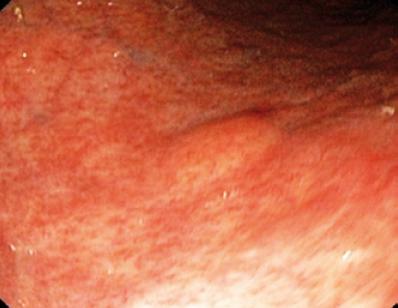
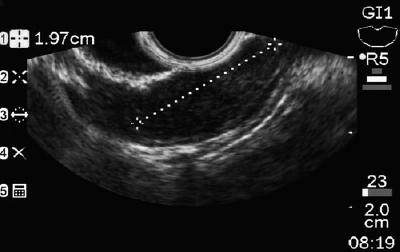
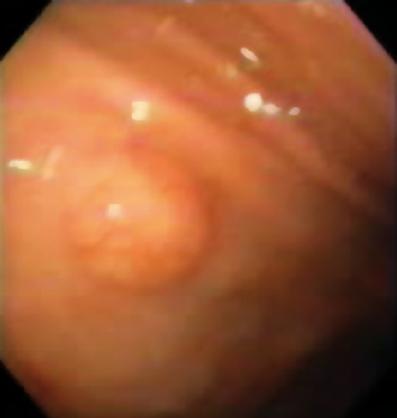
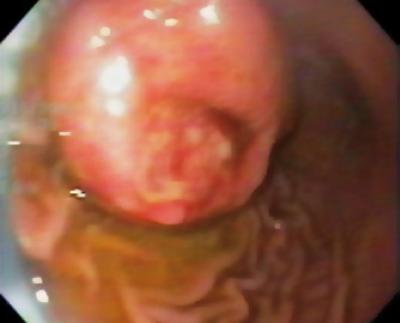
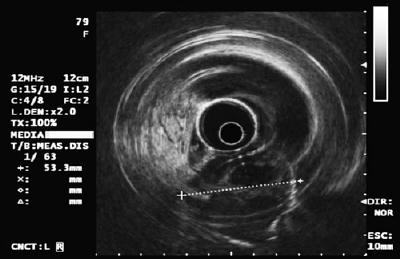
En 50-årig mand med dyspepsi blev sendt til en øvre endoskopi, hvor der blev fundet en 9 mm subepithelial læsion i mavekorpus (Figur 1). Biopsi af den overliggende slimhinde var normal. Patienten havde ingen tidligere sygehistorie, og hans fysiske undersøgelse var normal.
Figur 1. Gastrisk subepithellæsion.
Initial tilgang: Hvad kunne vi så gøre?
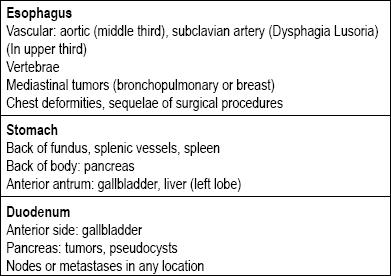
En masse eller fremspring i lumen i et organ, der er dækket af normalt epitel, kaldes en subepithellæsion. De er ualmindelige læsioner, som forventes at være til stede i 1 ud af 300 endoskopier (1, 2). Årsagerne kan være intrinsiske benigne eller maligne læsioner af væggen i mave-tarmkanalen eller extrinsisk kompression forårsaget af normale eller patologiske tilstødende strukturer (3).
Disse læsioner findes normalt tilfældigt og har ofte ingen sammenhæng med symptomer, som det var tilfældet med vores patient. Dette kan få lægen til at tvivle på, om hun eller han bør følge op med mere specifik undersøgelse og udføre yderligere (4). Efter vores mening bør alle disse læsioner evalueres for at klarlægge deres oprindelse. Vi bør altid tage en biopsi af den overliggende slimhinde (medmindre vi har mistanke om en vaskulær eller cystisk oprindelse), fordi mange af disse læsioner kan have oprindelse i lamina propria eller muscularis mucosa. I disse tilfælde kan man nå dem med en tang, og der kan stilles en præcis diagnose. Hvis biopsierne er normale, er det her, vi skal definere, om vi skal stoppe eller fortsætte undersøgelsen.
Når endoskopien er blevet udført, og en subepithelial læsion er blevet påvist, kan vi straks vurdere den. I første omgang skal vi beskrive dens størrelse, form, farve og bevægelighed, og om den pulserer eller ej. Endelig kan vi vurdere dens konsistens med en lukket biopsipincet, så vi kan konstatere, om den er cystisk, fast eller blød, nedtrykkelig og pudeagtig (en læsion, der langsomt gendannes). Pudeformede læsioner med gule haloer tyder i høj grad på lipomer. Hvis læsionen er en let uregelmæssighed i slimhinden og har en central fordybning, tyder det på en ektopisk bugspytkirtel. Normalt har cyster eller varicer en glat, symmetrisk slimhinde. GIST’er (gastrointestinale stromale tumorer) kan være let ulcererede, men de er faste og bevægelige (9). Det er også nyttigt at ændre patientens stilling for at udelukke muligheden for en ekstrinsisk læsion, hvis endoskopiske udseende vil ændre sig, hvis patienten ændrer stilling, inhalerer, eller hvis patientens mave er fyldt med luft (10-12).
Hvad er differentialdiagnosen?
Der er mange typer af læsioner i mave-tarmkanalen, der kan kategoriseres som subepitheliale. Deres årsager afhænger normalt af, om læsionen er placeret i spiserøret, maven, duodenum eller rektum. Det næste punkt, der skal overvejes, er, om det virkelig er en læsion i væggen, eller om der er tale om en ekstrinsisk kompression, da der er strukturer rundt omkring i hele mave-tarmkanalen, som kan føre til kompression (tabel 1) (5-8).
Tabel 1. Primære årsager til extraluminale kompressioner i den øvre del af fordøjelseskanalen.
Bør alle læsioner vurderes med endoskopisk ultralyd (EUS)?
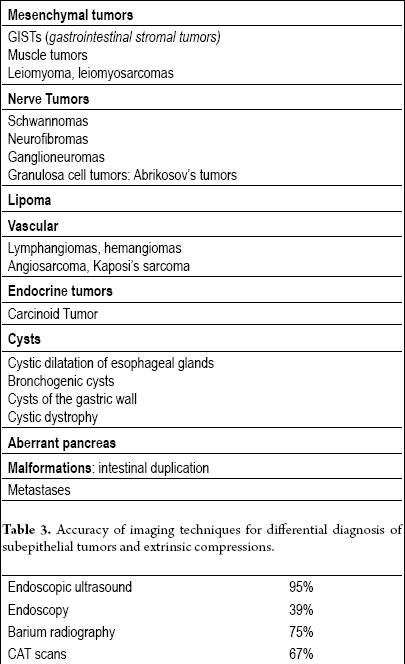
Egentlig skal alle subepitheliale læsioner (Tabel 2) evalueres med yderligere billeddannelsesteknikker, men hvis læsionen er mindre end en centimeter på tværs (især hvis den er gul), er en evaluering ikke nødvendig, fordi der er stor sandsynlighed for, at det er et lipom.
Tabel 2. Subepitheliale tumorer i mave-tarmkanalen.
Den endoluminale eller endoskopiske ultralyd (EUS) er den foretrukne teknik (13, 14). Nøjagtigheden af EUS til differentiering af extraluminale kompressioner fra en subepithelial tumor er over 95 %. Dette er meget bedre end andre billeddannelsesteknikker som f.eks. konventionel ultralyd eller CAT-scanning (15-17) (tabel 3) (Tabel 3).
Tabel 3. Præcision af billeddannelsesteknikker til differentialdiagnostik af subepitheliale tumorer og ekstrinsiske kompressioner.
Når vi har fastslået, at læsionen er intrinsisk i væggen og ikke er en ekstrinsisk kompression, skal vi vurdere, hvilket væglag den svarer til. Normalt er mavevæggen opdelt i mucosa, submucosa, muscularis propria og serosa. Slimhinden er opdelt i epithel, basalmembran, lamina propria og muskelslimhinden. Med EUS og med radioudstyret kan væggen inddeles i 5 lag (18):
Det første hyperechoiske lag svarer til den mest overfladiske del af maveslimhinden.
Det andet hypoekkoiske lag svarer til den dybeste del af slimhinden, der kan korreleres med muskelslimhinden.
Det tredje hyperechoiske lag svarer til det submucosale lag.
Det fjerde hypoekkoiske lag svarer til selve musklen.
Det femte hyperechoiske lag svarer til serosa eller adventitia.
Normalt er der ingen læsioner i lag et og fem (19), så de er begrænset til tre lag. De er normalt hypoekkoiske, anekkoiske eller hyperekkoiske.
Diagnostik med endoskopisk ultralyd
Vi vil beskrive hver præsentation i henhold til dens lag.
Ekologisk lag to
Korresponderer til den dybeste del af mucosa eller til lamina propria og til muscularis mucosa. De læsioner, der opstår i dette lag, er sjældne og er normalt hypoekkoiske.
Hypoekkoiske læsioner: De fleste af de tumorer, der opstår i dette lag, er muskulære, som regel leiomyomer. De kan have forkalkninger, og de store kan være heterogene og vise knuder i modsætning til små læsioner, som er homogene. (20).
I dette lag finder vi også Abrikosovs tumorer eller granulære celler. De er normalt små, og i modsætning til leiomyomerne deformerer de endoskopets kugle på grund af deres hårdhed (figur 2 og 3). Karcinoider kan også have deres udspring i dette lag, normalt i fundus eller rektum (figur 4).
Figur 2. Gulfarvet subepithellæsion i den distale esophagus.
Figur 3. EUS viser en isoechoisk læsion i det tredje ekkolag, som deformerer kuglen, hvilket tyder på en 2 cm stor granulærcelletumor
Figur 4. Subepithellæsion med et retikulært mønster i midten, der tyder på en neuroendokrin tumor.
Anekkoiske læsioner: Normalt kan vi se, at inklusions- eller retentionscyster kan have deres udspring i dette lag.
Ekolag tre
Er et bånd af væv, der ser hyperechoisk ud i EUS. Talrige tumorer kan have deres udspring i dette lag.
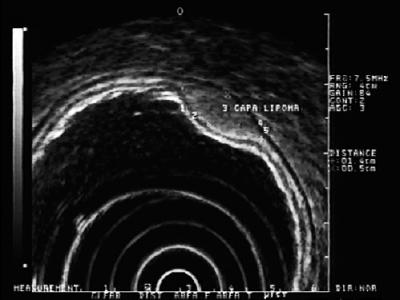
Hyperechoiske læsioner: De hyppigst forekommende læsioner i dette lag er lipomer. De er karakteriseret som homogene hyperechoiske læsioner. Normalt er de pudeagtige, når de skubbes med en endoskopisk tang (figur 5) (9).
Figur 5. EUS: Hyperechoisk læsion i submucosal lag 3 forenelig med lipom.
Neurofibromer har tendens til at være hyperechoiske. De har deres oprindelse i submucosa eller muscularis propria.
Hypoekkoiske læsioner i dette lag kan svare til ektopisk eller aberrerende pancreata. Disse læsioner er normalt heterogene, og lejlighedsvis kan man se anekkoiske kanalstrukturer, som kan svare til kanaler, i midten. Ved en endoskopi ses en læsion med et nedtrykt center (21).
Hypoekkoiske læsioner kan også svare til karcinoide tumorer. Selv om de ikke er subepitheliale tumorer, fordi de er neuroendokrine snarere end mesenkymale, kan de være lokaliseret i fordøjelsesvæggen og give anledning til den samme type knuder. Normalt er de små (mindre end en cm), hypoekkoiske (men mere ekkogene end muskulære) og sætter sig i slimhinden. Histologisk undersøgelse er normalt mulig ud fra en biopsi (22, 23).
Gastriske lymfomer kan også forekomme som hypoekkoiske eller hyperekkoiske læsioner i submucosa (24).
Anekkoiske læsioner, der observeres i dette lag, er sandsynligvis vaskulære strukturer eller cyster (25).
Ekologisk lag fire
Korresponderer til det muskulære lag. Derfor er størstedelen af tumorer i dette lag af muskulær oprindelse.
Hyperechoiske læsioner er meget sjældne, men kan være forbundet med lymfomer, neurogene tumorer eller metastaser (26).
Hypoekkoiske læsioner: De fleste tumorer i dette lag er hypoekkoiske, for det meste stromale tumorer (GIST), når de er placeret i maven. Hvis de imidlertid er placeret i spiserøret, kaldes de normalt leiomyomer. Andre læsioner, der kan have dette udseende, er metastaser med oprindelse i lungerne eller brysterne og glomustumorer (27). Lymfomer kan også kompromittere dette lag, men er generelt ledsaget af engagement i de øvre lag.
GIST (gastrointestinal stromal tumor) er navnet på en læsion, som vores viden om er blevet meget bedre i de senere år (28-30). Disse tumorer synes at have deres oprindelse i totipotentielle celler, som også er oprindelsesstederne for de såkaldte interstitielle celler af Cajal. De kan opdeles i grupper: overvejende muskulære, overvejende neurale eller en kombination af de to. Diagnosen stilles ved immunohistokemisk identifikation af CD-117-protein (også kendt som c-kit-protein), som er en membranreceptor med tyrosinkinaseaktivitet (31).
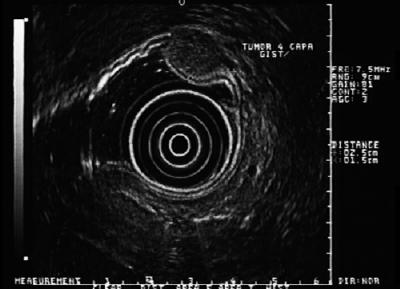
Den betydning af disse læsioner er, at 30 % kan have malign opførsel og give anledning til metastaser. Alene i USA rapporteres der hvert år mellem 5.000 og 6.000 tilfælde (32). Deres fordeling i mave-tarmkanalen er: mave (40-70%), tyndtarm (20-40%), tyktarm og endetarm (5-15%) og spiserør (<5%) (33). Det betyder, at hvis vi har en fjerde lag hypoekkoisk læsion i øsofagus, er det sandsynligvis et leiomyom, men hvis det er i maven, er det normalt en GIST (Figur 6, 7 y 8). De fleste patienter er i deres femte eller sjette leveårtiår. Normalt har de en læsion, der er placeret i det fjerde lag eller muscularis propria, selv om den også kan være placeret i muscularis mucosa (34). De fleste patienter er asymptomatiske, indtil tumoren bliver stor nok til at ulcerere, bløde eller metastasere.
Figur 6. EUS viser hypoekkoisk læsion i det fjerde lag, der er forenelig med GIST.
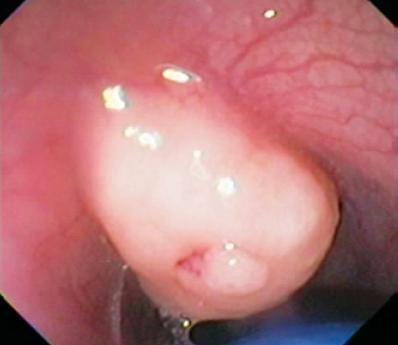
Figur 7. Ulcereret læsion, der tyder på GIST.
Figur 8. EUS i figur 7 viser hypoekkoisk læsion i fjerde ekkolag, der i høj grad tyder på en GIST, mere end 5 cm.
Derfor er det, hvis vi identificerer en GIST større end 3 cm, en indikation for operation, selv om den er asymptomatisk (andre forfattere foreslår en grænse på 4 cm). (35). Læsioner på mindre end 3 cm udgør imidlertid udfordringer for håndteringen, fordi de fleste er benigne. Ikke desto mindre bør det præciseres, at alle GIST’er er potentielt maligne, og der er rapporteret om små GIST’er, der har metastaseret, især i den nedre del af mave-tarmkanalen. På nuværende tidspunkt er vi ikke i stand til med endoskopisk ultralyd at forudsige en GIST’s maligne potentiale. Ikke desto mindre ved vi, at læsioner, der er større end 4 cm, har uregelmæssige grænser og/eller cystiske rum i dem eller har ekkogene foci, har stor sandsynlighed for at være maligne (36).
På den anden side kan endoskopisk ultralydsvejledt fin-nålsaspiration (EUS-FNA) ikke kun diagnosticere GIST ved at identificere CD-117, men kan også tilstedeværelsen af Ki-67-proteinet, som indikerer proliferation og tyder på malign adfærd (37). Det er meget vigtigt at understrege, at GIST-læsioner er meget farlige. Vi skal følge dem løbende og vurdere tumorstørrelse og proliferationshastighed i henhold til de etablerede risici. Selv efter en fuldstændig resektion kan disse læsioner recidivere, især på oprindelsesstedet, men også i peritoneum eller i leveren. 40-90 % af læsionerne går tilbage på trods af fuldstændig resektion. 50 % af recidiverne involverer leveren. GIST’er har 4 gange større risiko for recidiv, når det primære sted er tarmen, end når det er i maven (38).
Hvad er nøjagtigheden af endoskopisk ultralyd?
Flere undersøgelser har vist, at EUS er meget præcis til at bestemme, om en læsion er på væggen eller ej, og til at fastslå, fra hvilket væglag læsionen kommer. Dette giver os mulighed for at vælge den bedste diagnostiske tilgang. En undersøgelse fastslog, at kildelaget hos 48 ud af 50 patienter (96 %) med kirurgisk bekræftelse (39). Interobserveroverensstemmelsen er meget god, især ved identifikation af læsioner som leiomyomer og vaskulære læsioner. Det er vigtigt at bemærke, at det sonografiske udseende af læsioner ikke gør det muligt at bestemme deres årsager med 100 % sikkerhed. En undersøgelse af Karaca et al. (40) af 22 patienter, der gennemgik EUS efterfulgt af mucosektomi, viste, at nøjagtigheden af EUS kun var 45 %. Læsionerne var dog for det meste mindre end 20 mm, og ultralydspræcisionen steg til 66 % for differentiering af maligne fra benigne tumorer. Da de sonografiske kriterier kan være upræcise, forekommer det rimeligt, at vi, hvis det er muligt, bør forsøge at opnå en specifik diagnose. Dette kan opnås med EUS-FNA eller slimhinde-resektion af læsionen som vist i dette arbejde. Mekky et al. undersøgte 141 patienter, der gennemgik EUS-FNA kontrolleret kirurgisk. De fandt en nøjagtighed på 95,6 % for deres endelige resultater (41).
Monitorering, punkturbiopsi eller resektion?
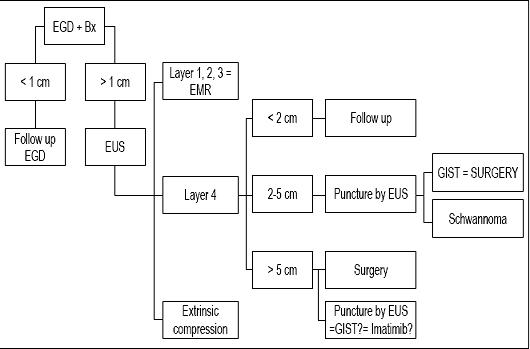
Beslutningen om at monitorere, anvende eller udføre en resektion afhænger af flere faktorer, herunder læsionens størrelse, dens endoskopiske udseende, oprindelseslaget og dens ekkogene egenskaber. Hvis vi står over for en subepithelial læsion på mindre end 1 cm, er flere undersøgelser ikke berettiget, men der bør foretages en opfølgende endoskopi. Hvis læsionen er større end 1 cm, er EUS obligatorisk. Hvis læsionen er lille og afhænger af det første, andet eller tredje ekkolag, kan der foretages diagnostisk slimhinde-resektion, som også er terapeutisk. Hvis læsionen imidlertid befinder sig i det fjerde lag og er mindre end 2 cm, anbefales overvågning med endoskopi alene. Hvis den måler mellem 2 cm og 5 cm, er EUS-FNA ideel. Hvis det konstateres, at der er tale om en godartet læsion, kan der foretages en opfølgende undersøgelse efter 6 måneder. Hvis den ikke er vokset, er det ikke nødvendigt med yderligere kontrol. Hvis den er malign, har malignt potentiale eller er større end 5 cm, anbefales behandling (42).
Sammenfattende mener vi, at da vores patient havde en læsion mindre end 1 cm, mener vi, at hans læsion kun fortjente opfølgende endoskopi (se algoritme, figur 9). En ny opfølgende undersøgelse blev foreslået om et år. Hvis læsionen ikke er vokset, vil der blive planlagt yderligere opfølgningsundersøgelser hvert 2. eller 3. år, men hvis den vokser, vil vi foreslå EUS-FNA og en immunohistokemisk undersøgelse.
Figur 9. Behandlingsalgoritme ved subepitheliale læsioner. EGD: øvre endoskopi. Bx: Biopsi. EUS: endoskopisk ultralyd. EMR: endoskopisk slimhinde-resektion.
1. Polkowski M, Butruk E. Submucosale læsioner. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoskopisk tilgang til gastrointestinale stromale tumorer. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS i submucosale tumorer. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskopisk ultralyd og endoskopisk ultralydsvejledt finnålsaspiration til diagnosticering af maligne submucosale tumorer. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Præcision af endoskopisk ultralydsundersøgelse af submucosale læsioner i den øvre gastrointestinal del af slimhinden: en prospektiv multicenterundersøgelse. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonografiske træk ved gastrisk ektopisk bugspytkirtel, der kan skelnes fra mesenkymale tumorer. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonografiske træk ved øsofageale granulære celletumorer. Endoskopi 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Den rolle, som endoskopisk ultralyd spiller i behandlingen af submucosale tumorer i spiserøret og mavesækken. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Finnålsaspirationsbiopsi af gastriske duplikationscyster med endoskopisk ultralydsvejledning. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoskopisk slimhinde-resektion for gastriske neoplasmer. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskopisk slimhinde-resektion. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoskopisk ultralydsundersøgelse af gastrointestinale stromale tumorer (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. En undersøgelse af myogene tumorer i den øvre del af mave-tarmkanalen ved hjælp af endoskopisk ultralydsundersøgelse med særlig henvisning til differentialdiagnosen af benigne og maligne læsioner. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluering af submucosale læsioner i den øvre del af mave-tarmkanalen ved hjælp af endoskopisk ultralyd. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserveroverensstemmelse for EUS ved evaluering og diagnosticering af submucosale masser. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskopisk ultralydsundersøgelse ved diagnosticering af submucosal tumor i mavesækken. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Martin RW, Haggitt RC, et al. Histologiske korrelater af gastrointestinale ultralydsbilleder. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektiv evaluering af en over-the-wire kateter US-sonde. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskopisk ultralyd til evaluering af glatte muskeltumorer i det øvre gastrointestinale system: en erfaring med 42 tilfælde. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoskopisk ultralydsundersøgelse. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal billeddannelse: endoskopisk ultralyd. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Udbytte af vævsprøvetagning for submucosale læsioner vurderet ved EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskopisk ultralydsundersøgelse til indledende stadieinddeling og opfølgning hos patienter med lavgrads gastrisk lymfom af mucosa-associeret lymfoidt væv, der behandles medicinsk. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosticering af fordoblingscyster ved endoskopisk ultralydsundersøgelse. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonografisk differentiering af benigne og maligne stromale celletumorer. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografiske træk, der kan forudsige benigne og maligne gastrointestinale stromalcelletumorer. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologi og diagnostiske kriterier for gastrointestinale strømtumorer (GIST’er): En gennemgang. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Effektivitet og sikkerhed af imatinib mesylat i avancerede gastrointestinale stromale tumorer. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Gastrointestinale stromale tumorer og andre mesenkymale læsioner i tarmen. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinale stromale tumorer: Fra en kirurgisk til en molekylær tilgang. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Behandling af maligne gastrointestinale stromale tumorer. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromale tumorer. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Måling af læsioner ved endoskopi: en oversigt. Endoscopy 1995; 27; 27: 694-697.
36. Roberts PJ, Eisenberg B. Klinisk præsentation af gastrointestinale stromale tumorer og behandling af operabel sygdom. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. En undersøgelse af myogene tumorer i den øvre del af mave-tarmkanalen ved hjælp af endoskopisk ultralydsundersøgelse med særlig henvisning til differentialdiagnosen af benigne og maligne læsioner. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostisk vurdering af gastrointestinal stromal tumor. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. En klinisk-patologisk undersøgelse af 77 tilfælde med korrelation af træk med ikke-agressiv og aggressiv klinisk adfærd. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosale tumorer og tykke mavesækker. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosale læsioner. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoskopisk tilgang til gastrointestinale stromale tumorer. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskopisk ultralyd og endoskopisk ultralydsstyret finnåleaspiration til diagnosticering af maligne submucosale tumorer. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonografiske træk ved gastrisk ektopisk bugspytkirtel, der kan adskilles fra mesenkymale tumorer. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonografiske træk ved øsofageale granulære celletumorer. Endoskopi 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Den rolle, som endoskopisk ultralyd spiller i behandlingen af submucosale tumorer i spiserøret og mavesækken. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Finnålsaspirationsbiopsi af gastriske duplikationscyster med endoskopisk ultralydsvejledning. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoskopisk slimhinde-resektion for gastriske neoplasmer. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskopisk slimhinde-resektion. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoskopisk ultralydsundersøgelse af gastrointestinale stromale tumorer (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. En undersøgelse af myogene tumorer i den øvre del af mave-tarmkanalen ved hjælp af endoskopisk ultralydsundersøgelse med særlig henvisning til differentialdiagnosen af benigne og maligne læsioner. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluering af submucosale læsioner i den øvre del af mave-tarmkanalen ved hjælp af endoskopisk ultralyd. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserveroverensstemmelse for EUS ved evaluering og diagnosticering af submucosale masser. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskopisk ultralydsundersøgelse ved diagnosticering af submucosal tumor i mavesækken. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Martin RW, Haggitt RC, et al. Histologiske korrelater af gastrointestinale ultralydsbilleder. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektiv evaluering af en over-the-wire kateter US-sonde. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskopisk ultralyd til evaluering af glatte muskeltumorer i det øvre mave-tarmkanalen: en erfaring med 42 tilfælde. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoskopisk ultralydsundersøgelse. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal billeddannelse: endoskopisk ultralyd. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Udbytte af vævsprøvetagning for submucosale læsioner vurderet ved EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskopisk ultralydsundersøgelse til indledende stadieinddeling og opfølgning hos patienter med lavgrads gastrisk lymfom af mucosa-associeret lymfoidt væv, der behandles medicinsk. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnosticering af fordoblingscyster ved endoskopisk ultralydsundersøgelse. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonografisk differentiering af benigne og maligne stromale celletumorer. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografiske træk, der kan forudsige benigne og maligne gastrointestinale stromalcelletumorer. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologi og diagnostiske kriterier for gastrointestinale strømtumorer (GIST’er): En gennemgang. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Effektivitet og sikkerhed af imatinib mesylat i avancerede gastrointestinale stromale tumorer. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Gastrointestinale stromale tumorer og andre mesenkymale læsioner i tarmen. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinale stromale tumorer: Fra en kirurgisk til en molekylær tilgang. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Behandling af maligne gastrointestinale stromale tumorer. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromale tumorer. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Måling af læsioner ved endoskopi: en oversigt. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Klinisk præsentation af gastrointestinale stromale tumorer og behandling af operabel sygdom. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. En undersøgelse af myogene tumorer i den øvre del af mave-tarmkanalen ved hjælp af endoskopisk ultralydsundersøgelse med særlig henvisning til differentialdiagnosen af benigne og maligne læsioner. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostisk vurdering af gastrointestinal stromal tumor. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. En klinisk-patologisk undersøgelse af 77 tilfælde med korrelation af træk med ikke-agressiv og aggressiv klinisk adfærd. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosale tumorer og tykke mavesækker. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.