Glykogen og stivelse, glukosepolymerer af megadaltonstørrelse, er det vigtigste reservoir af lettilgængelig energi og kulstofforbindelser i de fleste levende organismer. Hos pattedyr er glukoseoptagelse og -udnyttelse under nøje kontrol. Fejl i den normale glukosehåndtering er forbundet med en række menneskelige patologier som f.eks. glykogenoplagringssygdomme og diabetes, hvor vedvarende hyperglykæmi er korreleret med en tidlig debut og øget sværhedsgrad af sygdommen. De metaboliske veje for den katalytiske omdannelse af glykogen involverer flere enzymer, hvoraf glykogensyntase katalyserer forlængelsen og glykogenphosphorylase nedbrydningen af a(1,4)-bundne glukaner. Der er i de sidste 30 år indhentet mange oplysninger om glykogennedbrydning gennem biokemiske og strukturelle undersøgelser af glykogen- og maltodextrinphosphorylaser . Disse undersøgelser har vist, at glykogenphosphorylase-regulering er et fascinerende eksempel på kovalent og ikke-kovalent allosterisme, der er nøje koordineret af hormonel kontrol. Der foreligger nu oplysninger, der beskriver de tertiære og kvaternære strukturer for praktisk talt alle de enzymer, der er direkte involveret i glykogenforarbejdningen. Overraskende nok er der kun meget få strukturelle oplysninger om glykogensyntase, som katalyserer glykogenforlængelsen gennem den successive tilføjelse af ![]() -(1,4)-bundne glukoserester til polymerens ikke-reducerende ende ved hjælp af ADP/UDP-glukose som glukosedonor.
-(1,4)-bundne glukoserester til polymerens ikke-reducerende ende ved hjælp af ADP/UDP-glukose som glukosedonor.
Vi har nu bestemt krystalstrukturen af glykogensyntasen fra Agrobacterium tumefaciens (AtGS) ved 2,3 Å opløsning, både i apo-formen og i tilstedeværelse af ADP. Dataene blev indsamlet på ID29, og strukturen blev løst ved hjælp af SAD-teknikken (anomal diffraktion med enkeltbølgelængde), efterfulgt af procedurer til ændring af tætheden. Proteinet findes som en dimer i den asymmetriske enhed, hvor hver monomer består af to “Rossmann-fold”-domæner (figur 81), der er organiseret som i strukturerne af glykogenphosphorylase og andre glykosyltransferaser i GT-B-superfamilien . En dyb spalte mellem de to domæner indeholder det katalytiske center. En væsentlig forskel mellem glykogensyntaser fra pattedyr (familie GT3) og bakterielle glykogensyntaser (GT5) er, at kun GT3-enzymer er tæt reguleret af fosforylering og ikke-kovalent allosterisk modulering. Ifølge de strukturbaserede multiple sekvenstilpasninger mellem GT3-, GT5- og glykogenphosphorylase-sekvenser er de regulerende fosforyleringssteder i menneskelig glykogensyntase sandsynligvis placeret i de 25-residualer N-terminale og 120-residualer C-terminale indsættelser, uden for den ikke-regulerede GT-B-kerne i bakterielle glykogensyntaser. Mutagenesestudier havde tidligere identificeret to konserverede Arg-klynger i GT3-enzymer som en del af det eller de allosteriske steder for både phospho-Ser/Thr-rester og den ikke-kovalente aktivator Glc-6P. De tilsvarende rester i AtGS er placeret i den ene ende af det C-terminale domæne, langt fra reaktionscentret, hvilket indikerer en langdistanceregulerende effekt.
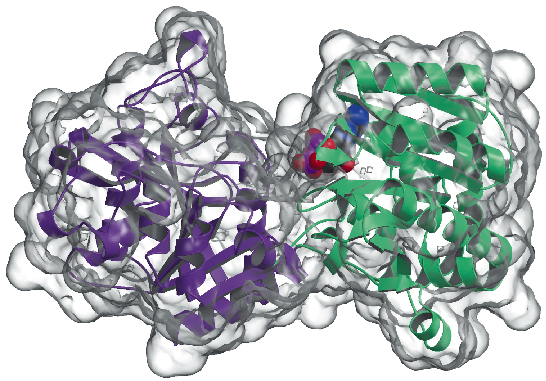
Figur 81: Glykogensyntase struktur: Den opløsningsmiddeltilgængelige overflade er repræsenteret i gennemsigtig. Bemærk det bundne ADP-molekyle (tegnet som VDW-kugler).
Strukturen af AtGS viser en slående topologisk lighed med kernestrukturerne af glykogen/ maltodextrinphosphorylaser (familie GT35) (figur 82a), selv om sekvensidentiteterne er lave (~14%). Strukturen af hvert Rossmann-fold-domæne af AtGS er betydeligt tættere på fosforylaser fra GT35-familien end på nogen anden nukleotidafhængig glykosyltransferase. Glykogensyntase og fosforylaser udviser også en stærk lighed ved deres katalytiske steder (figur 82b). ADP-ribose- og pyridoxalgrupperne ligger i tilsvarende positioner, ligesom det distale fosfat af ADP i AtGS og det uorganiske fosfat-substrat i fosforylaser. Desuden er kritiske aminosyrer, der interagerer med substraternes glukoseenheder, også bevaret. Den katalytiske mekanisme, der anvendes af glykogensyntaser og fosforylaser, er derfor sandsynligvis ens, og subtile ændringer i strukturen forklarer deres overordnede forskellige funktionelle egenskaber.
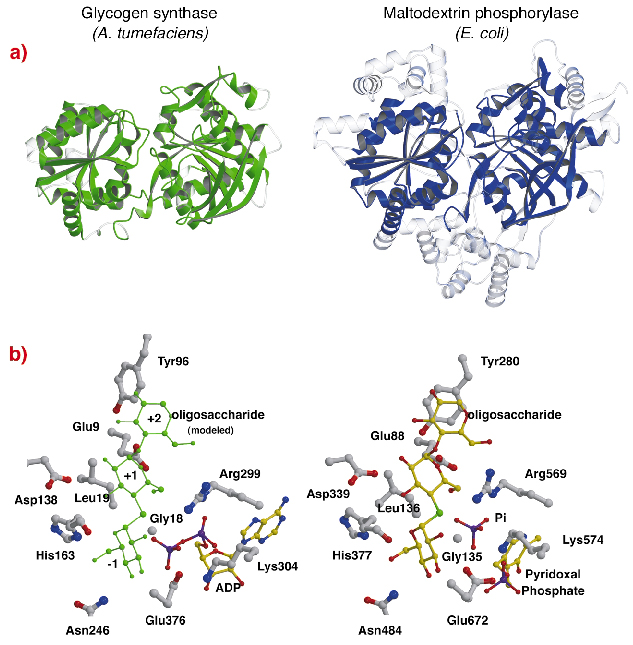
Fig. 82: Homologi til glykogenfosforylase: (a) efter strukturel tilpasning er overlejrede ækvivalente rester mellem AtGS og E. coli maltodextrinphosphorylase MalP, repræsenteret i fast materiale (ikke-tilpassede regioner, i gennemsigtigt); (b) de katalytiske steder i AtGS og MalP.
Det oprindelige forslag om, at glykogensyntese blot repræsenterede en omvending af dets nedbrydende fosforolyse, blev vist at være fejlagtigt, da Leloir viste, at UDP-Glc og glykogensyntase, ikke Glc-1-P og glykogenphosphorylase, var ansvarlige for polysaccharidforlængelsen . Vores arbejde viser nu imidlertid, at de modsatrettede uafhængige reaktioner i glukose-glykogen-interkonverteringen katalyseres af nært beslægtede homologe enzymer.