Det er vigtigt at kende et molekyls Lewis-struktur for at forstå dets fysiske egenskaber, hybridisering og molekylets form. I dag skal vi gennemgå Lewis-strukturen af I3- eller også kendt som triodidion, da den har en negativ ladning på sig. Der er tre jodmolekyler i dette molekyle, og derfor er navnet på forbindelsen Triodid. For at forstå molekylets Lewis-struktur skal vi kende jodmolekylets valenselektroner.
Lewis-struktur
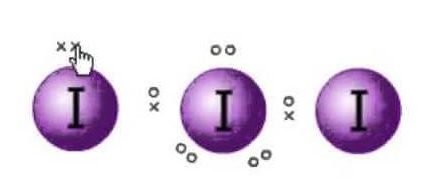
Lewis-struktur er repræsentationen af molekylernes elektroner. Der er ensomme par og valenselektroner, som er med til at bestemme molekylets hybridisering og form. Da der er molekyler af jod, vil et jodmolekyle være i midten. Desuden er jod i den syvende gruppe i det periodiske system og har syv valenselektroner i sin ydre bane.

Vi har her tre jodmolekyler, som sammen med en ekstra elektron, der giver den en negativ ladning. Så det samlede antal valenselektroner er altså : 7×3 + 1= 22.
Der er i alt 22 valenselektroner i dette molekyle. Nu er der en oktetregel, som alle atomer følger. Ifølge denne regel skal hvert atom have otte elektroner i sin ydre bane. Hvis der er 8 elektroner i det centrale atoms ydre skal, er der to andre atomer, som skal supplere deres oktet. Da alle atomer skal have otte elektroner i deres ydre skal for at fuldende oktetten, vil en elektron fra det centrale jodatom blive taget af begge de tilstødende jodatomer. Det betyder, at 8-1-1-1=6.
Da elektronerne vil blive taget af begge atomer.
Så nu vil valenselektronerne på det centrale jodatom være seks. Disse seks elektroner vil danne de ensomme elektronpar, der ikke binder sig. Da det danner elektronparret nu, vil der være tre ensomme par og to bindingspar af elektronerne, da hvert jodatom har en binding med det centrale atom, der deler en elektron hver i alt er der 3 ensomme par og 2 bindingspar på det centrale atom.
Hybridisering
For at kende hybridiseringen af ethvert molekyle, er der en simpel formel, der kan bruges. Denne formel bruges til at finde ud af hybridiseringstallet, som hjælper med at kende hybridiseringen af molekylet.
Hybridiseringstallene og den hybridisering det bestemmer angives som følger:
- 2: sp hybridisering
- 3: sp2 hybridisering
- 4: sp3 hybridisering
- 5: hybridisering
Formlen til at finde tallet er,
Hybridiseringstal: Antal valenselektroner + monovalent + (negativ ladning) – (positiv ladning)/2
Valenselektronerne i jodatomerne er 7, da der er syv elektroner i den yderste skal. Antallet af monovalente atomer er to, da de to ud af tre jodatomer er monovalente. Når vi nu kommer til I3-ionens ladning, har den en negativ ladning, så værdien af denne negative ladning vil være 1.
Sæt nu alle værdierne i overensstemmelse med formlen,
7+1+2/2
=10/2
=5
Det betyder, at hybridiseringsnummeret er 5, hvilket betyder, at hybridiseringen er sp3d.
En anden måde at finde hybridiseringen af et givet molekyle på er ved hjælp af lone par og valenselektroner. Antallet af lone par i dette molekyle er 3, og antallet af atomer, der deler valenselektroner, er 2.
Dermed er 3+2=5, hvilket også bestemmer sp3d-hybridiseringen.
Den form af I3-ionen

Den form af molekylet I3- er Lineær. Der er tre jodatomer, hvoraf det ene har en ekstra negativ ladning. På grund af denne ene ekstra elektron er der 3 ensomme elektronpar og 2 bindingspar, hvilket gør, at dets steriske nummer er 5. Da der er tre ensomme par på det centrale jodidatom, forsøger disse par at frastøde hinanden så meget som muligt. Så for at være væk i en større afstand indtager parrene de ækvatoriale positioner, og de to andre jodatomer er 180 grader fra hinanden. Således er den overordnede form af I3- ionen lineær.
Polaritet
Så her er den tricky del om denne ion, først og fremmest ligesom der er en ladning på den kan vi kalde den som en polyatomisk ion i stedet for at kalde den et molekyle. Ioner er de ladninger, som vi ser på molekylerne. Da I3- har én elektron, har denne ion samlet set en negativ ladning. Molekyler har polaritet, fordi det har både de ladninger, der er en delvist positivt ladet ende og den delvist negativt ladede ende. Der er et dipolmoment på molekylerne afhængigt af adskillelsen af ladningerne på molekylet. Hvis afstanden mellem de to ladninger er større, vil dipolmomentet også være større.
Men når vi taler om I3-ionen, er det en negativt ladet ion. Selv når vi tegner, dens Lewis-struktur ser vi ikke noget dipolmoment eller de polære bindinger i den, da den samlede ladning i sig selv er negativ på ionen. Så den er hverken polær eller upolær. Men hvis man skal beskrive ionen, kan man bruge udtrykket den ” som et polært molekyle”, fordi I3- er opløseligt i vand.
I de afsluttende bemærkninger, for at opsummere, hele denne artikel, er I3- en polyatomisk ion, der har 22 valenselektroner, 3 ensomme par, 2 bindingspar og sp3d-hybridisering. Den er lineær i form og har ingen polaritet.