Indhold
- 1 Indledning
- 2 Strukturelle højdepunkter
- 3 Funktion
- 4 Relevans for menneskers sundhed & Sygdomme
- 5 Eksterne links
Indledning
Human gastric lipase (HGL, E.C. 3.1.1.1.3) (PBD ID: 1hlg) er den lipase, der er ansvarlig for at igangsætte fordøjelsen af kostfedt i maven . Dette syrebestandige enzym udskilles af de fundiske hovedceller i den menneskelige mave og katalyserer 10-20 % af de samlede lipolytiske processer (dvs. dem, der involverer fedtnedbrydning) hos sunde voksne . HGL katalyserer specifikt hydrolysen af triacylglycerol for at producere diacylglycerol og et carboxylat-biprodukt , en proces, der letter den efterfølgende fedtnedbrydning med pancreaslipase . Med hensyn til sygdomsimplikationer er der tegn på, at HGL-sekretionen er ændret hos personer med gastritis (den mest almindelige mavetilstand, hvor mavesækken er betændt) . Desuden må personer med nedsat pancreasfunktion (og dermed nedsat niveau af pancreaslipase) være stærkt afhængige af HGL for at fordøje kostfedt .
Strukturelle højdepunkter
HGL, et hydrolaseenzym bestående af to 379 aminosyrerester lange underenheder, besidder en der indeholder resterne Ser-153, His-353 og Asp-324. Denne struktur er afgørende for nedbrydningen af lipider, koordineret med en ved Leu-67 og Gln-154 , der tjener til at stabilisere overgangstilstanden. Strukturelt set udviser den humane gastriske lipase et kompleks (beta-plader vist i gul, alfa-helixer vist i orange, coiled coils vist i grøn og opløste kulhydrater vist som lilla). HGL ved resterne 215-244 giver plads til de (hydrofobiske regioner noteret med rødt) både omkring det aktive sted og i grænsefladen til låget. Disse områder menes at trække lipider til og fremme docking .
Funktion
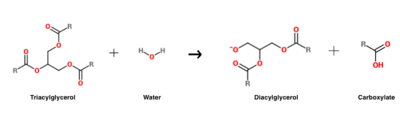
Hydrolysereaktionen af triacylglycerol, der katalyseres af HGL .
HGL fungerer ved en optimal pH-værdi på ca. fem og katalyserer primært hydrolysen af kortkædede triacylglyceroler .
Som esterase med et katalytisk aktivt serin udviser HGL en mekanisme, der ligner den etablerede serinesterase-mekanisme. Det aktive serin på det aktive sted, der er placeret inden for , lettes først af den tilstødende dannelse af en saltbro mellem Asp-136 og His-152, hvilket inducerer tilegnelsen af en proton fra Ser-153. Det nu stærkt nukleofile Ser-153 angriber carbonylkulstoffet i acetatgruppen i et triacylglycerolmolekyle. Den tetraedriske art stabiliseres af oxyanionhullet. Men så snart arten opløses til den kovalent bundne acetat og lipase, undergår serinen en deacylering, hvor vand fungerer som nukleofil. Dette sidste trin bringer Ser-153 tilbage til sin protonerede tilstand .
Relevans for menneskers sundhed & Sygdom
Den hydrolytiske virkning af HGL er noget accessorisk hos raske voksne, hos hvem HGL modulerer højst 10-20% af nedbrydningen af kostfedt . Tilstedeværelsen af HGL er imidlertid afgørende hos for tidligt fødte børn, som ofte udviser dårlig pancreasfunktion, samt hos voksne med patologisk pancreasinsufficiens (f.eks. kronisk pancreatitis) . Disse personer er ikke i stand til at producere tilstrækkelige mængder af pancreaslipase og må derfor primært være afhængige af HGL til fordøjelsen af kostfedt . Hos disse personer er HGL ansvarlig for hydrolyseringen af 30-60 % af kostens triglycerider .
Tomasik et al. (2013) undersøgte den hormonelle regulering af HGL-sekretionen hos børn og unge med gastritis . HGL-aktiviteten blev sammenlignet på tværs af tre grupper: en eksperimentel gruppe bestående af unge, der var diagnosticeret med Helicobacter pylori gastritis (n = 10), en anden eksperimentel gruppe bestående af unge med en ikke-H. pylori-induceret form for gastritis (n = 10) og en kontrolgruppe af raske unge (n = 14). HGL-aktiviteten blev sammen med plasmakoncentrationerne af glukagonlignende peptid-1, cholecystokinin og glukoseafhængigt insulinotropisk peptid observeret gennem analyse af mavesaftprøver, der var blevet indsamlet via endoskopiske målinger fra hver patient.
Patienter, hvis overfladiske gastritis blev induceret af andre patogener end H. pylori, udviste lavere niveauer af HGL-aktivitet sammenlignet med både raske unge (p < .005) og dem, der blev diagnosticeret med H. pylori gastritis (p < .005). De gennemsnitlige plasmakoncentrationer af glukoseafhængigt insulinotropisk peptid var lavere hos raske patienter (p < 0,005) end hos dem med ikke-H. pylori gastritis (p < .003) og dem med H. pylori gastritis (p < 0,01). Reguleringen af HGL-sekretion af glukagonlignende peptid-1 (GLP-1) og cholecystokinin (CCK) viste sig derfor at være ændret hos unge med gastritis; til støtte for dette resultat er det i den eksisterende litteratur blevet foreslået, at GLP-1 og CCK hæmmer HGL-sekretion . Desuden blev glukoseafhængigt insulinotropisk peptid fundet at være en kraftig aktivator af human gastrisk lipaseaktivitet i alle forsøgs- og kontrolgrupper .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG