- Introduktion
- Materialer og metoder
- Deltagere
- Magnetisk resonansbilleddannelse
- Dataindsamling og -behandling
- Atlasudtrækning
- Statistisk analyse
- Resultater
- Patienter med SCA3 afslørede signifikante læsioner i typiske infratentorielle læsionsregioner
- Patienter med SCA3 afslørede cerebrale lateraliserede supratentorielle læsioner
- Diskussion
- Konklusioner
- Data Availability Statement
- Ethics Statement
- Author Contributions
- Funding
- Interessekonflikter
- Akkreditering
- Supplementært materiale
Introduktion
Spinocerebellær ataksi type 3 (SCA3) er en arvelig neurodegenerativ sygdom forårsaget af CAG-udvidelse i den kodende region på kromosom 14q32.1 (1, 2). Klinisk udviser patienter med SCA3 cerebellært syndrom, parkinsonisme, ataktisk gang, dysartri, dysmetri, nystagmus, perifer neuropati, pyramidale og ekstrapyramidale manifestationer (3-5). Patienter med SCA3 lider også af følelsesmæssige forringelser, såsom depression og angst (6, 7). Disse dysfunktioner af højere orden ved SCA3 tyder på yderligere involvering af ekstracerebellære strukturer snarere end det konventionelle “olivopontocerebellære” mønster af neurodegeneration (8-12). Desuden er SCA3-sygdommen blevet beskrevet som cerebellært kognitivt affektivt syndrom (CCAS) (6, 8).
Studier har anvendt positronemissionstomografi (PET) og enkeltfotonemissions-computertomografi til at identificere subkliniske abnormaliteter i hjernebarken (13, 14). Disse undersøgelser rapporterede imidlertid, at forstyrrelsen af den cerebrocerebellære bane ikke helt kan forklare den kognitive og affektive forringelse hos patienter med SCA3. For eksempel er visuospatiale underskud hos patienter med SCA3 markant forbundet med parietallappen og er mindre forbundet med cerebellum. Kun få undersøgelser har fokuseret på den rolle, som supratentorielle regioner spiller i SCA3. Kvantificering af degenerationen i supratentorielle regioner kan være afgørende for vurderingen af dysfunktion hos patienter med SCA3. I neuroimagingundersøgelser er måling af regional kortikal atrofi afgørende for at evaluere dens sammenhæng med kognitiv svækkelse og følelsesmæssig dysfunktion.
Diffusionstensorafbildning (DTI) kan lette visualiseringen og karakteriseringen af hvidt stof (WM), og DTI er også en effektiv metode til undersøgelse af SCA3 (15). SCA3 var blevet verificeret som en WM-dominant atrofi neurodegenerativ sygdom (16). Tidligere undersøgelser viste, at patienter med SCA3 demonstrerer fald i fraktionel anisotropi (FA) i områderne cerebellum og hjernestam, men stigninger i radial diffusivitet (RD) i cerebellum, hjernestam, thalamus og frontal- og temporallapper (17). En anden DTI-undersøgelse identificerede en udbredt FA-reduktion i den bilaterale cerebral-frontale, -parietale, -temporale og -occipitale WM; cerebellar WM; thalamus; og hjernestammen hos patienter med SCA3 (16). Desuden blev gennemsnitlige diffusivitetsforøgelser (MD) påvist i et lignende, bredt overlappende mønster i bilateral cerebral-frontal, -parietal, -temporal og -occipital WM; cerebellar WM; thalamus; og hjernestammen (16).
I denne undersøgelse vurderede vi atrofi i relativt fokale regioner og forklarede supratentorial involvering i SCA3. I denne undersøgelse blev der anvendt den fraktale dimensionsmetode (FD), som har den fordel, at den giver resultater med minimal variation (18), til at kvantificere kortikale morfologiske ændringer og måle den regionale kortikale atrofi i supratentoriale regioner. I den foreliggende undersøgelse målte vi 3D-FD-værdierne af de 97 segmenter af den grå substans fra hele hjernen for hver deltager. Vi sammenligner endvidere disse resultater af grå substanslæsioner med DTI-analysen af hvide substanslæsioner i SCA3 i vores seneste undersøgelse. Vi forventede, at de vurderede GM-læsioner regioner i denne undersøgelse er relateret til WM-læsioner regioner fra DTI-undersøgelsen, og resultatet kan verificere forbindelsen mellem motorisk relateret svækkelse og supratentorielle regioner atrofi hos patienter med SCA3.
Materialer og metoder
Deltagere
I alt 48 patienter med SCA3 og 50 køns- og aldersmatchede raske personer, som kontrolgruppe, deltog i denne undersøgelse. Denne undersøgelse blev udført i overensstemmelse med Helsinki-erklæringen og blev godkendt af Institutional Review Board of Taipei Veterans General Hospital. Alle deltagere gav skriftligt informeret samtykke, inden de deltog i denne undersøgelse. Alle deltagere blev rekrutteret fra Radiologisk Afdeling, Taipei Veterans General Hospital. SARA-skalaen (skala til vurdering og klassificering af ataksi) blev anvendt til klinisk vurdering af ataksi hos patienter med SCA3 (19). Symptomerne på Parkinsons sygdomsforløb i SCA3 blev målt ved hjælp af Modified Hoehn and Yahr-stadiering (20). SARA-score, som var en vurdering af ataxiasymptomernes sværhedsgrad fra 0 til 40, blev anvendt som reference til at angive progressionen af den kliniske sværhedsgrad i forhold til den cerebellære degeneration. En selvrapporteret alder for debut, dvs. den alder, hvor patienterne viste det første tegn på et ataktisk symptom, blev indhentet fra hver patient (21). CAG-repeatlængden for hver SCA3-patient blev bestemt ved hjælp af polymerasekædereaktion som tidligere beskrevet (22). Tabel 1 viser de demografiske, kliniske og MR-billeddannelsesdata for begge grupper. Patienter med SCA3 opfyldte inklusionskriterierne, hvis de havde progressiv og på anden måde uforklarlig ataksi og blev testet positive for SCA3-genotypen. Sygdomslængden hos patienter med SCA3 var 8,89 ± 6,432 år. De i kontrolgruppen havde ingen sygdomme i centralnervesystemet og udviste ingen neurologiske abnormiteter i løbet af undersøgelsesperioden. En erfaren neuroradiolog undersøgte T1- og T2-vægtede billeder af kontrolgruppen for at sikre, at der ikke var uopdagede tegn på en anden neurologisk sygdom eller uventede abnormiteter.
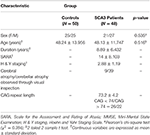
Tabel 1. Demografiske, kliniske og MR-billeddata for kontrolgruppen og patientgruppen.
Magnetisk resonansbilleddannelse
Dataindsamling og -behandling
Aksiale MR-billeder af den menneskelige hjerne, der dækker hele cerebrum og cerebellum, blev erhvervet ved hjælp af en 1,5-T Vision Siemens-scanner (Erlangen, Tyskland). Deltagerne blev scannet med en cirkulært polariseret hovedspole for at opnå T1-vægtede billeder (TR = 14.4 ms; TE = 5.5 ms; matrixstørrelse: 256 × 256; 1.5 mm aksiale skiver; FOV = 256 × 256 mm2; voxelstørrelse, 1.0 × 1.0 × 1.0 × 1.5 mm3, antal skiver = 128). De erhvervede T1-vægtede billeder af hver deltager blev omformateret til et aksialt billede og konverteret til et analyseformat ved hjælp af MRIcro-software (Chris Rorden, University of Nottingham, UK; www.sph.sc.edu/comd/rorden/mricro.html). Figur 1 illustrerer flowdiagrammet for databehandling og statistisk analyse. For at forbedre nøjagtigheden af hjernevævsudtrækningen blev der anvendt en automatiseret skull-stripping-funktion på billedvolumener ved hjælp af hjerneudtrækningsværktøjet i MRIcro-softwaren (figur 1B). De efterfølgende processer blev udført ved hjælp af DiffeoMap (Li, X.; Jiang, H.; Jiang, H.; og Mori, S.; Johns Hopkins University, www.MriStudio.org). I denne procedure blev der anvendt en affin transformation med 12 parametre (23) til at normalisere hvert T1-vægtet billede mod JHU_MNI_SS_T_ss T1-skabelonen.
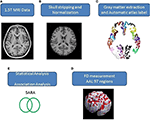
Figur 1. (A-E) Fremgangsmåde for billedprocessen og statistisk analyse.
Atlasudtrækning
Billeddataprocesserne blev udført ved hjælp af SPM8-værktøjskassen (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm/) og IBASPM-værktøjskassen (Individual Brain Atlases using Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), begge kørt ved hjælp af MATLAB 2010-software (Mathworks, Natick, MA, USA).
Proceduren omfatter tre trin efter normalisering: (1) segmentering af det normaliserede billede i grå substans, hvid substans og cerebral spinalvæske i det oprindelige rum, (2) parcellering af grå substans i 116 regioner baseret på den anatomiske mærkning af Montreal Neurological Institute (MNI) anatomiske atlas (24), og (3) transformation af billeder af grå substans til MNI-rummet og den anatomiske tilpasning af hver voxel af grå substans til de 116 automatiske anatomiske mærkningsstrukturer ved hjælp af IBASPM (24), venstre cerebrum: 45 regioner, højre cerebrum: 45 regioner, cerebellum: 26 regioner; (figur 1C). De 26 regioner i cerebellum blev slået sammen til syv regioner i henhold til deres anatomiske strukturer, og volumenet af de 97 mærkede (45 for hver hjernehalvdel og syv for cerebellum, supplerende tabel 1) hjernestrukturer blev ekstraheret for hver person (figur 1C).
Den FD-metode blev oprindeligt foreslået af Mandelbrot til kvantificering af den formrelaterede kompleksitet af objekter i en enkelt numerisk værdi (25). FD-metoden anvendes til topologisk måling af kompleksitet; en højere FD-værdi repræsenterer en større topologisk kompleksitet af det undersøgte væv (18, 26). Mange neurologer har påvist, at FD-værdien kan tjene som et kvantitativt mål til nøjagtig beskrivelse af den morfologiske kompleksitet af hjernefolden (18, 26, 27). Da FD-analysen er baseret på en logaritmisk skala, kan selv en lille stigning i FD-værdien svare til en betydelig stigning i kompleksiteten (18). I denne undersøgelse blev 3D-boksoptællingsmetoden anvendt til at måle 3D-FD-værdierne for de 97 segmenter af grå substans fra hele hjernen for hver deltager (figur 1D). En relateret undersøgelse beskriver algoritmen for box-tællingsmetoden (18).
Statistisk analyse
De køns- og aldersrelaterede forskelle mellem grupperne blev målt ved hjælp af Pearsons chi-square test (χ2 = 0.384, p = 0.535) og den 2-tailed 2-sample t-test (p = 0.516), separat. Der blev anvendt lineær regression for at fjerne virkningerne af alder og køn. Vi anvendte en 2-halet t-test for at afgøre, om der var en signifikant forskel mellem kontrol- og patientgrupperne med hensyn til 3D-FD-værdierne for hver kortikal region. Resultaternes signifikans blev baseret på den falske opdagelsesrate (FDR-korrigeret p = 0,05) (28). Størrelsen af forbindelsen mellem 3D-FD-værdien af individuelle hjerneområder og kliniske træk, såsom sygdomsvarighed og SARA, blev bestemt ved hjælp af Pearson’s r-måling (Figur 1E). Disse analyser blev udført ved hjælp af Statistics Toolbox i MATLAB 2010.
Resultater
Patienter med SCA3 afslørede signifikante læsioner i typiske infratentorielle læsionsregioner
Erfarne neuroradiologer rapporterede MRI-fund for patienter med SCA3 (Tabel 1). Figur 2 illustrerer sammenligningen af 3D-FD-værdier i hver lobe mellem den raske gruppe og SCA3-gruppen. Overordnet set udviste patienter med SCA3 signifikant nedsatte 3D-FD-værdier i hver lobe, og lillehjernen var forbundet med den mest betydelige reduktion i 3D-FD-værdien (Figur 2). 3D-FD-værdierne i cerebellar cortex af SCA3 viste en signifikant korrelation med deres SARA-scoringer (r = -0,3346; p = 0,023). Vi parcelliserede yderligere den cerebrale og cerebellære cortex i 97 regioner og kvantificerede atrofi i hver parcelliseret region. Patienter med SCA3 havde typiske infratentorielle læsioner regioner, herunder pontinkerner, cerebellær cortex og inferior oliven. Detaljerne om de signifikant nedsatte 3D-FD-værdier af atrofiområder mellem den raske gruppe og SCA3-gruppen er opsummeret i tabel 2.
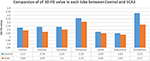
Figur 2. Sammenligning af 3D-FD-værdier i hver lobe mellem den raske gruppe og SCA3-gruppen. 3D-FD-værdien i hver lobe hos SCA3 viste sig at være signifikant lavere end i kontrolgruppen. P-værdien for signifikant forskel for lillehjernen, frontallappen, parietallappen og occipitallappen er mindre end 0,01, og for andre lober er mindre end 0,05.
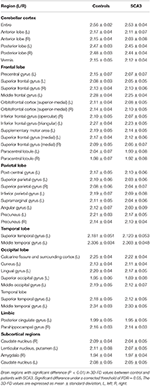
Tabel 2. Signifikant atrofierede regioner hos patienter med SCA3 (p < 0,05).
Patienter med SCA3 afslørede cerebrale lateraliserede supratentorielle læsioner
Suden de infratentorielle læsioner blev der også observeret læsioner i supratentorielle regioner hos alle patienter med SCA3. De viste udbredte læsioner i 39 cerebrale parcellerede regioner (p < 0,05), herunder frontallappen, parietallappen, occipitallappen og temporallappen. De afslørede lateraliseret atrofi og overvejende i venstre hemisfære (højre/venstre: 12/27). Især i occipital- og temporallapperne viste patienter med SCA3 signifikant nedsatte 3D-FD-værdier kun i venstre hemisfære. De signifikant atrofierede regioner i de frontale regioner var den præmotoriske cortex (venstre præcentral gyrus, bilateral superior frontal gyrus og venstre midterfrontal gyrus), supplerende motorisk cortex (venstre supplerende motorisk område) og primær motorisk cortex (venstre præcentral gyrus) (figur 3).
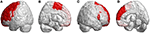
Figur 3. Regioner i frontallappen, der angiver lavere 3D-FD-værdier hos patienter med SCA3 sammenlignet med kontroller. (A) Venstre-udenfor-visning, (B) venstre-indre-visning, (C) højre-udenfor-visning og (D) højre-indre-visning. Patienter med SCA3 havde signifikant nedsatte 3D-FD-værdier i frontale regioner, herunder den præmotoriske cortex (venstre præcentral gyrus, bilateral overlegen frontal gyrus og venstre midterfrontal gyrus), supplerende motorisk cortex (venstre supplerende motorisk område) og primær motorisk cortex (venstre præcentral gyrus). Der blev observeret andre atrofierede regioner i venstre inferior frontal gyrus (opercular), venstre inferior frontal gyrus (triangulær), bilateral orbitofrontal cortex (superior-1 medial), bilateral superior frontal gyrus (medial) og bilateral paracentral lobulus hos patienter med SCA3. Alle de regioner med signifikant nedsatte 3D-FD-værdier er illustreret med rødt.
Andre atrofierede regioner var i venstre inferior frontal gyrus (opercular), venstre inferior frontal gyrus (triangulær), bilateral orbitofrontal cortex (superior-medial), bilateral superior frontal gyrus (medial) og bilateral paracentral lobulus. I parietallappen blev der påvist nedsatte FD-værdier i venstre postcentral gyrus, venstre supramarginal gyrus, venstre angulær gyrus, bilateral overordnet parietal gyrus og bilateral precuneus hos patienter med SCA3 (figur 4).
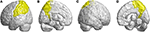
Figur 4. Regioner i den parietale lobe, der indikerer et fald i 3D-FD-værdien hos patienter med SCA3 sammenlignet med kontroller. (A) Venstre-udvendig visning, (B) venstre-indvendig visning, (C) højre-udvendig visning, og (D) højre-indvendig visning. Sammenlignet med kontroller havde patienter med SCA3 signifikant lavere 3D-FD-værdier i venstre postcentral gyrus, venstre supramarginal gyrus, venstre angulær gyrus, bilateral superior parietal gyrus og bilateral precuneus i den parietale lap. Alle de signifikant nedsatte 3D-FD-værdiområder er illustreret med gul farve.
I occipitallappen viste SCA3-patienter signifikant lavere FD-værdier i calcarine fissur og den omgivende cortex, cuneus, lingual gyrus og den overlegne og midterste occipitale gyri i venstre hjernehalvdel (Figur 5A, blå farve). I tindingelappen var regioner med nedsatte FD-værdier i den venstre-superior temporale og venstre-midterste temporale gyri hos patienter med SCA3 (Figur 5A, lilla farve). 3D-FD-værdierne i den venstre posteriore cingulære gyrus i den limbiske region var også signifikant nedsat hos patienter med SCA3 (figur 5B,D, grøn farve). Der blev observeret regioner med betydelig atrofi i de basale ganglier, herunder den bilaterale caudatokerne og venstre putamen, hos patienter med SCA3 (figur 5B,D, aquablå farve). I den højre-udenlige occipitallap blev der ikke observeret nogen signifikant atrofierede regioner hos patienter med SCA3 (figur 5C).
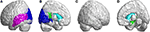
Figur 5. Regioner i occipitallappen, temporallappen og subkortikallappen, der indikerer signifikant lavere 3D-FD-værdier hos patienter med SCA3 sammenlignet med kontroller. (A) Venstre-udvendig visning, (B) venstre-indvendig visning, (C) højre-udvendig visning, og (D) højre-indvendig visning. De blå områder viser signifikant lavere 3D-FD-værdier i occipitallappen, herunder calcarine fissur og den omkringliggende cortex, cuneus og lingual gyrus og den overlegne og midterste occipital gyrus i venstre hjernehalvdel. Lilla områder angiver lavere 3D-FD-værdier i den venstre-superior temporale gyrus og den venstre-midterste temporale gyrus. Aqua blå regioner repræsenterer lavere 3D-FD-værdier i subkortikale regioner, herunder den bilaterale caudat og venstre putamen. Grønne regioner repræsenterer signifikant lavere 3D-FD-værdier i den venstre posteriore cingulære gyrus og den parahippocampale gyrus i det limbiske system.
I figur 6 fandt vi mange cerebrale atrofierede regioner, herunder cerebellum, cerebellar-thalamokortikale og basale ganglia-thalamokortikale forbindelseskredsløb, der antydede, at patienter med SCA3 afslørede cerebellar-thalamokortikale og basale ganglia-thalamokortikale beskadigede i disse veje.

Figur 6. SCA3 er involveret i både de cerebellar-thalamokortikale og basale ganglia-thalamokortikale veje. (A) Venstre-udvendig visning, (B) venstre-indvendig visning, (C) højre-udvendig visning og (D) højre-indvendig visning. I det cerebellære-thalamokortikale loop udviser patienter med SCA3 signifikant lavere 3D-FD-værdier i cerebellære, præmotoriske og supplerende motoriske cortexer. De nedsatte 3D-FD-værdier i den cerebellære cortex og andre motorisk relaterede hjerneområder hos patienter med SCA3 giver en forklaring på tilstedeværelsen af kliniske symptomer. I det basale ganglia-thalamokortikale loop udviser patienter med SCA3 signifikant lavere 3D-FD-værdier i den frontale cortex, den primære motoriske cortex, putamen og caudat. Disse resultater afslører morfologiske ændringer i den basale ganglia-thalamokortikale loop hos patienter med SCA3.
Diskussion
Klinisk set udviser patienter med SCA3 cerebellært syndrom og parkinsonisme (3-5). De atrofierede regioner af infratentorial og supratentorial cortex, der er opført i tabel 2, og viste en bred vifte af overlappende områder som i to funktionelle regioner, nemlig cerebellum-relateret (CB-relateret) cortex (29) og basalgangliarelateret (BG-relateret) cortex (30). Den CB-relaterede cortex omfatter cerebellum, præfrontal, sensomotorisk cortex, præfrontal cortex og temporallappen, og BG-relateret cortex omfatter primær motorisk cortex, supplerende motorisk område, præmotorisk cortex og basalganglier. Vores resultater afslørede i overensstemmelse med tidligere konventionelle neuroimaging-undersøgelser, at cerebellum er den mest berørte og atrofierede region hos patienter med SCA3 (4, 31, 32). Derudover havde 3D-FD-værdien i cerebellar cortex hos patienter med SCA3 en signifikant negativ korrelation med SARA-scoringer (r = -0.3346; p = 0.023), som Rezende et al. nogensinde havde rapporteret (33).
I de infratentorielle regioner havde patienter med SCA3 en signifikant nedsat 3D-FD-værdi i putamen og caudate. Neuropatologiske undersøgelser har vist neuronalt tab i putamen og caudate, hvilket kan føre til atrofi af de basale ganglier i forbindelse med parkinsonisme (34). Parkinsonistiske træk er den fremherskende fænotype ved SCA3-mutationen og er normalt ledsaget af basalgangliasymptomer (35-37). I nekropsiske undersøgelser er involvering af basalganglierne almindelig hos patienter med SCA3. Funktionel billeddannelse ved hjælp af PET-undersøgelser har også påvist tidlig funktionel tilbagegang i caudat og putamen hos patienter med SCA3. Desuden havde patienter med SCA3 et betydeligt mindre volumen af basale ganglier (35). Relaterede undersøgelser har imidlertid kun fokuseret på de basale ganglier og infratentoriale regioner. I figur 6 verificerede vi, at SCA3 måske ikke kun har læsioner af basalganglier, men også skader på cerebellar-thalamokortikale og basalganglia-thalamokortikale veje.
Patienter med SCA3 udviser signifikant nedsatte 3D-FD-værdier af den præmotoriske cortex og den supplerende motoriske cortex i deres cerebellar-thalamokortikale loop. Den præmotoriske cortex og det supplerende motoriske område er forbundet med bevægelseskontrol, som f.eks. muskelkraft og retning af rækkevidde. Skader i disse regioner kan fremkalde ataksi af gang, stand og lemmer ud over bevægelsesdekomposition (38, 39). De reducerede 3D-FD-værdier af cerebellar cortex og andre motorrelaterede cerebrale regioner hos patienter med SCA3 kan forklare tilstedeværelsen af kliniske symptomer. I det basale ganglia-thalamokortikale loop udviser patienter med SCA3 desuden signifikant nedsatte 3D-FD-værdier i de frontale og primære motoriske cortexer. Den primære motoriske cortex er også en vigtig destination for basalgangliernes output (40). Forstyrrelser i det basale ganglia-thalamokortikale loop kan også bidrage til Parkinsons motoriske dysfunktion (41). Resultaterne af denne undersøgelse understreger de morfologiske ændringer i det basale ganglia-thalamokortikale loop hos patienter med SCA3, som tidligere neuroimaging-undersøgelser ikke har behandlet.
For nylig brugte vi diffusionstensorafbildning (DTI) til at måle vandmolekylær diffusion af hvidt stof (WM) forandring i SCA3 (15). Vi fandt SCA3 afslørede udbredte hvide stoflæsioner i den bilaterale cerebral-frontale, -parietale, -temporale og -occipitale WM; cerebellær WM; thalamus og hjernestammen. I denne undersøgelse observerede vi, at SCA3 viste næsten de samme parcellede regioner af disse WM-læsioner, som afslørede GM-læsioner, i samme undersøgelse. Disse aktuelle resultater bekræfter inddragelsen af supratentorielle regioner hos patienter med SCA3. Braga et al. rapporterede lignende resultater og påviste, at SCA3 forårsager CCAS gennem forringelse af eksekutive funktioner, verbal fluency, abstrakt ræsonnement og arbejdshukommelse (8). I neuropatologiske undersøgelser blev det afsløret, at CCAS skyldes en forstyrrelse af det cerebellære kredsløb, som er forbundet med de præfrontale, overlegne parietale, overlegne temporale og limbiske cortexer (42, 43). Undersøgelser har bekræftet lillehjernens rolle i den kognitive funktion; kognitive, affektive og visuospatiale funktioner er imidlertid direkte forbundet med kortikal degeneration. De signifikant atrofierede områder i de supratentorielle regioner hos patienter med SCA3 var mere omfattende end de CCAS-associerede regioner. Atrofi af den supratentorielle cortex kan være den primære faktor, der er forbundet med dysfunktionen i de ataksi- og parkinsonrelaterede regioner. Disse resultater tyder på, at SCA3 ikke længere bør betragtes som en sygdom, der er begrænset til lillehjernen og dens forbindelser; den bør snarere betragtes som en patologi, der påvirker hele hjernen.
Denne undersøgelse havde dog stadig visse begrænsninger. De vigtigste begrænsninger i denne undersøgelse er manglen på specifikke kognitive evalueringer og kliniske parametre til vurdering af CCAS i SCA. Yderligere undersøgelser er berettiget med hensyn til korrelationen mellem de nuværende resultater og kliniske data, såsom funktionelle MRI-data. Dette kan bidrage til at give en mere præcis metode til vurdering af sammenhængen mellem kognitiv med motorisk relateret involvering og regional atrofi hos patienter med SCA3.
Konklusioner
I denne undersøgelse anvendte vi 3D-FD-metoden til at kvantificere regionale morfologiske variationer hos patienter med SCA3 og vurdere sammenhængen mellem supratentorial atrofi og motorisk relateret involvering hos patienter med SCA3. Vores resultater viste en betydelig degeneration af hjernebarken i specifikke regioner, som måske er cerebellarelaterede eller basalgangliarelaterede. Vores resultater kan korrelere med de almindelige symptomer på SCA3, såsom ataksi, parkinsonisme, dysartri og dysmetri. SCA3 bør ikke længere betragtes som en sygdom, der er begrænset til cerebellum og dets forbindelser; det bør snarere betragtes som en patologi, der påvirker hele hjernen.
Data Availability Statement
Alle datasæt genereret til denne undersøgelse er inkluderet i artiklen / Supplementary Material.
Ethics Statement
Studierne, der involverer menneskelige deltagere, blev gennemgået og godkendt af Institutional Review Board of Taipei Veterans General Hospital. Patienterne/deltagerne gav deres skriftlige informerede samtykke til at deltage i denne undersøgelse.
Author Contributions
P-SW og Y-TW organiserede forskningsprojektet, gennemgik og kritiserede manuskriptet. T-YW skrev manuskriptet. H-MW fik adgang til forskningsdata. B-WS organiserede forskningen og udførte dataindsamling. C-WJ udførte den statistiske analyse, skrev og reviderede manuskriptet.
Funding
Denne undersøgelse blev finansieret af Ministeriet for Videnskab og Teknologi, Taiwan (MOST108-2634-F-010-002); National Health Research Institutes, Taiwan (NHRI-EX106-10526EI); National Yang-Ming University og Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006).
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Forfatterne ønsker at takke alle de personer, der deltog i denne undersøgelse, og takke Wallace Academic Editing for redigering af dette manuskript.
Supplementært materiale
Det supplerende materiale til denne artikel kan findes online på: https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. CAG-udvidelser i et nyt gen for Machado-Joseph-sygdom på kromosom 14q32.1. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: neurologiske træk, patogenese og dyremodeller. Cerebellum. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Clinical and molecular advances in autosomal dominant cerebellar ataxias: from genotype to phenotype and physiopathology. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autosomal dominant cerebellar ataxier: kliniske træk, genetik og patogenese. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Progressiv kognitiv dysfunktion i spinocerebellær ataksi type 3. Movement Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Cerebellært kognitivt affektivt syndrom i machado josephs sygdom: centrale kliniske træk. Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Executive and emotional dysfunction in Machado-Joseph disease. Movement Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Kognitiv dysfunktion ved spinocerebellær ataksi type 3: variable topografier og mønstre. Movement Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Udbredte neuronale skader og kognitiv dysfunktion i spinocerebellær ataksi type 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Svar til: Kognitiv dysfunktion ved spinocerebellær ataksi type 3: variable topografier og mønstre. Movement Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Anatomisk grundlag for kognitiv-emotionelle interaktioner i den præfrontale cortex hos primater. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neokortikal atrofi ved machado-joseph-sygdom: en longitudinal neuroimaging-undersøgelse. J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Soong BW, Liu RS. Positronemissionstomografi hos asymptomatiske genbærere af Machado-Joseph-sygdom. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamintransportør positronemissionstomografi i spinocerebellære atakier type 1, 2, 3 og 6. Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Diffusionstensor magnetisk resonansbilleddannelse til differentiering af multiple systematrofi cerebellær type og spinocerebellær ataksi type 3. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. Skader på det hvide stof er relateret til ataksiens sværhedsgrad i SCA3. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. En multimodal evaluering af mikrostrukturelle skader i den hvide substans ved spinocerebellær ataksi type 3. Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Fraktal dimensionsanalyse til kvantificering af cerebellær morfologisk ændring af multiple systematrofi af cerebellær type (MSA-C). NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Skala til vurdering og klassificering af ataksi. Udvikling af en ny klinisk skala. Neurologi. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Hoehn MM, Yahr MD. Parkinsonisme: indtræden, progression og dødelighed. Neurology. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Neurologiske fund ved Machado-Joseph-sygdom: sammenhæng med sygdomsvarighed, undertyper og (CAG)n. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Frekvensanalyse af autosomalt dominerende cerebellære atakier hos taiwanesiske patienter og klinisk og molekylær karakterisering af spinocerebellær ataksi type 6. Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Automatiseret billedregistrering: I. Generelle metoder og intrasubjekt- og intramodalitetsvalidering. J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Automatiseret anatomisk mærkning af aktiveringer i SPM ved hjælp af en makroskopisk anatomisk parcellering af MNI MRI-hjernen for en enkelt forsøgsperson. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Fraktaler: Form, tilfældighed og dimension. San Francisco, CA: Freeman (1977). s. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Fraktal dimension og ændringer i den hvide substans ved multipel sklerose. NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Fraktal dimension af cerebral kortikal overflade i skizofreni og obsessiv-kompulsiv lidelse. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Kontrol af den falske opdagelsesrate: en praktisk og effektiv tilgang til multipel testning. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Anatomisk undersøgelse af projektioner til basis pontis fra posterior parietal association cortices i rhesusabe. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Selektiv forstærkning ved hjælp af en kontraherende model af de basale ganglier. Pont A Mousson: NeuroComp (2006). p. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomal dominant cerebellær ataksi type I kliniske træk og MRT i familier med SCA1, SCA2 og SCA3. Brain. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Magnetisk resonansbilleddannelse ved spinocerebellære atakier. Cerebellum. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Cerebral cortex-involvering i Machado-Joseph-sygdom. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. Den parkinsoniske fænotype af spinocerebellær ataksi type 3 i en taiwanesisk familie. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomal dominant cerebellar ataksi type I. MRI-baseret volumetri af posterior fossa-strukturer og basale ganglier i spinocerebellar ataksi type 1, 2 og 3. Brain. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Saraiva-Pereira ML, Jardim LB. Intrafamiliel variabilitet af Parkinson-fænotypen i SCA’er: nye tilfælde som følge af SCA2- og SCA3-udvidelser. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bettencourt C, Santos C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Parkinsonfænotype ved Machado-Joseph-sygdom (MJD/SCA3): en rapport om to tilfælde. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Principper for neuralvidenskab. New York, NY: McGraw-Hill (1991). s. 626-46.
Google Scholar
39. Asbury AK, McKhann GM. Sygdomme i nervesystemet: Klinisk neurobiologi. Philadelphia, PA: W.B. Saunders (1992). s. 319-341.
40. Hoover JE, Strick PL. Flere udgangskanaler i de basale ganglier. Science. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Kvantitativ analyse af dopaminerge tab i forhold til funktionelle territorier hos MPTP-behandlede aber. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Spinocerebellar ataxia type 3 (SCA3): thalamisk neurodegeneration forekommer uafhængigt af thalamiske ataxin-3 immunopositive neuronale intranukleære inklusioner. Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Konsistent affektion af det centrale somatosensoriske system ved spinocerebellær ataksi type 2 og type 3 og dens betydning for kliniske symptomer og rehabiliterende behandling. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar