- Introduktion
- Materialer og metoder
- Dyr og opstaldning
- Gaboxadol-behandling og eksperimentel tidslinje
- Open Field Test (OFT)
- Successive Alleys Test (SAT)
- Light-Dark Exploration Test (LDT)
- Social interaktion (SI), aggressiv adfærd
- Stereotypi
- Selvplejning
- Statistisk analyse
- Resultater
- Gaboxadol normaliserer hyperaktivitet observeret i Fmr1 KO2-mus
- Angstlignende adfærd i Fmr1 KO2-mus normaliseres af Gaboxadol
- Irritabilitet og aggressiv adfærd i Fmr1 KO2-mus normaliseres af Gaboxadol
- Gaboxadol normaliserer gentagende adfærd i Fmr1 KO2-mus
- Diskussion
- Ethisk erklæring
- Author Contributions
- Funding
- Interessekonflikterklæring
Introduktion
Fragilt X-syndrom (FXS) er den mest almindelige arvelige form for intellektuel funktionsnedsættelse og autisme med en anslået frekvens på 1:4,000-5,000, der påvirker alle etniske grupper verden over (Gross et al., 2015). Personer med FXS har en øget risiko for en række tilknyttede adfærdsproblemer, herunder: opmærksomhedsproblemer, hyperaktivitet, angst og mange træk, der associeres med autisme, herunder motoriske stereotypier, social undgåelse, selvskadende adfærd og aggression (Hagerman et al., 2010). Derudover er personer med FXS tilbøjelige til at have comorbide medicinske problemer, herunder kramper, søvnforstyrrelser, gastrointestinale problemer og problemer med bindevæv. Adfærdsinterventioner og farmakologisk behandling af diskrete symptomer tilbydes til personer med FXS, men der findes i øjeblikket ingen FDA-godkendte behandlinger til behandling af syndromet som helhed.
FXS er et resultat af mutationer i FMR1-genet, der blokerer ekspressionen af det skrøbelige X mental retarderingsprotein (FMRP). FMRP er et allestedsnærværende udtrykt mRNA-bindingsprotein, der er nødvendigt for transport og oversættelse af 4-8 % af synaptiske proteiner og dermed regulerer en række synaptiske funktioner (Bassell og Warren, 2008). FMRP’s rolle i FXS og evaluering af kandidatterapeutika er blevet undersøgt i stor udstrækning gennem brug af en Fmr1 knockout (KO) musemodel, der først blev karakteriseret af det hollandsk-belgiske Fragile X Consortium (Bakker et al., 1994). Fmr1 KO-modellen blev genereret ved en målrettet indsættelse af en neomycin-kassette i exon 5 af FMR1-genet, hvilket resulterede i en mus, der havde et ikke påviseligt niveau af FMRP-protein og et lavt niveau af resterende Fmr1 mRNA (Bakker et al., 1994). Fmr1 KO2-musen er rettet mod en ny nulallel på Fmr1, der er genereret ved at slette promotoren og det første exon af Fmr1 (Mientjes et al., 2006). Den er både protein- og mRNA-nul. Denne model er blevet bredt anvendt til lægemiddelafprøvning (Deacon et al., 2015; Cheng et al., 2017; Gaudissard et al., 2017; Dahlhaus, 2018; Leboucher et al., 2019; Tranfaglia et al., 2019), og batteriet af adfærdstest har i høj grad været fokuseret på hyperaktivitet, øget følsomhed over for auditive stimuli, stereotypi og underskud i indlæring og hukommelse (Olmos-Serrano et al., 2011). På celle- og kredsløbsniveau har undersøgelser af FXS-musene i høj grad fokuseret på overaktiv metabotropisk glutamatreceptor 5 (mGluR5) signalering (Dölen et al., 2007), øget proteinsyntese (Osterweil et al., 2010) og øget langtidspotentiering (LTP; Auerbach og Bear, 2010).
En γ-aminobuttersyre (GABA)ergisk hypotese af FXS er også opstået baseret på observationer fra personer med FXS og mus, der mangler en aktiv kopi af Fmr1-genet. GABA er den primære hæmmende neurotransmitter i hjernen og signalerer post-synaptisk gennem enten hurtige ionotrope (GABAA) receptorer eller langsomme metabotrope (GABAB) receptorer. Inden for GABAA-receptorpopulationen skelnes der yderligere mellem synaptiske og ekstrasynaptiske receptorer, der formidler henholdsvis fasisk og tonisk hæmning (Olmos-Serrano et al., 2010; Meera et al., 2011). Til støtte for den GABAergiske hypotese viser personer med FXS reduceret GABAA-receptortilgængelighed (D’Hulst et al., 2015). Dette resultat fra personer med FXS er fint parallelt med fund i en musemodel af sygdommen.
Molekylære undersøgelser har vist fald i det GABAergiske maskineri, herunder ændringer i GABA-receptorunderenheder, GABA-transporteren (Rotschafer et al., 2015) og glutaminsyre-decarboxylase (GAD; D’Hulst og Kooy, 2007; Olmos-Serrano et al., 2010). Mere specifikt er mRNA-niveauer for det gen, der koder for delta-underenheden af GABAA-receptorunderenheden – specifik for den ekstrasynaptiske population af receptorer – blevet rapporteret at være reduceret (Gantois et al., 2006). Med hensyn til GABAergisk funktion blev frigivelsen af synaptisk GABA reduceret, og den fasiske og toniske hæmning blev mindsket i amygdala (Olmos-Serrano et al., 2010).
Med hensyn til adfærd er hyperaktivitet, auditiv startle og indlæring og hukommelse observeret i FX-mus blevet korreleret med tabet af hæmmende tone fra GABAergiske input i cerebellum og amygdala (Olmos-Serrano et al, 2010), to hjerneområder, der også er forbundet med menneskelig FXS (Lightbody og Reiss, 2009; Hall et al, 2013).
Mere kritisk er det, at selektiv potentiering af delta-underenhedsholdige ekstrasynaptiske GABAA-receptorer (dSEGA’er) med gaboxadol, også kendt som OV101 og 4,5,6,7-tetrahydroisoxazolo(5,4-c)pyridin-3-ol (THIP), normaliserede aberrant hyperaktivitet og auditive startle-reaktioner i Fmr1 KO-musene (Olmos-Serrano et al., 2010). Det er vigtigt, at disse resultater blev observeret ved eksponeringer svarende til dem, hvor gaboxadol er godt tolereret hos mennesker (Meera et al., 2011).
Da de første kliniske forsøg endnu ikke har vist nogen terapeutisk fordel af mGluR5-hæmmere (Scharf et al., 2015), søgte vi i den nuværende undersøgelse at udforske tilgange, der mere direkte kunne informere en klinisk plan, herunder bredere aspekter af FXS-fænototypen, der ikke tidligere er rapporteret. Specifikt undersøgte vi her virkningerne af forskellige doser gaboxadol på hyperaktivitet, angst, aggression og repetitiv adfærd i Fmr1 KO2-modellen af FXS, hvilket demonstrerer gaboxadols effektivitetspotentiale til behandling af disse FXS-symptomer.
Materialer og metoder
Dyr og opstaldning
Fmr1 KO2-mus, der tidligere er genereret ved sletning af promotoren og første exon af Fmr1, hvilket resulterer i mRNA- og protein-nul-mus (Mientjes et al, 2006), blev anvendt til alle eksperimenter. Floxed Fmr1-mus blev parret med mus, der udtrykker en tidlig ubiquitært udtrykt Cre-recombinase, hvilket resulterede i eliminering af Fmr1 fra alle celler. KO-mus blev tilbagekrydset i mindst otte generationer med C57BL/6J, og vildtype-kærester (WT) blev anvendt som kontrol. Ti mus (hanner, 2 måneder gamle) blev anvendt til hver behandlingsgruppe i alle adfærdseksperimenter. Heterozygote avlspar blev anvendt til at generere WT- og KO-kuldkammerater til alle undersøgelser. Hanner blev fjernet fra avlsburene efter fødslen, hunnerne blev frasorteret fra kuldet, og genotypning blev udført ved hjælp af TransnetXY Automated Genotyping (Transnetyx, Inc., Cordova, TN, USA) ved hjælp af etablerede primere og protokol. Mus i det samme bur blev injiceret med den samme dosis gaboxadol eller vehikel, og mutanter og kontroller blev anbragt separat. Alle mus blev opstaldet i grupper i plastikbure (35 × 30 × 12 cm), fem pr. bur, og de blev vænnet til dyreanlægget i mindst en uge før testning. Rumtemperaturen (21 ± 2 °C), den relative luftfugtighed (55 ± 5 %), en 12 timers lys/mørke-cyklus (lyset tændt kl. 7.00-7.00) og luftskiftet (16 gange i timen) blev automatisk kontrolleret. Alle musene havde ad libitum adgang til mad og vand. Alle forsøg blev udført i lysfasen af en forsøgsleder, der var blind for genotype og lægemiddelbehandling. Husning og eksperimenter fandt sted hos GeN DDI Limited (London, UK) i overensstemmelse med kravene i den britiske lov om dyr (videnskabelige procedurer) fra 1986.
Gaboxadol-behandling og eksperimentel tidslinje
Fmr1 KO2-mus blev injiceret med vehikel (0.9% steril saltvand) eller gaboxadol (0.5, 1, 1, 1.5, 2, 3, 4 eller 5 mg/kg, i.p.) 30 min før adfærdstestning på hver testdag med et tre-dages interval mellem hver test for at undgå enhver kumulativ virkning af lægemiddeladministrationen. Wild-type mus, der blev injiceret med vehikel på samme tidspunkt, blev også inkluderet i alle eksperimenter. Adfærdsmæssig screening af musene (n = 10 pr. gruppe) blev udført i følgende rækkefølge med 2-3 dage mellem hver test: Open Field Test (OFT; dag 1), successive gyder (dag 4), lys/mørk kasse (dag 7), sociale test og aggression (dag 10) og selvpleje og stereotypi (dag 12).
Open Field Test (OFT)
På testdag 1 blev OFT udført i et VersaMax aktivitetsmonitorkammer (AccuScan Instruments, Columbus, OH, USA). Lokomotorisk aktivitet blev registreret i 30 minutter i et stort plexiglaskammer (40 × 40 cm) belyst med 40-lux. Aktiviteten blev overvåget ved infrarøde stråleafbrydelser, der blev kombineret i 1-min-bins og afkodet ved hjælp af VersaDat-software (AccuScan Instruments, Columbus, OH, USA) for at bestemme den tilbagelagte afstand (cm), den tilbagelagte midterafstand (cm), omdrejninger med og mod uret (på mindst 5.08 cm i diameter) og gentagne strålebrud.
Successive Alleys Test (SAT)
På testdag 4 blev musene underkastet den successive alleys test (SAT). SAT har en fordel i forhold til den forhøjede plus labyrint, da den sætter en bredere vifte af angstniveauer i bås (Deacon, 2013). Testkammeret bestod af fire på hinanden følgende, lineært arrangerede, i stigende grad anxiogene (lysere farve, lavere vægge, smallere) gyder, der var 25 cm lange og 50 cm høje fra jorden. Mus blev observeret i løbet af en 5-minutters periode under et 60-W rødt lys placeret over apparatet. Antallet af indgange i hver gyde blev registreret.
Light-Dark Exploration Test (LDT)
På testdag 7 gennemgik musene en lys/mørke-udforskningstest (LDT). LDT anvendes i vid udstrækning til at måle angstlignende adfærd hos mus baseret på deres medfødte frygt for lyse, åbne rum (Prut og Belzung, 2003). Testkammeret i polypropylen (44 × 21 × 21 cm) blev opdelt i et mindre, mørkt, dækket rum (14 cm) og et større, lyst oplyst, åbent rum (28 cm) ved hjælp af en mørk skillevæg med en lille åbning (13 × 5 cm). Overgangene mellem rummene blev registreret af fotoceller, der var placeret i skillevæggenes åbning. Hver mus blev placeret i den lyse side, der vender væk fra skillevæggen, fik lov til frit at udforske kammeret i 10 min, og overgange mellem kamre blev registreret.
Social interaktion (SI), aggressiv adfærd
På testdag 10 blev social interaktion (SI) og aggressionstest udført i et bur af samme størrelse som hjemmeburet (40 × 23 × 12 cm) med et plexiglaslåg for at lette visning af musene. Musene blev vænnet til testrummet i 25 min. To forsøgspersoner, en forsøgsmus og en vild-type “test”-mus, blev derefter anbragt i testburet samtidig. Den samlede varighed og antallet af sociale undersøgelser, hale raslen, antallet af bid og antallet af mounts blev registreret ovenfra og målt i 3 min.
Stereotypi
På testdag 12 blev hastigheden af spontan stereotypi (hovedbevægelser) vurderet ved hjælp af et modificeret automatiseret fotocelleapparat (Columbus Instruments, Columbus, OH, USA). Testprotokollen omfattede fjernelse af musene fra deres hjemmebure og anbringelse af dem enkeltvis i testbure af plexiglas (22 × 25 × 28 cm). Musene blev efterladt uforstyrret i 2 minutter for at vænne sig til testkammeret. Derefter blev hver mus overvåget i 3 min. for at generere en stereotypi-score, der svarer til den gennemsnitlige stereotypihyppighed pr. time. Der blev givet mad og vand i hele testperioden. Stereotypi-tallet er en kvantificering af det antal gange, en mus forstyrrer den samme infrarøde stråle i et anfald af stereotypisk aktivitet som målt af testapparatet.
Selvplejning
Også på testdag 12 blev selvplejning overvåget. Hver mus blev anbragt individuelt i et standardmusebur (46 × 23,5 × 20 cm) belyst ved 40-lux. Efter en 5-minutters tilvænningsperiode i testburet blev den kumulative tid, der blev brugt til grooming af ethvert kropsområde, registreret i 3 min for at bestemme den kumulative tid (i sekunder) til grooming af ethvert kropsområde.
Statistisk analyse
Da Fmr1 KO2-mus blev behandlet med gaboxadol eller køretøj, men WT-mus blev kun behandlet med køretøj, blev parametriske data analyseret ved hjælp af envejs variansanalyse (ANOVA) og Tukey’s post hoc-test. Alle data blev analyseret ved hjælp af GraphPad Prism v7.0 (GraphPad Software, San Diego, CA, USA). Statistisk signifikans blev sat ved P < 0.05.
Resultater
Gaboxadol normaliserer hyperaktivitet observeret i Fmr1 KO2-mus
Hyperaktivitet er et fremtrædende træk ved menneskelig FXS (Bailey et al, 2008; Wheeler et al., 2014; Hagerman et al., 2017) og er blevet pålideligt reproduceret i den tidligere karakteriserede hollandsk-belgiske Fmr1 KO-mus (Olmos-Serrano et al., 2010; Kazdoba et al., 2014). For at teste, om Fmr1 KO2-musene viste lokomotorisk hyperaktivitet, og om gaboxadol kunne normalisere denne afvigende adfærd, blev Fmr1 KO2-musene injiceret med vehikel eller gaboxadol (0.5-5 mg/kg, i.p.), og WT-kuldkammerater blev injiceret med vehikel 30 min før testning i OFT. Den samlede tilbagelagte distance (cm) i OFT blev registreret i 30 min. Resultaterne viste, at den afstand, der blev tilbagelagt af Fmr1 KO2-mus, var signifikant forøget sammenlignet med WT-kuldkammeraternes kontroller (figur 1, F(8,81) = 21.27, p < 0.0001), hvilket er i overensstemmelse med resultater fra andre modeller af FXS. Behandling med gaboxadol (0.5 mg/kg) normaliserede den afstand, der blev tilbagelagt af Fmr1 KO2-mus til WT-aktivitetsniveauer (Figur 1). Højere doser gaboxadol (1-5 mg/kg, i.p.) havde ingen effekt på lokomotorisk aktivitet hos Fmr1 KO2-mus (Figur 1). Disse resultater kunne ikke tilskrives sedative virkninger af gaboxadol, fordi i WT C57Bl/6- eller BALB/c-mus har gaboxadol-doser op til 2,0 mg/kg, i.p. ingen virkning på lokomotorisk aktivitet i en 60 minutters OFT (data ikke vist), hvilket er i overensstemmelse med tidligere arbejde, der viser ingen virkning af gaboxadol på lokomotion i WT-mus (Olmos-Serrano et al, 2011) eller rotter (Silverman et al., 2016).
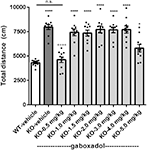
Figur 1. Gaboxadol normaliserer hyperaktivitet i Fmr1 KO2-mus. Samlet tilbagelagt distance i 30 min for wild-type-littermates (WT) mus behandlet med vehikel (hvid søjle), Fmr1 KO2-mus behandlet med vehikel (knockout, KO mørkegrå søjle) og Fmr1 KO2-mus behandlet med gaboxadol (KO-0,5-5,0 mg/kg, lysegrå søjler). Stænger er gennemsnit ± SEM, prikker er rådata fra individuelle mus. *p < 0,05, ****p < 0,0001 vs. WT-køretøjsgruppe; ns, ikke signifikant vs. WT-køretøjsgruppe; ++++p < 0,0001 vs. Fmr1 KO2-køretøjsgruppe. N = 10 pr. gruppe.
Angstlignende adfærd i Fmr1 KO2-mus normaliseres af Gaboxadol
For at vurdere effekten af gaboxadol på angstlignende adfærd i Fmr1 KO2-musene blev der anvendt tre forskellige adfærdstests: centerafstand tilbagelagt i OFT, LDT og SAT. Øget afstand tilbagelagt i centrum fortolkes som mindsket angst og udnytter musenes iboende præference for at blive i perimeteren, når de introduceres til et nyt miljø. Fmr1 KO2-mus blev injiceret med gaboxadol (0,5-5 mg/kg, i.p.), og WT-kuldkammerater blev injiceret med vehikel 30 minutter før de blev anbragt i OFT i 30 minutter. Den samlede afstand, der blev tilbagelagt i centrum, var signifikant forøget hos Fmr1 KO2-musene sammenlignet med WT-kontroller (Figur 2A, F(8,81) = 21,32, p < 0,0001). Behandling med gaboxadol (0,5 mg/kg, i.p.) normaliserede effekten af Fmr1 KO2 på den tilbagelagte afstand i centrum til niveauer, der var sammenlignelige med WT-kontroller (Figur 2A). Højere doser gaboxadol (1-5 mg/kg) havde ingen effekt på Fmr1 KO2-mus i denne test (Figur 2A).
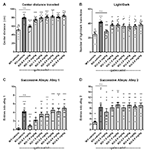
Figur 2. Gaboxadol normaliserer angstrelateret adfærd hos Fmr1 KO2-mus. WT-mus behandlet med vehikel (hvid søjle), Fmr1 KO2-mus behandlet med vehikel (KO, mørkegrå søjle) eller Fmr1 KO2-mus behandlet med gaboxadol (KO-0,5-5,0 mg/kg, lysegrå søjler) blev udsat for test i åbent felt (OFT), lys/mørkeudforskningstest (LDT) og successive alleys-test (SAT). (A) Samlet distance tilbagelagt i midten af OFT. (B) Antallet af overgange mellem lyse og mørke rum i LDT. (C) Antallet af indgange til gyde 1 under SAT-testen. (D) Antallet af indgange til gyde 2 i løbet af SAT’en. Søjlerne er gennemsnit ± SEM, prikkerne er rådata fra individuelle mus. ****p < 0,0001, ***p < 0,001, **p < 0,01, *p < 0,05 vs. WT-køretøjsgruppe; ns, ikke signifikant vs. WT-køretøjsgruppe; ++++p < 0,0001, +++p < 0,001, ++p < 0,01 vs. Fmr1 KO2-køretøjsgruppe. N = 10 pr. gruppe.
Næst blev LDT, som udnytter musenes naturlige præference for mørke, beskyttede miljøer, anvendt som en anden adfærdsmæssig test for angst. Villighed til at udforske det lyse rum i kammeret, målt ved antallet af overgange mellem rummene, fortolkes som anxiolytisk adfærd og er følsom over for behandling med anxiolytiske midler (Bourin og Hascoët, 2003). Fmr1 KO2-mus viste et signifikant øget antal overgange mellem kamre i LDT sammenlignet med WT-mus (Figur 2B, F(8,81) = 5.819, p < 0.0001). Gaboxadol (0.5 mg/kg, i.p.) normaliserede adfærdsfænotypen af Fmr1 KO2-musene til WT-niveauer (Figur 2B). Højere doser gaboxadol havde ingen effekt på lys/mørke-overgangene hos Fmr1 KO2-musene (Figur 2B).
Endeligt forstærkede resultaterne fra SAT, at den angstrelaterede fænotype observeret hos Fmr1 KO2-musene kunne normaliseres ved gaboxadolbehandling. Denne test anvendes som en mere følsom variant af Elevated Plus Maze og består af fire lineære, på hinanden følgende, i stigende grad angstfremkaldende gyder (Deacon, 2013). Antallet af indgange i gyde 2-4 vurderer angstadfærd (Deacon, 2013), mens øgede indgange i gyde 1 er i overensstemmelse med generel hyperaktivitet (Deacon, 2013). Det er vigtigt, at tidligere arbejde har vist, at lokomotorisk hyperaktivitet ikke fører til falske positive resultater i denne test (gennemgået i Deacon, 2013). Fmr1 KO2-mus viste et øget antal indgange i gyde 1 (Figur 2C, F(8,81) = 11.50, p < 0.0001), hvilket er i overensstemmelse med øget lokomotorisk aktivitet og den hyperaktivitetsfænotype, der er vist i Figur 1. Fmr1 KO2-mus viste også et signifikant øget antal indgange i gyde 2 sammenlignet med WT-kontroller (Figur 2D, F(8,81) = 4.925, p < 0.0001), hvilket understøtter en angstrelateret fænotype. Injektion af gaboxadol (0.5 mg/kg) i Fmr1 KO2-mus 30 min før testning normaliserede indgange i gyde 1 og 2 til niveauet for WT-kontroller (figur 2C,D). Højere doser gaboxadol havde ingen virkning på Fmr1 KO2-musene i SAT (figurer 2C,D). Indgange i Alleys 3 og 4 var signifikant forøget i Fmr1 KO2-mus i forhold til WT-kontroller, men der blev ikke set nogen åbenlys fordel af gaboxadol med nogen af de testede doser (ikke vist).
Irritabilitet og aggressiv adfærd i Fmr1 KO2-mus normaliseres af Gaboxadol
Som med andre former for syndromisk autisme viser en stor del af individer med FXS irritabilitet, social angst og aggression. Disse afvigende adfærd kan modelleres i gnavere gennem karakterisering af SIs mellem en testmus og en ny burkammerat. For at teste hypotesen om, at irritabilitet og aggression var øget i Fmr1 KO2-mutanter, kvantificerede vi forekomster af hale-raslende, bidende adfærd, monteringsadfærd og latenstid til angreb. Mus blev injiceret med vehikel eller gaboxadol (0,5-5 mg/kg, i.p.) 30 min. før de blev anbragt i testburet.
Hale raslende, eller hurtige vibrationer af halen, afspejler aggressivitet og kamptendens. Fmr1 KO2-mus viste signifikant øget hyppighed af halerasslering sammenlignet med WT-kontroller (Figur 3A, F(8,81) = 16,03, p < 0,0001). Gaboxadol (0,5, 1,5 og 5,0 mg/kg) normaliserede effekten i Fmr1 KO2-mus til niveauer, der var sammenlignelige med WT-kontroller (Figur 3A).
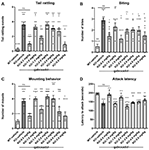
Figur 3. Gaboxadol normaliserer irritabilitet og aggressionsadfærd hos Fmr1 KO2-mus. Hale-raslende (A), bidende adfærd (B), monteringsadfærd (C) og latenstid til at angribe en ny burkammerat (D) blev målt i WT-mus behandlet med vehikel (hvid søjle), Fmr1 KO2-mus behandlet med vehikel (KO, mørkegrå søjle) eller Fmr1 KO2-mus behandlet med gaboxadol (KO-0,5-5,0 mg/kg, lysegrå søjler). Stænger er gennemsnit ± SEM, prikker er rådata fra individuelle mus. ****p < 0,0001,***p < 0,001,**p < 0,01, *p < 0,05 vs. WT-køretøjsgruppe; ns, ikke signifikant vs. WT-køretøjsgruppe; ++++p < 0,0001, +++p < 0,001, ++p < 0,01, ++p < 0,05 vs. Fmr1 KO2-køretøjsgruppe. N = 10 pr. gruppe.
Ligesom hale rasleri er bidning et mål for aggression hos mus. Fmr1 KO2-mus viste et signifikant øget antal bid sammenlignet med WT-kontroller (Figur 3B, F(8,81) = 5.446, p < 0.0001). Gaboxadol (0,5, 1,5 og 5,0 mg/kg) mindskede signifikant antallet af bid fra Fmr1 KO2-musene (Figur 3B). Ved nogle af de testede doser (1,0, 3,0 og 4,0 mg/kg) forblev bidende adfærd imidlertid signifikant forøget sammenlignet med WT-musgrupper og blev ikke ændret signifikant sammenlignet med KO-muskontrollerne (Figur 3B).
I hanmus er monteringsadfærd en aggressiv bekræftelse af social dominans. Fmr1 KO2-mus viste et signifikant øget antal monteringer sammenlignet med WT-kontroller (Figur 3C, F(8,81) = 9,008, p < 0,001). Behandling med gaboxadol (0,5, 1,5, 4,0 og 5,0 mg/kg) mindskede signifikant monteringsadfærd hos Fmr1 KO2-musene, og virkningerne af 0,5 og 5,0 mg/kg-doserne var statistisk signifikante sammenlignet med KO-vejlederbehandlede kontroller (Figur 3C). I Fmr1 KO2-mus, der blev behandlet med 1,5 og 4,0 mg/kg gaboxadol, adskilte monteringsadfærd sig ikke signifikant fra WT-køretøjsbehandlede mus, hvilket tyder på en tendens til en effekt ved disse doser, selv om deres sammenligning med den KO-køretøjsbehandlede gruppe ikke nåede statistisk signifikans (Figur 3C).
Sluttelig blev latenstiden til at angribe en nyligt mødt mus registreret som et andet mål for aggression. Fmr1 KO2-mus viste en signifikant nedsat latenstid til at angribe sammenlignet med WT-kuldkammerater (Figur 3D, F(8,81) = 17,22, p < 0,0001). Den reducerede latenstid til angreb blev normaliseret i Fmr1 KO2-mus behandlet med gaboxadol (0.5, 1.5 mg/kg; Figur 3D).
Gaboxadol normaliserer gentagende adfærd i Fmr1 KO2-mus
Perseveration og gentagende adfærd er almindelig hos personer med FXS og er meget forstyrrende (Arron et al., 2011; Leekam et al., 2011; Hall et al., 2016). For at teste hypotesen om, at sådanne træk kan observeres i Fmr1 KO2-dyr, kvantificerede vi cirkling, selvpleje og stereotypi i WT- og Fmr1 KO2-mutantmus. Omdrejninger mod uret (CCW) blev målt i testkammeret, efter at musene blev injiceret med vehikel eller gaboxadol (0.5-5 mg/kg, i.p.). Fmr1 KO2-mus viste signifikant øgede CCW-omdrejninger i løbet af 5 minutters test sammenlignet med WT-kontroller (figur 4A, F(8,81) = 25.46, p < 0.0001). Injektion af gaboxadol (0,5, 1,0 mg/kg) i Fmr1 KO2-mus genoprettede antallet af CCW-omdrejninger til WT-niveau (Figur 4A). Der var ingen effekt af genotype på kredsløb med uret (p = 0,386, data ikke vist).

Figur 4. Gaboxadol normaliserer repetitiv adfærd hos Fmr1 KO2-mus. WT-mus behandlet med vehikel (hvid søjle), Fmr1 KO2-mus behandlet med vehikel (KO, mørkegrå søjle) eller Fmr1 KO2-mus behandlet med gaboxadol (KO-0,5-5,0 mg/kg, lysegrå søjler) blev udsat for fire test, der måler repetitiv adfærd. (A) Omdrejninger mod uret (CCW) blev målt ved infrarøde strålebrydninger under en 5-min test i det åbne felt. (B) Efter 5 minutters tilvænning til testburet vises den tid, der blev brugt på at pudse i 3 min. (C) Tællinger af stereotypi (hovedbobling hændelser) i løbet af en 3-min testperiode er vist. Søjler er gennemsnit ± SEM, prikker er rå data fra individuelle mus. ****p < 0.0001 vs. WT-køretøjsgruppe; ns, ikke signifikant vs. WT-køretøjsgruppe; ++++p < 0.0001 vs. Fmr1 KO2-køretøjsgruppe. N = 10 pr. gruppe.
Den tid, der blev brugt på at pleje, var signifikant forøget hos Fmr1 KO2-musene sammenlignet med WT-kontroller (Figur 4B, F(8,81) = 41,99, p < 0,0001). I Fmr1 KO2-mus normaliserede gaboxadolinjektion (0.5 mg/kg) den tid, der blev brugt på grooming, til WT-niveauer (Figur 4B).
Stereotypi er defineret som repetitive og rituelle bevægelser og er almindeligt forekommende i autisme og FXS. Hos mus kan stereotypiske aktiviteter såsom hovedbobning måles ved at kvantificere infrarøde strålebrud i testburet. Stereotypietællinger var signifikant forøget i Fmr1 KO2-mus sammenlignet med WT-kontroller (Figur 4C, F(8,81) = 19.93, p < 0.0001). Fmr1 KO2-mus injiceret med gaboxadol (0.5 mg/kg) havde normaliseret stereotypiadfærd tilbage til WT-niveauer (Figur 4C).
Diskussion
Kliniske symptomer på FXS kan omfatte hyperaktivitet, angst, hukommelses- og indlæringsmangler, sociale abnormiteter, aggression og repetitiv adfærd. I alle tilfælde genoprettede behandling med 0,5 mg/kg gaboxadol Fmr1 KO2-musenes adfærd til WT-niveau (opsummeret i figur 5). Disse data giver yderligere støtte til forøgelse af dSEGA-aktivitet og tonisk hæmning af gaboxadol som en terapeutisk strategi, der berettiger yderligere undersøgelse hos personer med FXS.

Figur 5. Samlede adfærdsmæssige virkninger af gaboxadol i Fmr1 KO2-mus. Sammenfatning af resultaterne af adfærdsvurdering af Fmr1 KO2-mus, der er behandlet med vehikel eller gaboxadol (0,5-5,0 mg/kg) sammenlignet med WT-kuldkammerat-kontroller. Fmr1 KO2-musene viste signifikante fænotyper i lokomotorisk aktivitet, angstrelateret adfærd, irritabilitet og aggression samt repetitiv adfærd. Alle disse fænotyper blev konsekvent normaliseret til WT-niveauer ved behandling med gaboxadol i dosis på 0,5 mg/kg. “Normal” adfærd (grønne firkanter) er i overensstemmelse med WT-køretøjsbehandlede mus og er statistisk forskellig fra Fmr1 KO2 (KO) køretøjsbehandlede mus. “Unormal” adfærd (røde firkanter) er i overensstemmelse med Fmr1 KO2 (KO) køretøjsbehandlede mus og er statistisk forskellig fra WT køretøjsbehandlede mus. Gule firkanter angiver en forskel, der enten ikke er signifikant forskellig fra WT-mus eller statistisk forskellig fra Fmr1 KO2 (KO) køretøjsbehandlede mus.
Lokomotorisk hyperaktivitet er et træk ved menneskelig FXS (Bailey et al., 2008; Wheeler et al., 2014; Hagerman et al., 2017). I den aktuelle undersøgelse viste Fmr1 KO2-mus øget lokomotorisk aktivitet, der blev normaliseret af gaboxadol. Tidligere arbejde i de hollandsk-belgiske Fmr1 KO-mus har også vist en konsistent hyperaktivitetsfænotype, der blev vendt med gaboxadolbehandling, dog ved en højere dosis (Olmos-Serrano et al., 2011). Potentielle forklaringer på denne forskel omfatter: differentiel regulering af Gabrd mRNA (D’Hulst et al., 2006; Curia et al., 2009), ændret overfladeekspression af ekstrasynaptiske GABA-receptorer (Zhang et al., 2017), virkninger på hjernestruktur (Lai et al., 2016) eller forskelle i de adfærdsmæssige manifestationer af mutationen (Pietropaolo et al., 2011; Spencer et al., 2011). Hver kunne være medieret af resultatet af den genetiske baggrund, da tidligere arbejde blev udført ved hjælp af FVB-mus, mens dyrene, der blev undersøgt her, var C57BL/6J. Subtile forskelle i laboratorieudstyr, dyrehåndtering og endda boligforhold, som er veletablerede modifikatorer af museadfærd, kan også bidrage (Crabbe et al., 1999; Wahlsten et al., 2006).
Resultaterne fra tre angsttests, centerafstand i OFT, lys/mørk kasse og SAT, viser en robust fænotype i Fmr1 KO2-musen, der omvendes ved behandling med gaboxadol. Det skal bemærkes, at hyperaktivitet kan forvirre OFT- og lys/mørk boksresultaterne. Imidlertid forekommer angstrelateret adfærd observeret i SAT uafhængigt af lokomotoriske aktivitetsændringer (gennemgået i Deacon, 2013); og mens den angstrelaterede effekt i KO er i modsat retning af det, der observeres hos patienter med FXS (Bailey et al., 2008), er vores resultater i overensstemmelse med tidligere rapporter, der beskriver FXS-musens fænotype (gennemgået af Kazdoba et al., 2014). Ikke desto mindre vil det være vigtigt, at fremtidige undersøgelser sigter mod yderligere at belyse angsteffekten i disse mus. På trods af dette og især viser vores data, at gaboxadol normaliserer den afvigende angstadfærd observeret i FXS-musemodellen såvel som i alle de andre adfærd vurderet i vores analyser.
Irritabilitet og aggressiv adfærd, modelleret ved at måle SIs med en ny burkammerat, blev også øget i Fmr1 KO2-musene og vendt af gaboxadol. En nylig undersøgelse rapporterede, at næsten alle (>90%) hanner og hunner med FXS, der blev undersøgt, var involveret i en vis aggression i de foregående 12 måneder. Blandt dem viste 33% af hannerne og 20% af hunnerne alvorlig aggression, nok til at forårsage skade på plejepersonale (Wheeler et al., 2016). Selvskadende og impulsiv adfærd er også mere udbredt hos personer med FXS (Arron et al., 2011).
Repetitiv adfærd og stereotypi blev konsekvent øget i Fmr1 KO2-mus og lindret af gaboxadolbehandling. Gentagende adfærd kan forårsage alvorlige problemer for daglig funktion og kan blive en barriere for indlæring og SI (Leekam et al., 2011). Paradigmer, der vurderer stereotyp adfærd og socioemotionelle underskud, kan således være nyttige til at vurdere nye lægemidler for deres effektivitet til at forbedre de autistiske fænotyper i FXS.
Gaboxadol normaliserede alle de testede adfærdsmæssige underskud hos Fmr1 KO2-mus ved en dosis på 0,5 mg/kg. Mens højere doser også normaliserede irritabilitet og aggressiv adfærd, blev dette ikke observeret for andre adfærdsdomæner, der blev evalueret. En forklaring på det noget smalle virkningsvindue, der blev observeret her, kan komme fra tidligere arbejde, der viser kompromitteret informationsbehandling ved enten utilstrækkelig eller overskydende tonisk hæmning, den fysiologiske proces, som gaboxadol potenserer. Under denne model ville den adfærdsmæssige fordel af lægemidlet ved høje doser blive opvejet af farmakologisk introducerede FXS-uafhængige underskud (Duguid et al., 2012).
Vores resultater giver robuste beviser for den potentielle fordel af gaboxadol med hensyn til at vende ASD-relateret adfærd, aggression og socialitet. Samlet set støtter disse resultater hypotesen om, at potentiering af ekstrasynaptiske GABAA-receptorer med gaboxadol kan være til gavn for personer med FXS. Konklusionen er, at disse data støtter den fremtidige evaluering af gaboxadol hos personer med FXS, især med hensyn til symptomer på hyperaktivitet, angst, ASD-relateret stereotypi, omgængelighed, irritabilitet, aggression og kognition.
Ethisk erklæring
Alle eksperimenter blev udført under godkendelse af Institute of Ecology and Biodiversity Ethical Committee, University of Chile, Santiago, Chile.
Author Contributions
BA og MD tog initiativ til dette arbejde og arbejdede sammen med PC og RD for at udvikle en eksperimentel plan. PC og RD skrev en teknisk rapport med en sammenfatning af resultaterne, som JW-S brugte til at udarbejde et manuskript, der var klar til offentliggørelse. MvS bidrog ligesom de andre forfattere til fortolkningen af resultaterne. Alle forfattere gav feedback på manuskriptet inden indsendelse.
Funding
Denne undersøgelse blev sponsoreret og betalt fuldt ud af Ovid Therapeutics Inc., New York, NY, USA.
Interessekonflikterklæring
PC og RD er stifter/CEO og CSO for Gen. DDI Limited, som blev hyret af Ovid Therapeutics til at udføre det eksperimentelle arbejde, der er beskrevet her. PC og RD er i øjeblikket leder af og medlem af teamet for FRAXA-DVI. JW-S er gennem NeuroJenic Consulting, LLC, blevet hyret til at udarbejde dette manuskript til offentliggørelse. MvS, BA og MD er fuldtidsansatte hos Ovid Therapeutics og har også enten aktier eller aktieoptioner.
Arron, K., Oliver, C., Moss, J., Berg, K., og Burbidge, C. (2011). Prævalensen og fænomenologien af selvskadende og aggressiv adfærd i genetiske syndromer. J. Intellect. Disabil. Res. 55, 109-120. doi: 10.1111/j.1365-2788.2010.01337.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Auerbach, B. D., og Bear, M. F. (2010). Tab af det skrøbelige X mental retardationsprotein afkobler metabotropisk glutamatreceptorafhængig priming af langtidspotentiering fra proteinsyntese. J. Neurophysiol. 104, 1047-1051. doi: 10.1152/jn.00449.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Bailey, D. B. Jr., Raspa, M., Olmsted, M., og Holiday, D. B. (2008). Sammenhængende tilstande forbundet med FMR1-genvariationer: resultater fra en national forældreundersøgelse. Am. J. Med. Genet. A 146A, 2060-2069. doi: 10.1002/ajmg.a.32439
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassell, G. J., og Warren, S. T. (2008). Fragilt X-syndrom: tab af lokal mRNA-regulering ændrer synaptisk udvikling og funktion. Neuron 60, 201-214. doi: 10.1016/j.neuron.2008.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourin, M., and Hascoët, M. (2003). Musens lys/mørkekassetest. Eur. J. Pharmacol. 463, 55-65. doi: 10.1016/s0014-2999(03)01274-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, G. R., Li, X. Y., Xiang, Y. D., Liu, D., McClintock, S. M., og Zeng, Y. (2017). Implikationen af AMPA-receptor i synaptisk plasticitetsforringelse og intellektuel funktionsnedsættelse i fragilt X-syndrom. Physiol. Res. 66, 715-727.
PubMed Abstract | Google Scholar
Crabbe, J. C., Wahlsten, D., og Dudek, B. C. (1999). Genetik af museadfærd: interaktioner med laboratoriemiljøet. Science 284, 1670-1672. doi: 10.1126/science.284.5420.1670
PubMed Abstract | CrossRef Full Text | Google Scholar
Curia, G., Papouin, T., Séguéla, P., og Avoli, M. (2009). Nedregulering af tonisk GABAergisk hæmning i en musemodel af fragilt X-syndrom. Cereb. Cortex 19, 1515-1520. doi: 10.1093/cercor/bhn159
PubMed Abstract | CrossRef Full Text | Google Scholar
Dahlhaus, R. (2018). Af mænd og mus: modellering af det skrøbelige X-syndrom. Front. Mol. Neurosci. 11:41. doi: 10.3389/fnmol.2018.00041
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M. (2013). Den successive alleys test af angst i mus og rotter. J. Vis. Exp. 76:e2705. doi: 10.3791/2705
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M., Glass, L., Snape, M., Hurley, M. J., Altimiras, F. J., Biekofsky, R. R., et al. (2015). NNZ-2566, en ny analog af (1-3) IGF-1, som et potentielt terapeutisk middel til fragilt X-syndrom. Neuromolekylær Med. 17, 71-82. doi: 10.1007/s12017-015-8341-2
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., De Geest, N., Reeve, S. P., Van Dam, D., De De Deyn, P. P. P., Hassan, B. A., et al. (2006). Nedsat ekspression af GABAA-receptoren ved fragilt X-syndrom. Brain Res. 1121, 238-245. doi: 10.1016/j.brainres.2006.08.115
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., Heulens, I., Van der Aa, N., Goffin, K., Koole, M., Porke, K., et al. (2015). Positronemissionstomografi (PET) kvantificering af GABAA-receptorer i hjernen hos skrøbelige X-patienter. PLoS One 10:e010131486. doi: 10.1371/journal.pone.0131486
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., og Kooy, R. F. (2007). GABAA-receptoren: et nyt mål for behandling af skrøbelig X? Trends Neurosci. 30, 425-431. doi: 10.1016/j.tins.2007.06.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Dölen, G., Osterweil, E., Rao, B. S., Smith, G. B., Auerbach, B. D., Chattarji, S., et al. (2007). Korrektion af fragilt X-syndrom i mus. Neuron 56, 955-962. doi: 10.1016/j.neuron.2007.12.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Duguid, I., Branco, T., London, M., Chadderton, P., og Hausser, M. (2012). Tonisk hæmning forbedrer troværdigheden af sensorisk informationsoverførsel i den cerebellære cortex. J. Neurosci. 32, 11132-11143. doi: 10.1523/jneurosci.0460-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Gantois, I., Vandesompele, J., Speleman, F., Reyniers, E., D’Hooge, R., Severijnen, L. A., et al. (2006). Ekspressionsprofilering tyder på underekspression af GABAA-receptorunderenheden delta i den skrøbelige X knockout-musemodel. Neurobiol. Dis. 21, 346-357. doi: 10.1016/j.nbd.2005.07.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Gaudissard, J., Ginger, M., Premoli, M., Memo, M., Frick, A., and Pietropaolo, S. (2017). Adfærdsmæssige abnormiteter i Fmr1-KO2 musemodellen af fragilt X-syndrom: relevansen af tidlige livsfaser. Autism Res. 10, 1584-1596. doi: 10.1002/aur.1814
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, C., Hoffmann, A., Bassell, G. J., og Berry-Kravis, E. M. (2015). Terapeutiske strategier for fragilt X-syndrom: fra bænk til sengekant og tilbage. Neurotherapeutics 12, 584-608. doi: 10.1007/s13311-015-0355-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R. J., Berry-Kravis, E., Hazlett, H. C., Bailey, D. B. Jr., Moine, H., Kooy, R. F., et al. (2017). Fragilt X-syndrom. Nat. Rev. Dis. Primers 3:17065. doi: 10.1038/nrdp.2017.65
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R., Hoem, G., og Hagerman, P. (2010). Fragilt X og autisme: sammenflettet på det molekylære niveau, der fører til målrettede behandlinger. Mol. Autism 1:12. doi: 10.1186/2040-2392-1-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Barnett, R. P., og Hustyi, K. M. (2016). Problematisk adfærd hos ungdomsdrenge med skrøbeligt X-syndrom: relativ prævalens, hyppighed og sværhedsgrad. J. Intellect. Disabil. Res. 60, 1189-1199. doi: 10.1111/jir.12341
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Jiang, H., Reiss, A. L., og Greicius, M. D. (2013). Identificering af storskala hjernenetværk i skrøbeligt X-syndrom. JAMA Psychiatry 70, 1215-1223. doi: 10.1001/jamapsychiatry.2013.247
PubMed Abstract | CrossRef Full Text | Google Scholar
Kazdoba, T. M., Leach, P. T., Silverman, J. L., og Crawley, J. N. (2014). Modellering af skrøbeligt X-syndrom i Fmr1 knockout musen. Intractable Rare Dis. Res. 3, 118-133. doi: 10.5582/irdr.2014.01024
PubMed Abstract | CrossRef Full Text | Google Scholar
Lai, J. K., Lerch, J. P., Doering, L. C., Foster, J. A., og Ellegood, J. (2016). Regionale hjernevolumener ændringer i voksne han FMR1-KO mus på FVB-stammen. Neuroscience 318, 12-21. doi: 10.1016/j.neuroscience.2016.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Leboucher, A., Pisani, D. F., Martinez-Gili, L., Chilloux, J., Bermudez-Martin, P., Van Dijck, A., et al. (2019). Den translationelle regulator FMRP kontrollerer lipid- og glukosemetabolisme hos mus og mennesker. Mol. Metab. 21, 22-35. doi: 10.1016/j.molmet.2019.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leekam, S. R., Prior, M. R., og Uljarevic, M. (2011). Begrænset og repetitiv adfærd i autismespektrumforstyrrelser: en gennemgang af forskning i det sidste årti. Psychol. Bull. 137, 562-593. doi: 10.1037/a0023341
PubMed Abstract | CrossRef Full Text | Google Scholar
Lightbody, A. A., og Reiss, A. L. (2009). Gen-, hjerne- og adfærdssammenhænge i skrøbeligt X-syndrom: beviser fra neuroimaging-undersøgelser. Dev. Disabil. Res. Rev. 15, 343-352. doi: 10.1002/ddrr.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Meera, P., Wallner, M., og Otis, T. S. (2011). Molekylært grundlag for den høje THIP/gaboxadol-følsomhed hos ekstrasynaptiske GABAA-receptorer. J. Neurophysiol. 106, 2057-2064. doi: 10.1152/jn.00450.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Mientjes, E. J., Nieuwenhuizen, I., Kirkpatrick, L., Zu, T., Hoogeveen-Westerveld, M., Severijnen, L., et al. (2006). Generering af en betinget Fmr1 knock out musemodel til undersøgelse af Fmrp-funktion in vivo. Neurobiol. Dis. 21, 549-555. doi: 10.1016/j.nbd.2005.08.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Corbin, J. G., og Burns, M. P. (2011). GABAA-receptoragonisten THIP forbedrer specifikke adfærdsunderskud i musemodellen af fragilt X-syndrom. Dev. Neurosci. 33, 395-403. doi: 10.1159/000332884
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Paluszkiewicz, S. M., Martin, B. S., Kaufmann, W. E., Corbin, J. G., og Huntsman, M. M. (2010). Defekt GABAergisk neurotransmission og farmakologisk redning af neuronal hyperexcitabilitet i amygdalaen i en musemodel af fragilt X-syndrom. J. Neurosci. 30, 9929-9938. doi: 10.1523/JNEUROSCI.1714-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Osterweil, E. K., Krueger, D. D., Reinhold, K., og Bear, M. F. (2010). Overfølsomhed over for mGluR5 og ERK1/2 fører til overdreven proteinsyntese i hippocampus i en musemodel af fragilt X-syndrom. J. Neurosci. 30, 15616-15627. doi: 10.1523/JNEUROSCI.3888-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pietropaolo, S., Guilleminot, A., Martin, B., D’Amato, F. R., og Crusio, W. E. (2011). Genetisk baggrundsmodulation af kerne- og variable autistisk-lignende symptomer hos Fmr1 knock-out-mus. PLoS One 6:e17073. doi: 10.1371/journal.pone.0017073
PubMed Abstract | CrossRef Full Text | Google Scholar
Prut, L., and Belzung, C. (2003). Det åbne felt som et paradigme til at måle virkningerne af lægemidler på angstlignende adfærd: en gennemgang. Eur. J. Pharmacol. 463, 3-33. doi: 10.1016/s0014-2999(03)01272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rotschafer, S. E., Marshak, S., og Cramer, K. S. (2015). Deletion af Fmr1 ændrer funktion og synaptiske inputs i den auditive hjernestamme. PLoS One 10:e0117266. doi: 10.1371/journal.pone.0117266
PubMed Abstract | CrossRef Full Text | Google Scholar
Scharf, S. H., Jaeschke, G., Wettstein, J. G., og Lindemann, L. (2015). Metabotropisk glutamatreceptor 5 som lægemiddelmål for Fragilt X-syndrom. Curr. Opin. Pharmacol. 20, 124-134. doi: 10.1016/j.coph.2014.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N. S., Popp, S., Vialou, V., Astafurov, K., Nestler, E. J., og Dow-Edwards, D. (2016). Effekter af gaboxadol på udtrykket af kokainsensibilisering hos rotter. Exp. Clin. Psychopharmacol. 24, 131-141. doi: 10.1037/pha0000069
PubMed Abstract | CrossRef Full Text | Google Scholar
Spencer, C. M., Alekseyenko, O., Hamilton, S. M., Thomas, A. M., Serysheva, E., Yuva-Paylor, L. A., et al. (2011). Ændring af adfærdsfænotyper i Fmr1KO-mus: genetiske baggrundsforskelle afslører autistisk-lignende reaktioner. Autism Res. 4, 40-56. doi: 10.1002/aur.168
PubMed Abstract | CrossRef Full Text | Google Scholar
The Dutch-Belgian Fragile X Consortium, Bakker, C. E., Verheij, C., Willemsen, R., van der Helm, R., Oerlemans, F., et al. (1994). Fmr1 knockout-mus: en model til undersøgelse af skrøbelig X mental retardering. Cell 78, 23-33. doi: 10.1016/0092-8674(94)90569-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tranfaglia, M. R., Thibodeaux, C., Mason, D. J., Brown, D., Roberts, I., Smith, R., et al. (2019). Repurposing af tilgængelige lægemidler til neuroudviklingsforstyrrelser: den skrøbelige X-erfaring. Neuropharmacology 147, 74-86. doi: 10.1016/j.neuropharm.2018.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahlsten, D., Bachmanov, A., Finn, D. A., og Crabbe, J. C. (2006). Stabilitet af indavlede musestammers forskelle i adfærd og hjernestørrelse mellem laboratorier og på tværs af årtier. Proc. Natl. Acad. Sci. U S A 103, 16364-16369. doi: 10.1073/pnas.0605342103
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A., Raspa, M., Bann, C., Bishop, E., Hessl, D., Sacco, P., et al. (2014). Angst, opmærksomhedsproblemer, hyperaktivitet og den afvigende adfærdscheckliste ved fragilt X-syndrom. Am. J. Med. Genet. A 164A, 141-155. doi: 10.1002/ajmg.a.36232
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A. C., Raspa, M., Bishop, E., og Bailey, D. B. Jr. (2016). Aggression i skrøbeligt X-syndrom. J. Intellect. Disabil. Res. 60, 113-125. doi: 10.1111/jir.12238
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, N., Peng, Z., Tong, X., Lindemeyer, A. K., Cetina, Y., Huang, C. S., et al. (2017). Nedsat overfladeekspression af delta-underenheden af GABAA-receptoren bidrager til reduceret tonisk hæmning i dentate granuleceller i en musemodel af fragilt X-syndrom. Exp. Neurol. 297, 168-178. doi: 10.1016/j.expneurol.2017.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar