Introduction
En estimeret glomerulær filtrationsrate (eGFR) på under 60mL/min/1,73 m2 er forbundet med en øget risiko for dødelighed af alle årsager og kardiovaskulær dødelighed i generelle og højrisikopopulationer.1,2 Personer med nedsat eGFR har større sandsynlighed for at dø af kardiovaskulære årsager end af nyresvigt.1,3 Prævalensen af eGFR
mL/min/1,73 m2 stiger gradvist med alderen og er så høj som 50 % hos personer over 80 år.4,5 I betragtning af befolkningens aldring på verdensplan forventes nyrefunktionen at få en stigende betydning for hjerte-kar-sygdomme i de kommende år.
Nogle undersøgelser har rapporteret, at sammenhængen mellem eGFR og dødelighed afbødes med alderen.1,6 Desuden er der fortsat debat om den kliniske betydning af moderat nedsat nyrefunktion (eGFR 45-59mL/min/1,73 m2 ) hos personer over 65 år.7,8 Det blev konstateret, at dødeligheden var signifikant højere ved eGFR 6,9 men kun ved eGFR 4,10-12 Resultaterne for kardiovaskulære hændelser (CVE) er endnu mere inkonsekvente.12,13 Dette scenarie har fået nogle forfattere til at foreslå en alderskalibreret tærskel, dvs. eGFR 8, hvilket er interessant på grund af den høje prævalens af mildere reduktioner hos ældre mennesker.
Nogle af uoverensstemmelserne i resultaterne kan skyldes forskelle i de metoder, der anvendes til måling af kreatinin, eGFR-estimationsligninger eller karakteristika for de undersøgte populationer. Desuden omfattede undersøgelser i områder med lav forekomst af koronar hjertesygdom (CHD) ikke personer over 74 år14,15 eller gav ikke detaljerede oplysninger på tværs af aldersgrupper.16,17
Sigtet med denne undersøgelse var at evaluere den aldersspecifikke sammenhæng mellem eGFR og dødelighed af alle årsager (ACM) og forekomsten af hjerte-kar-sygdomme hos personer over 60 år i en sydeuropæisk befolkning med lav forekomst af CHD.18
MetoderDesign og undersøgelsespopulation
Vi udførte en retrospektiv kohorteundersøgelse, der omfattede alle personer født i eller før 1950, som var registreret i et af 40 primære sundhedscentre med et centraliseret laboratorium, der er en del af Costa de Ponent Primary Care Service i det nordøstlige Spanien (der betjener en befolkning på 873 549 personer), og hvis kreatinin blev målt mellem 1. januar 2010 og 31. december 2011. Vi udelukkede patienter med nyresygdom stadium 5 (eGFR
Datakilder
Baseline kliniske data blev indhentet fra elektroniske patientjournaler i primærsektoren; for baseline kardiovaskulær sygdom tog vi også højde for tidligere hospitalsindlæggelse på grund af kardiovaskulær sygdom eller revaskulariseringsprocedurer siden 2005. Vi definerede indeksdatoen som den dato, hvor den første kreatininmåling blev foretaget i inklusionsperioden; baselinestatus blev defineret i henhold til de karakteristika, der blev registreret mellem 1 år før og 1 måned efter indeksdatoen.
Renalfunktionsvurdering
Serumkreatininniveauer blev målt af et enkelt laboratorium ved hjælp af den standardiserede Jaffe-kompenserede kinetiske metode, der kan spores til en isotopfortyndingsmassespektrofotometri-referencemetode. eGFR blev estimeret ved hjælp af CKD-EPI-ligningen19 (Chronic Kidney Disease Epidemiology Collaboration) for kreatinin uden korrektion for race, som ikke var tilgængelig.
Vi klassificerede eGFR i kliniske kategorier i henhold til KDIGO 2012 Clinical Practice Guideline: 15 til 29, 30 til 44, 45 til 59, 60 til 89 og 90 til 119.20
Kovariater
Vi indsamlede data om alder, køn, rygestatus (aldrig ryger, aktiv ryger og tidligere ryger), hyperkolesterolæmi (serumkolesterol > 6.4 mmol/L eller statinbehandling), kardiovaskulære risikofaktorer (hypertension, diabetes mellitus) og tidligere kardiovaskulær sygdomsdiagnose (KOL, cerebrovaskulær sygdom, perifer arteriesygdom og hjertesvigt).
Resultater
Data om dødsdato blev indhentet fra hospitals- eller administrative registre uden årsagsspecifikation; alle slutpunkter for CVE blev indhentet fra hospitalsindlæggelsesjournaler, som omfatter data fra alle hospitaler i Catalonien, den nordøstlige region i Spanien. Det primære endepunkt var ACM, og det sekundære endepunkt var enhver CVE, herunder CHD (akut myokardieinfarkt , ustabil angina pectoris eller angina pectoris ) og slagtilfælde (ikke-hæmoragisk slagtilfælde , eller forbigående iskæmisk anfald ). Vi analyserede hård CVE (akut myokardieinfarkt og ikke-hæmoragisk slagtilfælde), CHD og slagtilfælde separat.
Deltagerne blev fulgt op fra 1 måned efter indeksdatoen, indtil de døde, flyttede til et andet sundhedssystem eller indtil undersøgelsens afslutning (31. december 2013).
Studieprotokollen blev godkendt af den lokale kliniske forskningsetiske komité (IDIAP Jordi Gol P11/43). Vi indhentede ikke informeret samtykke fra deltagerne, da det ikke blev anset for nødvendigt af den forskningsetiske komité.
Statistisk analyse
Alle variabler blev analyseret efter aldersgruppe (60 til 74 år og ≥ 75 år). Vi brugte disse aldersgrupper, fordi de falder sammen med de fleste nuværende systemer til vurdering af risikoen for hjerte-kar-sygdomme.18 Kontinuerlige variabler er beskrevet som gennemsnit ± standardafvigelse eller median (ikke-normalt fordelt), og kategoriske variabler er beskrevet som absolutte og relative frekvenser. Vi anvendte Student t-test og Kruskall-Wallis-test til at evaluere forskelle mellem grupper af henholdsvis normalt og ikke-normalt distribuerede kontinuerte variabler. Vi anvendte chi-square-test for kategoriske variabler og testede også for lineær tendens mellem eGFR-kategorier. Incidente hændelser blev beregnet ved hjælp af Kaplan-Meier-kurver efter 3 år.
Inden for hver gruppe anvendte vi Cox proportional hazard-modeller til at estimere hazard-forhold (HR) for sammenhængen mellem eGFR som en kontinuerlig variabel og risikoen for ACM. Vi verificerede lineariteten af eGFR-effekten ved hjælp af lineære splines med 4 frihedsgrader i Cox-modellerne. På grund af det lille antal personer med eGFR ≥ 120 (n = 14) og den mindskede præcision af estimaterne over dette punkt blev disse personer udelukket fra yderligere analyser. Vi anvendte også Cox proportional hazard-modeller til at teste for sammenhængen mellem kategorisk eGFR, defineret ved KDIGO 2012 kliniske cutoff-point, og ACM. For alle CVE blev analysen udført ved hjælp af overlevelsesteknikker med konkurrerende risici (Fine-Gray proportional subdistributional hazards regression) for at tage højde for den mulige effekt af incidente dødelighed på estimaterne.
Antagelsen om proportionalitet af faren over tid blev vurderet grafisk (Schoenfeld-residualer) for eksponeringsvariablen (eGFR).
Cox proportional hazard-modeller for både kontinuerlig og kategorisk eGFR blev justeret for alder, køn, rygerstatus, hyperkolesterolæmi, diabetes mellitus, hypertension og tidligere kardiovaskulær sygdom (iskæmisk hjertesygdom, cerebrovaskulær, perifer arteriesygdom eller hjertesvigt). Modellerne blev yderligere justeret for behandlinger med tilgængelige data (statiner og lægemidler til renin-angiotensinsystemet).
Selv om CKD-EPI blev udviklet ved hjælp af en stikprøve med et bredt aldersspektrum (18-97 år), var der kun få personer på 80 år og derover. Derfor udførte vi en følsomhedsanalyse ved hjælp af Berlin Initiative Study-1 Equation,21 som blev udviklet specifikt i en samfundsbaseret prøve af personer i alderen ≥ 70 år.
De endelige modeller blev valideret ved hjælp af Hosmer-Lemeshow-testen og arealet under den modtageroperationskarakteristiske kurve. For begge metoder blev der taget hensyn til censur og konkurrerende hændelser.
Alle statistiske analyser blev udført ved hjælp af R version 3.2.3 (R: a language and environment for statistical computing R Foundation for Statistical Computing, Wien, Østrig), med 2-sidet test og P
RESULTATER
Af 138 040 støtteberettigede personer (73.1 % af hele befolkningen i alderen ≥ 60 år i dette område), blev 6797 udelukket, fordi de var i hjemmepleje, 509 havde nyresygdom i stadie 5, og 501 var blevet fulgt op for Figur 1 i det supplerende materiale). Der var ingen klinisk signifikante forskelle mellem inkluderede og ekskluderede personer med hensyn til alder (P = .374) eller køn (henholdsvis 56,1 % og 55,1 % kvinder; P
Medianalderen for hele stikprøven var 70 år , og 56,1 % af deltagerne var kvinder. Medianen af eGFR var 82,42 ; 13,5 % af deltagerne havde en eGFR Tabel 1), prævalensen af eGFR P
P mL/min/1,73 m2 kategori.
Baselinekarakteristika for undersøgelsespopulationen, stratificeret efter alder og kategori for estimeret glomerulær filtrationsrate
| ALL | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P samlet | P tendens | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 60- til 74-års-årige | ||||||||||
| Patienter | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | ||||
| Alder, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | ||||
| Køn, kvinder | 47 549 (53,8) | 19 927 (57,7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | ||||
| Rygning | ||||||||||
| Aldrig ryger | 54 452 (61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | ||||
| Aktiv ryger | 10 458 (11,8) | 4714 (13,6) | 5189 (10,7) | 422 (9,91) | 107 (10,9) | 26 (12.2) | ||||
| Tidligere ryger | 23 446 (26.5) | 8307 (24.0) | 13 452 (27.8) | 1263 (29.7) | 347 (35.2) | 77 (36.2) | ||||
| Hyperkolesterolemi | 44 990 (50,9) | 16 710 (48,4) | 24 994 (51,7) | 2529 (59,4) | 613 (62,2) | 144 (67.6) | ||||
| Diabetes mellitus | 19 998 (22,6) | 7950 (23,0) | 10 226 (21,1) | 1296 (30,4) | 431 (43.7) | 95 (44,6) | ||||
| Hypertension | 49 781 (56.3) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86,9) | ||||
| Koronar hjerte-kar-sygdom | 6200 (7,02) | 1825 (5,28) | 3629 (7,51) | 527 (12.4) | 173 (17,5) | 46 (21,6) | ||||
| Cerebrovaskulær sygdom | 4231 (4.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120 (12,2) | 36 (16,9) | ||||
| PAD | 1686 (1,91) | 510 (1,48) | 906 (1,87) | 171 (4.02) | 76 (7.71) | 23 (10.8) | ||||
| Hjertesvigt | 1891 (2.14) | 453 (1.31) | 1011 (2.09) | 259 (6.08) | 132 (13.4) | 36 (16.9) | ||||
| Tidligere CVD* | 12 012 (13.6) | 12 012 (13.6) | 3628 (10.5) | 6854 (14,2) | 1080 (25,4) | 361 (36,6) | 89 (41,8) | |||
| Statiner | 39 392 (44.6) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | ||||
| RASD | 40 619 (46,0) | 13 468 (39.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | ||||
| ≥ 75-års-olds | ||||||||||
| Patienter | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | ||||
| Alder, y | 79.0 | 77.0 | 79.0 | 81.0 | 82.0 | 83.0 | ||||
| Køn, kvinde | 25 482 (60.8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | ||||
| Rygning | ||||||||||
| Aldrig ryger | 30 251 (72.2) | 1202 (68,0) | 20 086 (71,8) | 5836 (72,9) | 2616 (75,8) | 511 (74,7) | ||||
| Aktiv ryger | 1866 (4.46) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3.51) | ||||
| Tidligere ryger | 9760 (23.3) | 440 (24.9) | 6607 (23.6) | 1844 (23.0) | 720 (20.9) | 149 (21.8) | ||||
| Hypercholesterolemi | 20 705 (49.4) | 798 (45.1) | 13 621 (48,7) | 4115 (51,4) | 1823 (52,9) | 348 (50,9) | ||||
| Diabetes mellitus | 11 889 (28.4) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36,0) | ||||
| Hypertension | 30 563 (73.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | ||||
| Koronar hjerte-kar-sygdom | 5074 (12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | ||||
| Cerebrovaskulær sygdom | 4567 (10.9) | 171 (9.67) | 2781 (9.94) | 1034 (12.9) | 486 (14.1) | 95 (13.9) | ||||
| PAD | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | ||||
| Hjertesvigt | 3275 (7,82) | 90 (5,09) | 1648 (5,89) | 822 (10,3) | 551 (16,0) | 164 (24.0) | ||||
| Tidligere CVD* | 11 691 (27,9) | 389 (22,0) | 6900 (24,7) | 2657 (33,2) | 1419 (41.1) | 326 (47,7) | ||||
| Statiner | 19 029 (45.4) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49,0) | ||||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498 (72,8) | ||||
CVD, kardiovaskulær sygdom; PAD, perifer arteriesygdom; RASD, lægemidler til renin-angiotensinsystemet.
Medmindre andet er angivet, er data udtrykt som antal (%) eller median .
Inklusive cerebrovaskulær, PAD og hjertesvigt.
For at teste for eGFR-forbindelser i Cox-modellerne definerede vi eGFR = 80 som reference (også anvendt i CKD-Prognostic Consortium-metaanalysen)6 i begge grupper, fordi dette var medianen af eGFR i befolkningen, og 60 til 90 som den kliniske kategori, fordi denne omfattede det højeste antal personer og var klinisk signifikant.
Den mediane opfølgning var 38,2 måneder . Der blev registreret i alt 6474 dødsfald, 1573 CHD-hændelser og 2236 cerebrovaskulære hændelser. Alle udfald var signifikant mere almindelige i den ældre aldersgruppe (P Tabel 2), bortset fra slagtilfældehændelser, som var lidt mindre almindelige hos personer med en eGFR på 15 til 29.
Udfald i undersøgelsespopulationen, stratificeret efter alder og estimeret glomerulær filtrationsrate ifølge Kaplan-Meier-estimater efter 3 år. Log Rank-test (P samlet), Lineær trend Wald Test (P Trend)
| Alle | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P samlet | P trend | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 60- til 74-årige | ||||||||||
| Patienter | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | ||||
| Alle-årsag dødelighed, % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | ||||
| Enhver CVE, % | 2,09 | 1,51 | 2,26 | 3,78 | 5,60 | 7.94 | ||||
| Hård CVE, % | 1.46 | 1.06 | 1.06 | 1.56 | 2.76 | 4.05 | 4.05 | 4.78 | ||
| CHD, % | 0,96 | 0,74 | 1,02 | 1,02 | 1,38 | 2,83 | 4.80 | |||
| Slagtilfælde, % | 1,16 | 0,79 | 1,79 | 1,27 | 2,44 | 2,88 | 3.17 | |||
| ≥ 75-års-årige | ||||||||||
| Patienter | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | ||||
| Dødelighed på grund af alle årsager, % | 9.88 | 10.5 | 7.89 | 11.7 | 17,8 | 28,5 | ||||
| Enhver CVE, % | 4,34 | 3,31 | 3,90 | 4,80 | 6,80 | 6.77 | 8.35 | |||
| Hård CVE, % | 3.24 | 2.22 | 2.90 | 3.75 | 4.90 | 5.93 | ||||
| CHD, % | 1.69 | 1.30 | 1.48 | 1.48 | 1.77 | 2,86 | 5,41 | |||
| Slagtilfælde, % | 2.74 | 2,13 | 2,49 | 3,17 | 4,00 | 3,34 | ||||
CHD, koronar hjertesygdom; CVE, kardiovaskulær hændelse.
Både modeller, for ACM og enhver CVE, viste proportionalitet af faren over tid for eksponeringsvariablen (eGFR; data ikke vist).
Sammenhængen mellem eGFR og risiko for ACM fulgte et U-formet mønster i begge aldersgrupper, men var mere svækket i den ældre gruppe (Figur 1). I modsætning hertil viste HR’erne for enhver CVE en lineær fordeling med en progressiv stigning i risikoen fra højere eGFR til lavere; dette mønster var ens i begge aldersgrupper og også for andre kardiovaskulære endepunkter (Figur 2 i det supplerende materiale). For alle udfald blev HR’erne i ≥ 75-årige signifikante under eGFR = 60 (Figur 1), mellem eGFR = 55 og eGFR = 60 for ACM og ved eGFR ∼ 50 for enhver CVE.
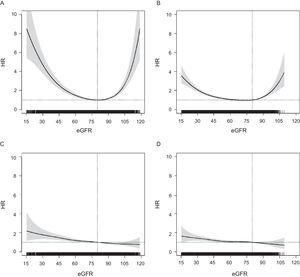
Sammenhæng mellem eGFR (kontinuerlig variabel) og risiko for ACM hos personer i alderen P-værdi
Med hensyn til de kliniske kategorier af eGFR steg risikoen for ACM og enhver CVE gradvist i eGFR-kategorier under 60 til 89 i begge aldersgrupper (Figur 2). Stigningen i risikoen for ACM var meget højere og stejlere hos 60-74-årige end hos ≥ 75-årige, mens stigningen for enhver CVE var mere ens i begge aldersgrupper og var på grænsen til signifikant i kategorien eGFR = 45 til 59 for ≥ 75-årige. Yderligere justering for behandling med statiner og lægemidler til renin-angiotensinsystemet ændrede ikke HR-værdierne (data ikke vist). Vi fandt også, at personer med et eGFR på 90 til 119 havde en højere risiko for død i den ældste gruppe og en signifikant lavere risiko for enhver CVE kun i den yngste gruppe. Resultaterne af modellerne for CHD, slagtilfælde og hård CVE lignede dem for enhver CVE (figur 3 i det supplerende materiale). En følsomhedsanalyse, der anvendte Berlin Initiative Study-1-ligningen til beregning af eGFR, viste ingen forskelle (figur 4 i det supplerende materiale).

Sammenhæng mellem eGFR-kategorier og risiko for dødelighed af alle årsager og enhver kardiovaskulær hændelse, vurderet ved hjælp af justerede Cox proportional hazard-modeller, hvor død betragtes som en konkurrerende hændelse for kardiovaskulære hændelser (samlet P-værdi
De endelige modeller viste god kalibrering og diskrimination (Figur 5 i det supplerende materiale og Tabel i det supplerende materiale).
DISKUSSION
I en population af personer i alderen ≥ 60 år i et land med lav kardiovaskulær risiko steg risikoen for ACM og enhver CVE gradvist med faldende eGFR, både hos 60-74-årige og hos ≥ 75-årige, uafhængigt af andre risikofaktorer og kardiovaskulær sygdom. HR’erne i den ældre aldersgruppe blev imidlertid signifikante ved lavere eGFR (under eGFR = 60) og var på grænsen til signifikant for enhver CVE i kategorien eGFR = 45 til 59. Den eGFR-associerede stigning i dødelighedsrisikoen var højere hos 60-74-årige end hos ≥ 75-årige, men var ens for CVE-risiko. Desuden fulgte sammenhængen mellem eGFR og dødelighed et U-formet mønster med øget dødelighed i kategorien 90 til 119 og var højere hos ≥ 75-årige.
I denne undersøgelsespopulation definerede alderskategorierne 2 veldifferentierede grupper, hvor antallet af personer med eGFR
Som forventet var forekomsten af kardiovaskulære udfald lavere end rapporteret hos ældre personer i lande uden for Middelhavsområdet,22 men var højere end hos yngre personer i vores område.23 Incidente cerebrovaskulære hændelser var mere almindelige end koronar hændelser, hvilket også er blevet beskrevet i undersøgelser af ældre mennesker.22
I overensstemmelse med tidligere rapporter,1,6,14,22,24 observerede vi et U-formet forhold mellem eGFR som en kontinuerlig variabel og ACM i begge aldersgrupper. Bemærkelsesværdigt nok var den observerede overrisiko for ACM i kategorien eGFR = 90 til 119 højere hos ældre patienter. Denne risikoforøgelse kunne afspejle forveksling af muskelsvind sekundært til andre sygdomme, der fører til døden; dette er en kendt begrænsning af kreatininbaserede estimeringsformler.19 I modsætning hertil fandt vi, at risikoen for ny CVE steg fra højere til lavere eGFR. Dette er i overensstemmelse med nogle tidligere rapporter,13,23,25 selv om andre har rapporteret et mindre udtalt U-formet forhold for kardiovaskulær dødelighed6,12 og kardiovaskulær sygdom.15 Således kunne incidente CVE, som synes at være mindre påvirket af begrænsningerne i kreatininbaserede estimeringsformler, være et mere pålideligt indeks for den prognostiske effekt af eGFR på kardiovaskulær risiko.
Der er modstridende beviser for den kliniske betydning af moderat nedsat eGFR hos ældre mennesker. Kun få undersøgelser har anvendt den aktuelt anbefalede ligning til at vurdere eGFR-associeret risiko og til at sammenligne resultaterne på tværs af alderskategorier. Så vidt vi ved, er vores undersøgelse den første undersøgelse, der gør dette i en ældre befolkning, der er bosiddende i en region med lav forekomst af CHD.
For ACM rapporterede CKD-PC-metaanalysen6 en signifikant justeret HR ved eGFR 9 gjorde et lignende fund i 60 til 69, 70 til 79 og ≥ 80 årige. I modsætning hertil blev der i Cardiovascular Health Study12 hos octogenarer kun fundet signifikante HR’er ved eGFR ≤ 43. I Sydeuropa har man fundet, at dødeligheden stiger hos personer over 65 år med eGFR 16 og hos 60-74-årige med eGFR 15 Hos 35-74-årige uden hjerte-kar-sygdom fandt man, at eGFR var en grænsesignifikant prædiktor for ACM,14 og med en signifikant større risiko ved eGFR = 45-59.
For kardiovaskulær dødelighed var HR’erne i grupperne 65-74 år og ≥ 75 år signifikante for eGFR 6, mens Cardiovascular Health Study, der anvendte kreatininbaserede ligninger, ikke fandt en lignende sammenhæng hos octogenarer.12 Med hensyn til risikoen for incidente CVE fandt PREVEND-undersøgelsen en sammenhæng med eGFR hos personer under 60 år, men ikke hos personer ≥ 60 år.13 I Sydeuropa er der rapporteret en øget risiko for kardiovaskulær mortalitet ved eGFR 16 og for incidente kardiovaskulære sygdomme (marginalt signifikant) ved eGFR 15 og eGFR 23
I vores undersøgelse steg HR’erne for ACM og enhver CVE støt med faldende eGFR under kategorien 60 til 89 år i både grupperne i alderen 60 til 74 år og ≥ 75 år. Som i tidligere rapporter var HR-værdierne og risikogradienten lavere i den ældste gruppe,6,9 og ved analyse af kontinuerlig eGFR blev HR’erne signifikante ved eGFR 6
De fleste nuværende internationale retningslinjer betragter alle personer med eGFR 18,20,26 I den foreliggende undersøgelse havde 20 % af deltagerne i alderen ≥ 75 år eGFR = 45 til 59, hvoraf 74 % havde eGFR ≥ 50. Hvis man således betragter alle ældre personer i kategorien 45 til 59 som havende en højere risiko, vil mange personer med “ingen betydelig ekstra risiko” blive udsat for mere aggressive mål og behandling af kardiovaskulære risikofaktorer. Desuden er den 11 % øgede relative risiko for KOL-hændelser hos 60-74-årige måske ikke tilstrækkelig til at betragte kategorien eGFR = 45-59 som en KOL-risikoækvivalent i lande med lav forekomst af KOL.
Styrker og begrænsninger
En stor styrke ved vores undersøgelse er det meget store antal personer, der er inkluderet, og det faktum, at de blev udtaget fra en repræsentativ befolkningsbaseret stikprøve, der afspejler den reelle situation for patienter, der behandles i primærsektoren. Næsten alle personer i alderen > 60 år (93 %) blev behandlet af det catalanske primære sundhedssystem, og en høj procentdel havde en kreatininmåling, sandsynligvis fordi dette er en del af den grundlæggende forebyggende sundhedskontrol og rutinemæssig opfølgning af andre udbredte kroniske sygdomme i denne befolkning. Desuden blev assays til kreatininmåling kalibreret til en referencemetode ved hjælp af isotopfortyndingsmassespektrofotometri som anbefalet, og de blev udført i et centraliseret laboratorium, hvilket yderligere reducerer variabiliteten.
Resultaterne af denne undersøgelse bør også fortolkes i lyset af forskellige begrænsninger. For det første blev eGFR-værdier og -kategorier tildelt på grundlag af en enkelt måling, hvilket er sædvanligt i epidemiologiske undersøgelser af prognoser. På grund af regressionsfortyndingsbias kan dette undervurdere den sande sammenhæng mellem eGFR og de pågældende resultater. Lave eGFR-målinger fra ambulante laboratoriedatabaser har imidlertid vist sig at være relativt stabile hos ældre personer.27 For det andet tog vi ikke højde for virkningen af nogle faktorer, der kan ændre nyrefunktionen, såsom neoplasmer, nefrotoksiske lægemidler, infektioner eller klinisk sammenfaldende hændelser. Vi mener, at disse virkninger er minimeret af det store antal inkluderede patienter. For det tredje estimerede vi eGFR ud fra serumkreatininmålinger ved hjælp af CKD-EPI-formlen, og vi accepterer begrænsningerne ved kreatininbaserede estimeringsformler, som har større effekt ved højere eGFR.19 Vi korrigerede ikke for race, selv om kaukasisk etnicitet er fremherskende i vores population, især i dette aldersinterval. Desuden, selv om den diagnostiske og prognostiske anvendelse af CKD-EPI hos ældre personer er genstand for debat, og der er udviklet nye formler, er CKD-EPI i øjeblikket den anbefalede tilgang20 og anvendes i vid udstrækning i primærsektoren. Desuden gav en følsomhedsanalyse med eGFR beregnet i henhold til Berlin Initiative Study-1-ligningen lignende resultater. For det fjerde var vi ikke i stand til at evaluere effekten af urinalbumin, da disse data ikke var tilgængelige; selv om eGFR og albumin begge anbefales til evaluering af CKD, har de vist uafhængige prognostiske implikationer,1 og de resultater, der præsenteres her, tilføjer værdifulde oplysninger om effekten af eGFR på kardiovaskulær risiko og cutoff-niveauer hos ældre personer. For det femte blev dataene indhentet fra elektroniske sundhedsjournaler, og fejlregistrering kan ikke udelukkes. Data for hjerte-kar-sygdomme i den primære sundhedspleje har vist sig at være af højere kvalitet end for andre sygdomme og egnede til epidemiologiske undersøgelser i vores population.28,29 Dødelige CVE uden for hospitalet blev ikke medtaget. Specifikt kan vi have underopdaget slagtilfælde hos patienter med fremskreden nyresygdom, som ikke blev indlagt på hospitalet, og disse var sandsynligvis mere alvorlige og med større comorbiditet, der resulterede i død. Mønstret for slagtilfældehændelser hos personer med eGFR mellem 45 og 80 svarede til mønstret for andre CVE; vi mener ikke, at dette ugyldiggør vores resultater, da vores fokus var på mild CKD. For det sjette blev modellerne justeret for kardiovaskulære risikofaktorer og sygdomme samt statinbehandling og lægemidler til renin-angiotensinsystemet, men ikke for andre komorbiditeter, lægemidler eller socioøkonomiske faktorer, der kan påvirke forekomsten af CVE. Endelig havde vi ikke adgang til data om dødsårsag. Dødelighed af alle årsager omfatter flere etiologier, der ikke er relateret til nyrefunktionen, men til andre aldersrelaterede sygdomme, diabetes mellitus eller hjertesvigt, f.eks. infektioner eller fald. Selv om vi justerede for nogle af disse komorbiditeter, kan vi ikke udelukke tilstedeværelsen af andre kilder til forvirring, såsom skrøbelighed.30
KONKLUSIONER
Sammenfattende observerede vi hos personer i alderen ≥ 60 år bosiddende i et land med en lav forekomst af CHD en stigning i risikoen for ACM og enhver CVE med faldende eGFR i både grupperne i alderen 60 til 74 år og ≥ 75 år. HR’erne blev dog signifikante ved eGFR
FUNDING
Dette projekt blev støttet af en forskningsbevilling fra Carlos III Institute of Health, Ministeriet for Økonomi og Konkurrenceevne (Spanien), tildelt under 2011-udbuddet af Health Strategy Action, inden for det nationale forskningsprogram orienteret mod samfundsudfordringer. Dette program er en del af den nationale plan for teknisk, videnskabelig og innovativ forskning 2008-2011, der samfinansieres med EU’s EFRU-midler (Den Europæiske Fond for Regionaludvikling) (PI11/02220). Ministeriet for Økonomi og Konkurrenceevne gennem Carlos III Institute of Health (Red RedIAPP RD12/0007) og EFRU-midler Generalitat de Catalunya gennem AGAUR (A for Management of Universities and Research Grants) (2014 SGR 1225) (2014 SGR 902). M. Grau blev finansieret af et Miguel Servet-tilskud (Carlos III Institute of Health, Ministeriet for Økonomi og Konkurrenceevne, Spanien) (PI12/03287).
Interessekonflikter
L. Pascual-Benito modtog foredragshonorarer fra Alter. A. Martínez-Castelao modtog konsulenthonorarer/betalte rådgivende bestyrelser fra Boëhringer-Ingelheim og foredragshonorarer fra og Boëhringer-Ingelheim.
- –
Individer med en eGFR
mL/min/1,73 m2 har en øget kardiovaskulær risiko. Prævalensen af nedsat eGFR stiger gradvist med alderen og er så høj som 50 % hos personer over 80 år. Der er en løbende debat om den kliniske betydning af de hyppigere mildere nedsættelser (eGFR 45 til 59mL/min/1,73 m2) hos ældre mennesker. Desuden har undersøgelser i områder med en lav forekomst af KOL ikke omfattet personer over 74 år eller har ikke givet detaljerede oplysninger på tværs af aldersgrupper.HVAD TILFØJER DENNE STUDIE?
- –
I en population af personer i alderen ≥ 60 år med bopæl i et land med lav kardiovaskulær risiko steg risikoen for ACM og enhver CVE gradvist med faldende eGFR, både hos 60-74-årige og hos ≥ 75-årige, uafhængigt af andre risikofaktorer og kardiovaskulære sygdomme. HR’erne i den ældre aldersgruppe blev dog signifikante ved eGFR under 60. Den eGFR-associerede stigning i dødelighedsrisikoen var højere i gruppen 60-74 år end i gruppen ≥ 75 år, men var ens for CVE-risikoen.