- Hvad gør et molekyle polært?
- Kig på strukturformlen for kuldioxid:
- Hvorfor er vand polært?
Vand er et polært molekyle, fordi dets ilt er stærkt elektronegativt og som sådan trækker elektronparret mod sig selv (væk fra de to brintatomer), hvorved det får en let negativ ladning.
Den polære karakter af et molekyle afhænger ikke kun af dets bestanddele, men også af, hvordan de er anbragt omkring det centrale atom, dvs. den rumlige placering af disse atomer. For at forstå dette bedre, lad os diskutere emnet nærmere.
Hvad gør et molekyle polært?
Et molekyls polaritet hænger sammen med forskydningen af elektroner i en bestemt retning. Dette afhænger igen af polariteten af de bindinger, der er til stede i molekylet, da disse bindinger også indeholder elektroner.
I et molekyle vil det atom, der har den største evne til at tiltrække elektroner til sig selv (dvs, det er mere elektronegativt end det andet atom) vil få en let negativ ladning på sig selv, og bindingen mellem de to atomer vil blive polær.
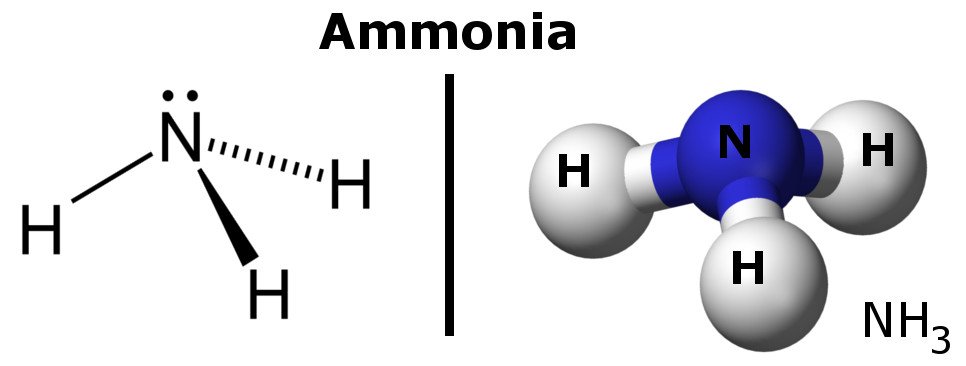
Ammoniak er et polært molekyle, fordi det har områder med lette negative og positive ladninger.
Samlet set kan man sige, at elektrontætheden i en polær binding akkumuleres mod den ene ende af bindingen, hvilket resulterer i, at denne ende besidder en let negativ ladning, mens den anden ende har en let positiv ladning. Dette gør et molekyle polært.
Sådan er det også, at hvis et molekyle ikke har områder med positiv og negativ ladning, betragtes det som upolært.
En interessant ting at bemærke er imidlertid, at jo større forskellen i elektronegativitet er, jo mere polær vil bindingen være i et molekyle. Carbonylforbindelser er polære, fordi carbonylkulstoffet er lidt positivt. Burde kuldioxid, som indeholder et positivt kulstof og to delvist negative oxygenatomer, således ikke være polær?
Jamen, kuldioxid består af to oxygenatomer, der er knyttet til et kulstofatom. Oxygenatomer er langt mere elektronegative end kulstofatomer, og som sådan burde de have en delvist negativ ladning, mens kulstofatomet burde være svagt positivt ladet. Men interessant nok sker det ikke.
Se på strukturformlen for kuldioxid:
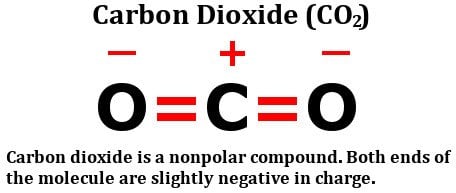
Det består af to lige elektronegative iltatomer, ja, men se på, hvordan disse atomer er arrangeret omkring kulstofatomet. De står begge i perfekte 180-graders vinkler i forhold til kulstof. Derfor trækker de elektrontætheden fra kulstof med lige stor kraft i modsatte retninger. Nettoresultatet er, at elektrontætheden på kulstofatomet forbliver upåvirket, hvilket gør kuldioxidmolekylet upolært.
Kuldioxid er et godt eksempel på, hvordan geometrien af et molekyle spiller en afgørende rolle for, om det er polært eller upolært. Lad os nu se på et vandmolekyle:
Hvorfor er vand polært?
Den kemiske formel for vand er H20, hvilket betyder, at det indeholder to hydrogenatomer og et oxygenatom. Brintatomerne består kun af én elektron i deres skal, mens iltatomet har 6 valenselektroner.
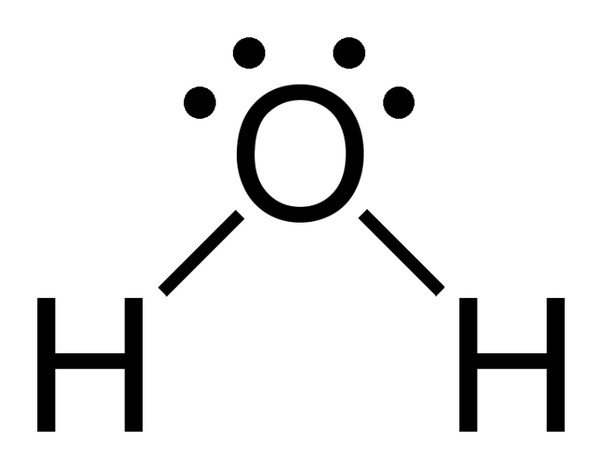
Bemærk de 2 ensomme elektronpar på iltatomet i vand.
Da ilt har 6 elektroner i sin valensskal, deler det en elektron med hvert brintatom. På denne måde står det tilbage med 4 ubundne elektroner i sine 2 orbitaler. Disse bundne og ubundne elektronpar arrangerer sig i en tetraederform omkring ilt, hvilket er grunden til, at de to bindinger ser ud til at have en bøjet form.
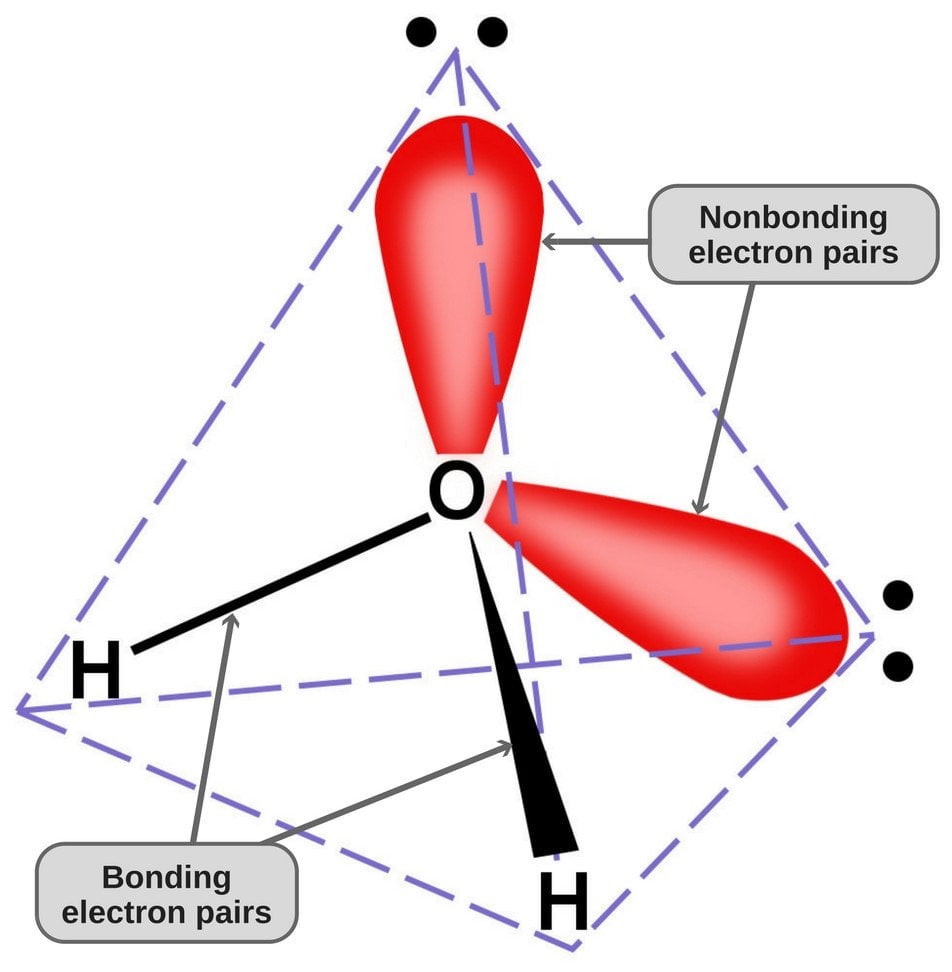
Vandmolekylets tetraedriske geometri.
Nu har både oxygen- og hydrogenatomer forskellige elektronegativiteter (hydrogenets elektronegativitetsværdi er 2,1, mens oxygenets elektronegativitet er 3,5); derfor er begge bindinger polære. Da ilt er mere elektronegativ end brint, forskydes elektrontætheden mod ilt i begge disse bindinger, hvorved området omkring ilten bliver mere negativt end områderne omkring de to brintatomer.
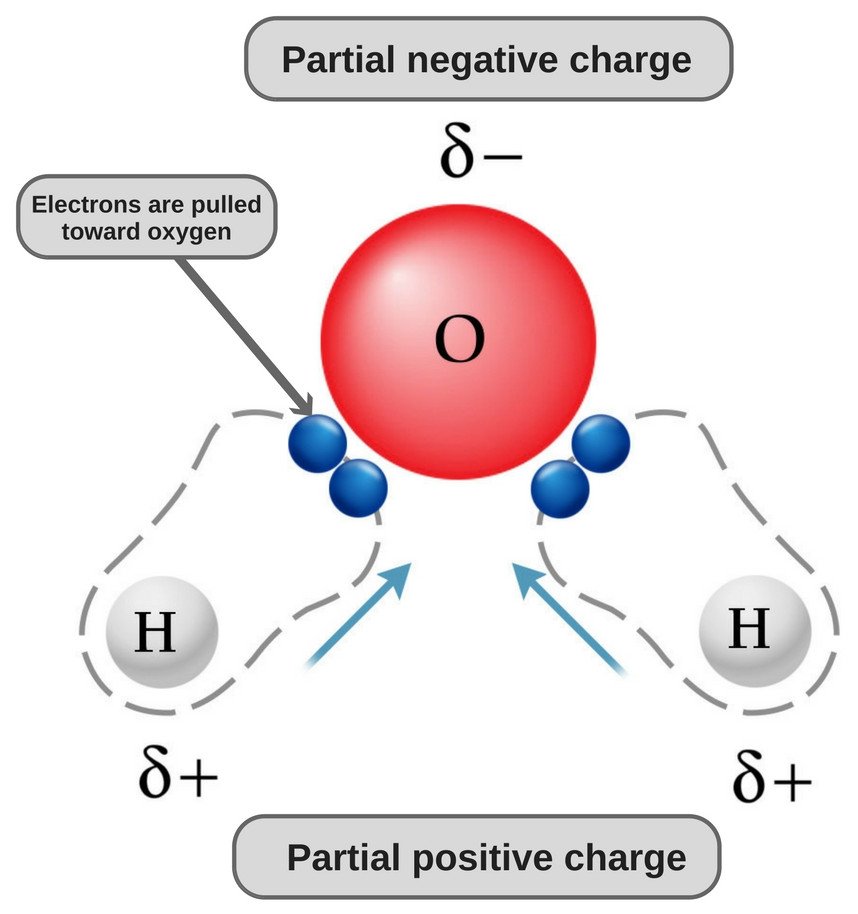
Det er derfor, at vandmolekylet bliver polært!