- Indledning
- Epidemiologi
- Organismen og patofysiologien ved C. difficile-diarré
- Kliniske manifestationer
- Diagnose
- Praktiske retningslinjer for diagnosticering af C. difficile diarrésyndromer
- Endoskopisk diagnosticering af C. difficile-diarré og colitis
- Behandling
- Håndtering af recidiverende C. difficile-diarré
- Svær C. difficile colitis
- Konklusion
Indledning
Clostridium difficile-associeret diarré (CDAD) er blevet anerkendt med stigende hyppighed som en årsag til nosokomial sygdom. Hyppigheden og forekomsten af CDAD varierer meget og påvirkes af flere faktorer, herunder nosokomiale udbrud, mønstre for antimikrobiel brug og individuel modtagelighed. Der er ingen rapporter om prospektive undersøgelser af hospitaler, der følger positiv toksin A eller A/B og resultaterne af CDAD og dens komplikationer.
Centers for Disease Control and Prevention (CDC) har analyseret sekulære tendenser i forekomsten af CDAD, og det rapporterede en støt stigning fra 1987 til 2001 (1). I denne rapport rapporterede 30 % af 440 læger med infektionsmedicin, der deltog i en webbaseret undersøgelse, at de ser højere forekomster af CDAD, mere alvorlig CDAD og mere recidiverende CDAD end tidligere. Der er et generelt indtryk af, at der er sket en stigning i andelen af tilfælde med alvorlige og dødelige komplikationer og en stigning i recidivraten blandt de berørte patienter.
Ud over morbiditet og dødelighed er den økonomiske byrde af C. difficile-infektion i form af forsinket udskrivning og andre hospitalsomkostninger betydelig.
Epidemiologi
Hyppigheden og forekomsten af CDAD varierer mellem hospitaler og inden for en given institution over tid. Risikoen for sygdom øges hos patienter med antibiotikaeksponering, gastrointestinal kirurgi, stigende opholdstid i sundhedsvæsenet, alvorlig underliggende sygdom, immunkompromitterende tilstande og høj alder.
C. difficile udskilles i afføring. Enhver overflade, enhver anordning eller ethvert materiale (f.eks. kommode, badekar og elektronisk rektalt termometer), der bliver kontamineret med afføring, kan fungere som reservoir for C. difficile-sporer. Sporer overføres til patienter hovedsageligt via hænderne på sundhedspersonale, der har rørt ved en kontamineret overflade eller genstand (2-6).
 klik for stor version
klik for stor version
Figur 1 . Digitalt røntgenbillede fra CT-scanning viser nodulær haustaltfortykkelse i det tværgående colon.
Organismen og patofysiologien ved C. difficile-diarré
C. difficile er en gram-positiv, anaerob, sporedannende bacille, der er ansvarlig for udviklingen af antibiotika-associeret diarré og colitis. C. difficile blev første gang beskrevet i 1935 som en bestanddel af den fækale flora hos raske nyfødte og blev oprindeligt ikke anset for at være patogen (7). Bacillen fik navnet difficile, fordi den vokser langsomt og er vanskelig at dyrke. C. difficile er i dag ansvarlig for næsten alle årsager til pseudomembranøs colitis og op til 20 % af tilfældene af antibiotika-associeret diarré uden colitis. Selv om den kun findes i afføringen hos 5 % af den almindelige befolkning, bliver op til 21 % af voksne koloniseret med denne organisme under indlæggelse på hospitalet (2,6).
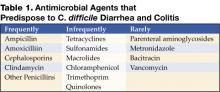
En ændring af den normale kolonimikroflora, som normalt skyldes antibiotikabehandling, er den vigtigste faktor, der prædisponerer for infektion med C. difficile. Næsten alle antibiotika er blevet forbundet med C. difficile-diarré og colitis. De antibiotika, der hyppigst er associeret, omfatter clindamycin, cefalosporiner, ampicillin og amoxicillin (tabel 1) (8).
Ud over antibiotikabehandling er ældre alder og sværhedsgraden af den underliggende sygdom vigtige risikofaktorer for C. difficile-infektion. Andre risikofaktorer omfatter tilstedeværelsen af en nasogastrisk sonde, gastrointestinale procedurer, syrehæmmende medicin, ophold på intensivafdeling og indlæggelsens varighed (9).
C. difficile-diarré skyldes primært udarbejdelsen af toksiner A og B, der produceres ved bakteriel formering i tarmlumenet. Disse toksiner binder sig til colonslimhinden og udøver deres skadelige virkninger på denne. Organismen skader sjældent tyktarmen ved direkte invasion, og diarréen skyldes virkningerne af toksiner, der produceres i tarmlumen, og som klæber til slimhindeoverfladen. De fleste toksigene isolater producerer begge toksiner, og ca. 5-25 % af isolaterne producerer hverken toksin A eller B og forårsager ikke colitis eller diarré (3-5).
Kliniske manifestationer
Infektion med C. difficile kan give en lang række kliniske manifestationer, herunder asymptomatisk bæresyge, mild til moderat diarré og fulminant sygdom med pseudomembranøs colitis (10). Hos patienter, der udvikler CDAD, begynder symptomerne normalt kort efter kolonisering. Kolonisering kan forekomme under antibiotikabehandling eller op til flere uger efter et antibiotikaforløb. CDAD er typisk forbundet med passage af hyppige, løse afføringer, der er i overensstemmelse med proktocolitis. Slim eller okkult blod kan være til stede, men synligt blod er sjældent.
Diagnose
Diagnosen CDAD er baseret på en historie med nylig eller igangværende antibiotikabehandling, udvikling af diarré eller andre tegn på akut colitis og påvisning af infektion med toksigene C. difficile, normalt ved påvisning af toksin A eller toksin B i afføringsprøve.
Figur 1 . Digitalt røntgenbillede fra CT-scanning viser nodulær haustal fortykkelse i det tværgående colon.
Praktiske retningslinjer for diagnosticering af C. difficile diarrésyndromer
- Diagnosen bør mistænkes hos alle med diarré, der har fået antibiotika inden for de foregående 2 måneder og/eller hvis diarré begynder 72 timer eller mere efter hospitalsindlæggelse.
- Når diagnosen mistænkes, bør en enkelt afføringsprøve sendes til laboratoriet til undersøgelse for tilstedeværelse af C. difficile og/eller dets toksiner.
- Når diarréen fortsætter på trods af et negativt afføringstoksinresultat, kan der sendes en eller to yderligere prøver til undersøgelse med de samme eller andre test (4). Endoskopi er forbeholdt særlige situationer, f.eks. når der er behov for en hurtig diagnose, og testresultaterne er forsinkede eller testen ikke er meget følsom, når patienten har ileus og afføring ikke er tilgængelig, eller når andre colonsygdomme også er en overvejelse.
Der findes endnu ingen enkel, billig, hurtig, følsom og specifik test til diagnosticering af C. difficile-diarré og colitis, og alle de tilgængelige test er heller ikke egnede til at blive anvendt af alle laboratorier (tabel 2) (11).
Endoskopisk diagnosticering af C. difficile-diarré og colitis
Sigmoidoskopi og koloskopi er ikke indiceret til de fleste patienter med CDAD (10,12). Endoskopi er dog nyttig i særlige situationer, f.eks. når der er tvivl om diagnosen, eller den kliniske situation kræver hurtig diagnose. Resultaterne af den endoskopiske undersøgelse kan være normale hos patienter med let diarré eller kan vise uspecifik colitis i moderate tilfælde. Konstatering af pseudomembraner i colonien hos en patient med antibiotika-associeret diarré er praktisk taget patognomonisk for C. difficile-kolitis. Nogle få patienter uden diagnostiske træk i rectosigmoid har pseudomembraner i de mere proximale områder af colon (13). Andre endoskopiske fund omfatter erytem, ødemer, smørbarhed og uspecifik colitis med små ulcerationer eller erosioner.
Behandling
Det første skridt i behandlingen af C. difficile-diarré og colitis er at afbryde de udløsende antibiotika, hvis det er muligt (10,12). Diarréen forsvinder hos ca. 15-25 % af patienterne uden specifik anti-C. difficile-behandling (14,15). Konservativ behandling alene er dog muligvis ikke indiceret hos patienter, der er systemisk syge eller har flere medicinske problemer, da det er vanskeligt at forudsige, hvilke patienter der vil forbedre sig spontant. Hvis det ikke er muligt at seponere det udledende antibiotikum på grund af andre aktive infektioner, bør patientens antibiotikaregime om muligt ændres, så der anvendes midler, der er mindre tilbøjelige til at forårsage CDAD (f.eks, aminoglykosider, trimethoprim, rifampin eller en quinolon).
Antiperistaltiske midler, såsom diphenoxylat plus atropin (Lomotil) eller loperamid (Imodium), og narkotiske analgetika bør undgås, fordi de kan forsinke clearance af toksiner fra colon og derved forværre toksininduceret colonskade eller fremskynde ileus og toksisk dilatation (12,16). Specifik behandling til udryddelse af C. difficile bør anvendes hos patienter med indledningsvis alvorlige symptomer og hos patienter, hvis symptomer fortsætter på trods af ophør af antibiotikabehandling. Selv om diagnosen C. difficile colitis ideelt set bør fastslås, før antimikrobiel behandling iværksættes, anbefaler de nuværende ACG-retningslinjer, at empirisk behandling bør iværksættes i stærkt suggestive tilfælde hos alvorligt syge patienter (tabel 3 på side 54) (12) (12).
På nuværende tidspunkt betragtes oral vancomycin eller metronidazol, der anvendes i 7 til 10 dage, af de fleste forfattere og de nuværende retningslinjer som førstevalgsterapi. Metronidazol i en dosis på 250 mg 4 gange dagligt anbefales af de fleste forfattere og ACG-retningslinjer som det foretrukne lægemiddel til den indledende behandling af C. difficile colitis (12). Disse anbefalinger er i vid udstrækning baseret på effektivitet, lavere omkostninger og bekymring for udviklingen af vancomycin-resistente stammer. Store ulemper ved metronidazol omfatter en mindre ønskværdig lægemiddelprofil og kontraindikationer hos børn og gravide kvinder.
Vancomycin er derimod i en dosis på 125 mg 4 gange dagligt sikkert og veltolereret og opnår afføringsniveauer 20 gange den krævede minimale hæmmende koncentration til behandling af C. difficile. Ulemper ved brugen af vancomycin er omkostningerne og den potentielle udvikling af vancomycin-resistente stammer. De nuværende ACG-retningslinjer betragter vancomycin som det foretrukne lægemiddel hos alvorligt syge patienter og i tilfælde, hvor brugen af metronidazol er udelukket.
Der mangler kontrollerede kliniske forsøg for patienter med fulminant colitis, som muligvis ikke tåler oral behandling. Indgift af metronidazol intravenøst eller indgift af vancomycin via nasogastrisk sonde eller rektal lavement er blevet beskrevet i små sagsserier (17-20). Intravenøs administration af vancomycin anbefales ikke, da stoffet ikke udskilles i colon (17).
Håndtering af recidiverende C. difficile-diarré
Trods vellykket initial behandling af CDAD har 15-20 % af patienterne recidiv af diarré i forbindelse med en positiv afføringstest for C. difficile-toksin. Symptomatisk recidiv skyldes sjældent behandlingssvigt eller antimikrobiel resistens over for metronidazol eller vancomycin. Behandlingsmetoder omfatter konservativ behandling (mange patienter er dog ældre og svagelige og kan ikke tåle diarré), behandling med specifikke anti-C. difficile-antibiotika, anvendelse af anionbindende harpikser, behandling med mikroorganismer (probiotika) og immunglobulinbehandling.
Den mest almindelige behandling af tilbagevendende C. difficile-diarré er en anden behandling med det samme antibiotikum, som blev anvendt til behandling af den første episode (12). I en stor observationsundersøgelse i USA reagerede 92 % af patienterne med tilbagevendende CDAD med succes på et enkelt gentaget behandlingsforløb, som regel med metronidazol eller vancomycin (14). Der er dokumentation for, at patienter med en historie med recidiv har en høj risiko for yderligere episoder af CDAD, efter at antibiotikabehandlingen er blevet afbrudt. Der er ingen data, der tyder på, at sekventielle episoder bliver gradvist mere alvorlige eller komplicerede (21). Der er blevet foreslået en række forskellige behandlingsskemaer for patienter med flere recidiv af C. difficile-diarré. En fremgangsmåde er at give et forlænget forløb med vancomycin (eller metronidazol) ved hjælp af en faldende doseringsskema efterfulgt af pulsterapi (tabel 4).
Cholestyramin, en anionbytterharpiks, der indgives i en dosis på 4 gram 3 eller 4 gange dagligt i 1 til 2 uger, binder C. difficile-toksiner og kan anvendes sammen med antibiotika til behandling af gentagne tilbagefald. Da kolestyramin kan binde både vancomycin og toksiner, bør det tages mindst 2 til 3 timer efter vancomycinet.
Svær C. difficile colitis
Incidensen af fulminant C. difficile colitis er blevet rapporteret til at være 1,6-3,2 % (22). Selv om der mangler nyere præcise tal fra andre centre, anerkendes det som en stigende årsag til komplikationer og død. Det kliniske syndrom af fulminant C. difficile colitis kan genkendes med et korrekt kendskab til spektret af sygdomsforekomsten.
A. Diarré: Selv om diarré er kendetegnende for C. difficile colitis, er den ikke altid til stede, og fraværet af diarré kan føre til diagnostisk forvirring. Når diarré er fraværende, synes dette at være sekundært til alvorlig dysmotilitet i colonien. Selv når diarré er til stede, kan diarré opfattes som en mindre komponent i et uspecificeret septisk billede.
Figur 1 . Digitalt røntgenbillede fra CT-scanning viser nodulær haustal fortykkelse i det tværgående colon.
Figur 2 . CT-billede af øvre abdomen bekræfter markant haustral fortykkelse i det tværgående colon.
Figur 3 . CT-billede af det midterste abdomen viser udtalt fortykkelse af hele colon. Der er milde inflammatoriske forandringer i det perikoloniale fedt.
B. Svær sygdom: Fulminant colitis er en usædvanlig form for C. difficile-infektion, der kun forekommer hos 3 % af patienterne, men som står for stort set alle alvorlige komplikationer. Patienter med mere alvorlige former af sygdommen kan præsentere sig med eller uden diarré. Når patienterne udvikler colitis lokaliseret til cecum og højre side af colon, kan diarréen være minimal eller fraværende. I mangel af diarré kan de eneste ledetråde til diagnosen være systemiske tegn på toksicitet (feber, takykardi, leukocytose og/eller volumenudtømning).
Et forhøjet antal hvide blodlegemer kan være et vigtigt fingerpeg om en forestående fulminant C. difficile colitis. Den hurtige forhøjelse af det perifere antal hvide blodlegemer (almindeligvis så højt som 30.000 til 50.000) med et betydeligt overskud af bånd og undertiden mere umodne former går ofte forud for hæmodynamisk ustabilitet og udvikling af organdysfunktion. Selv hos patienter, der i en længere periode har haft milde symptomer, kan der opstå pludselig og uventet udvikling til chok. Det er vanskeligt at forudsige, hvilke patienter der ikke vil reagere på medicinsk behandling. Derfor kan tidlige advarselstegn som f.eks. en leukemoid reaktion være uvurderlige.
Hypotension er et sent fund og kan være resistent over for vasopressorstøtte. Abdominale tegn varierer fra udspilning til generaliseret ømhed med vagtsomhed. Colonperforation ledsages normalt af abdominal stivhed, ufrivillig vagtsomhed, rebound ømhed og fraværende tarmlyde. Fri luft kan fremkomme på abdominale røntgenbilleder. Enhver mistanke om perforation i denne situation bør medføre øjeblikkelig kirurgisk konsultation. Døden indtræffer normalt, før der kan opstå fri luft og perforation. I en undersøgelse blev perforation i modsætning til det meste af den øvrige litteratur fundet sjælden (22).
Abdominal radiografi kan afsløre en dilateret colon (>7 cm i største diameter), hvilket stemmer overens med toksisk megakolon. Patienter med megakolon kan have en associeret tyndtarmsileus med dilateret tyndtarm på almindelige abdominale røntgenbilleder med luft-væske-niveauer, der efterligner tyndtarmsobstruktion eller iskæmi. CT uden kontrast og endoskopi kan hurtigt diagnosticere eller i det mindste kraftigt antyde fulminant C.difficile colitis. CT-scanningsresultater omfatter tegn på ascites, fortykkelse og/eller dilatation af colonvæggen. Disse fund kan være nyttige til at kategorisere colittens sværhedsgrad.
Mere aggressiv intervention hos patienter, der ikke reagerer medicinsk, herunder hurtig identifikation af patienter, der ikke reagerer på medicinsk behandling, er afgørende for et positivt resultat, og der bør foretages tidlig kirurgisk intervention i denne gruppe (figur 1-3).
Det er vigtigt, at alle, der er involveret i patientpleje på hospitaler, plejehjem og skilled nursing facilities, bliver uddannet om organismen og dens epidemiologi, rationelle tilgange til behandling og pleje af patienter med C. difficile-diarré, vigtigheden af håndvask mellem kontakt med patienter, brug af handsker ved pleje af en patient med C. difficile-diarré og undgåelse af unødvendig brug af antimikrobielle midler.
Konklusion
De seneste år har givet anledning til bekymring over stigende forekomst og alvorlige komplikationsrater af CDAD på nordamerikanske hospitaler (22,23). Canadian Medical Association journal offentliggjorde i 2004 en rapport om et udbrud af CDAD, der involverede flere hospitaler i Montreal, i detaljer. Indførelsen af nye hypervirulente og meget smitsomme stammer af C. difficile er blevet postuleret som den mulige årsag til udbruddet (24). En forringet infrastruktur, utilstrækkelig infektionsbekæmpelsespraksis, det stigende antal svækkede patienter, en aldrende befolkning og hypervirulente stammer blev alle anset for at være sandsynlige årsager til de seneste udbrud i Canada (25).
To epidemiologiske undersøgelser i USA og Canada (24,26) undersøgte uafhængigt af hinanden prøver af C. difficile og fandt, at en muteret version af den “vilde” stamme var ansvarlig for udbruddene i Quebec og for øgede CDAD-rater på hospitaler i USA i den seneste tid (22,23). Kliniske epidemiologer ved CDC undersøgte C. difficile-isolater fra hospitaler i USA med nylige (dvs. 2001-2004) udbrud af CDAD (22,23). Rapporten viser, at der er opstået en ny epidemisk stamme, “BI” (forskellig fra “J”-stammen fra 1989-1992), som kan være ansvarlig for den seneste stigning i antallet og den tilsyneladende sværhedsgrad af CDAD (26).
CDAD og colitis kan i de fleste tilfælde behandles ved indgift af metronidazol eller vancomycin. Hos nogle patienter udvikler der sig alvorlig livstruende toksicitet på trods af passende og rettidig medicinsk behandling, og det er nødvendigt med kirurgisk indgreb. Systemiske symptomer på infektion med C. difficile er rapporteret til ikke at stamme fra bakteriæmi, tarmperforation eller iskæmi, men fra toksininducerede inflammatoriske mediatorer frigivet fra colon (27-29). Tidlig kirurgisk indgreb bør anvendes i refraktære tilfælde af alvorlig sygdom. Kirurgisk indgreb er imidlertid langt fra ideelt og medfører en meget høj komplikationsrate og en betydelig risiko for dødelighed (22). Den fremtidige kliniske tilgang til behandling af nosokomial C. difficile colitis kan i sidste ende omfatte specifikke antitoksinhyperimmunoglobuliner og inhibitorer af den inflammatoriske kaskade (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Sekulær tendens i hospitalserhvervet Clostridium difficile-sygdom i USA; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotika-associeret colitis. In: Mandell G, Bennet JE, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases (principper og praksis for infektionssygdomme). 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarré: Patogenese, epidemiologi og behandling. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Historien om dens rolle som enterisk patogen og det nuværende vidensniveau om organismen. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosokomial erhvervelse af Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinalflora hos nyfødte spædbørn: Med en beskrivelse af en ny patogen anaerobe, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Behandling af Clostridium difficile-diarré og colitis. In: Wolfe MM, ed. Gastrointestinal farmakoterapi. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Risikofaktorer for Clostridium difficile-infektion. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Gastrointestinale infektioner: Diagnosis and Management: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rectal sparring ved antibiotika-associeret pseudomembranøs colitis: En prospektiv undersøgelse. Gastroenterology. 1982;83;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Ti års prospektiv overvågning af Clostridium difficile-associeret sygdom og behandling på Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospektivt randomiseret forsøg med metronidazol versus vancomycin for Clostridium-difficile-associeret diarré og colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamid-relateret toksisk megakolon ved Clostridium difficile-kolitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Adjunktiv intrakolonisk vancomycin ved svær Clostridium difficile-kolitis: case series and review of the literature. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intravenøs metronidazol til behandling af Clostridium difficile colitis. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Recidiverende Clostridium difficile-diarré: karakteristika for og risikofaktorer for patienter, der er indskrevet i et prospektivt, randomiseret, dobbeltblindet forsøg. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: en undervurderet og stigende årsag til død og komplikationer. Ann Surg. 2002;235;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile colitis: en stadig mere aggressiv iatrogen sygdom? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile-infektion på hospitaler: en storm under opsejling. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergens of an epidemic strain of Clostridium difficile in the United States, 2001-4: Potentiel rolle for virulensfaktorer og antimikrobielle resistensegenskaber. Infectious Diseases Society of America 42th Annual Meeting. Boston, MA, 30. september – 3. oktober 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokinrespons fra humane monocytter på Clostridium difficile-toksin A og toksin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Øget stof P-respons i dorsalrodsganglier, intestinale makrofager under Clostridium difficile toksin A enteritis hos rotter. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimulerer produktion af makrofag-inflammatorisk protein-2 i rottetarmens epitelceller. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Overlevelse af anti-Clostridium difficile bovint immunoglobulin koncentrat i det menneskelige mave-tarmkanalen. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenøs immunglobulinbehandling af svær Clostridium difficile colitis. Gut. 1997;41:366-70.