El XeF4 o Tetrafluoruro de Xenón es un compuesto químico formado por átomos de Xenón y Fluoruro. Es el primer compuesto binario descubierto en el mundo. Es un tipo de gas noble que tiene la ecuación química de
Xe +2 F2 -> XeF4
El XeF4 tiene un aspecto blanco sólido y tiene una densidad de 4,040 g cm-3 en forma sólida. En condiciones ordinarias, aparece como un cristalino incoloro. Tiene una temperatura sublime de 115,7 grados Celsius o 240,26 grados Fahrenheit. Al igual que los demás fluoruros de xenón, el tetrafluoruro de xenón tiene una formación exergónica. A temperatura y presión normales, se mantiene estable. Reacciona con el agua instantáneamente y libera oxígeno molecular, fluoruro de hidrógeno y gas xenón puro.
| Nombre de la molécula | Tetrafluoruro de xenón (XeF4) |
| Número de valencia Electrones en la molécula | 36 |
| Hibridación de XeF4 | Hibridación sp3d2 |
| Ángulos de enlace | 90 grados y 180 grados |
| Geometría molecular del XeF4 | Cuadrado plano |
Para conocer mejor sus propiedades físicas y químicas, hay que conocer su estructura de Lewis y su geometría molecular. Descubramos la estructura de Lewis del tetrafluoruro de xenón.
Para hacer la estructura de Lewis, necesitamos conocer los electrones de valencia del XeF4 para hacer su estructura y conocer la colocación de los átomos en la molécula.
Contenidos
XeF4 Electrones de valencia
En esta molécula tenemos un átomo de Xenón y cuatro de Flúor. Vamos a calcular los electrones de valencia de estos dos átomos para determinar el número total de electrones de valencia de XeF4.
Electrones de valencia del Xenón = 8
Electrones de valencia del Flúor = 7*4 ( como hay cuatro átomos de Flúor, lo multiplicaremos por 4)
Número total de electrones de valencia del Xef4: 8 + 7*4
: 8 + 28
: 36
Por tanto, hay un total de 36 electrones de valencia en el XeF4.
Estructura de Lewis del XeF4
Ahora que conocemos los electrones de valencia del tetrafluoruro de xenón, te será más fácil dibujar su estructura de Lewis. Esta estructura de puntos de Lewis es una representación pictórica de los electrones de valencia alrededor de los átomos individuales de una molécula junto con el enlace que forma.
Los enlaces en la estructura se muestran mediante líneas, mientras que los electrones que no participan en la formación del enlace se muestran como puntos. Los electrones que no forman ningún enlace se denominan electrones no enlazantes o pares de electrones solitarios.
Aquí como el Xenón es el átomo menos electronegativo, lo colocaremos en el centro y todos los demás átomos de flúor a su alrededor así:

Ahora que hemos colocado todos los átomos vamos a mostrar los enlaces entre cada átomo de Flúor y Xenón. Cada enlace en la molécula ocupa dos electrones, y como hay cuatro enlaces simples en esta molécula, se utilizan 8 electrones de los 36.
Comienza a colocar el resto de los electrones de valencia alrededor de los átomos. Cada átomo de flúor tendrá seis electrones de valencia a su alrededor, ya que se utilizó un electrón para hacer el enlace.
Podrías notar que ya hemos colocado 24 electrones de 28 alrededor de los átomos de flúor. Los restantes electrones no enlazantes o pares de electrones solitarios se colocarán en el xenón, ya que es una excepción a la regla del octeto.
Coloque estos dos pares de electrones no enlazantes en el xenón, y ahora tiene una estructura de Lewis donde hay dos pares de electrones solitarios en el xenón y seis electrones no enlazantes en cada átomo de flúor.
Hibridación del XeF4
Los orbitales del átomo central de Xenón se hibridan, lo que resulta en la formación de nuevos orbitales hibridados. El xenón tiene seis electrones en sus orbitales 5p y dos electrones en los orbitales 5s. No hay electrones en los orbitales d y f en el estado básico del xenón. Pero cuando este átomo está en estado excitado, dos electrones en los orbitales p pasan a los orbitales d; como resultado, hay cuatro electrones no apareados en total. De ellos, dos están en orbitales p, y los otros dos electrones no apareados están en orbitales d. Estos orbitales hibridados conducen a la hibridación sp3d2 en el XeF4.
Geometría molecular del XeF4
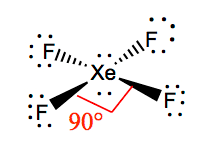
Es más fácil entender la geometría molecular de una molécula dada una vez que conocemos su estructura de Lewis. Como el xenón tiene dos pares de electrones solitarios, adoptará una estructura que ayude a estos pares solitarios a evitar las fuerzas de repulsión. Para mantener estas repulsiones al mínimo, los pares solitarios estarán en un plano perpendicular. Y como hay cuatro átomos de flúor, la molécula tendrá una disposición tal que su geometría molecular es cuadrangular. El XeF4 tiene una geometría electrónica octaédrica, por lo que la geometría molecular del tetrafluoruro de xenón es cuadrangular.

XeF4 Ángulos de enlace
Los ángulos de enlace de F-Xe-F son de 90 grados, y los pares solitarios tienen ángulos de 180 grados. Los átomos de flúor están situados a 90 grados entre sí, lo que da lugar a la distribución simétrica de los electrones en el plano de la molécula. Estos ángulos de enlace contribuyen a la formación de una geometría molecular cuadrada.
Polaridad del XeF4 – ¿Es el XeF4 polar o no polar?
Aunque los enlaces entre los átomos de xenón y flúor son polares, el XeF4 es una molécula no polar. ¿Se pregunta cómo? Todos los enlaces Xe-F están en oposición entre sí mutuamente, haciendo que la suma del momento dipolar sea cero. Como hay cuatro electrones en el átomo de xenón, que están localizados como pares de electrones no enlazados. Como la disposición global de los átomos y electrones en la molécula es tal que la suma vectorial de los dipolos es cero, XeF4 es una molécula no polar.
Observaciones finales
El tetrafluoruro de xenón es una de esas moléculas relativamente fáciles de entender. Su estructura de Lewis es una de las menos complicadas, ya que todos los átomos de flúor están dispuestos en el patrón simétrico. Los pares solitarios de la molécula están situados en un plano perpendicular en forma octaédrica para mantener sus fuerzas de repulsión al mínimo.
Para resumir esta entrada del blog, podemos decir que el XeF4 tiene 36 electrones de valencia. Tiene dos pares solitarios de electrones no enlazantes en el átomo central del Xenón. La molécula tiene una geometría electrónica octaédrica y una geometría molecular cuadrada. XeF4 es una molécula no polar y tiene hibridación sp3d2.