La inmunofluorescencia (IF) es un enfoque morfológico común utilizado para determinar la distribución de componentes subcelulares. En el ensayo de IF se requieren anticuerpos conjugados con colorantes fluorescentes. El anticuerpo reconoce específicamente el antígeno al unirse al epítopo de la diana, y el fluoróforo se detectará bajo un microscopio fluorescente. Por lo tanto, los componentes subcelulares pueden ser visualizados en un fondo oscuro. La IF también puede utilizarse como un método de análisis semicuantitativo alternativo para supervisar la expresión del interés.
Hay tres tipos de IF: IF directa, IF indirecta e IF combinada.
La IF directa utiliza un único anticuerpo primario que se conjuga con un colorante fluorescente.
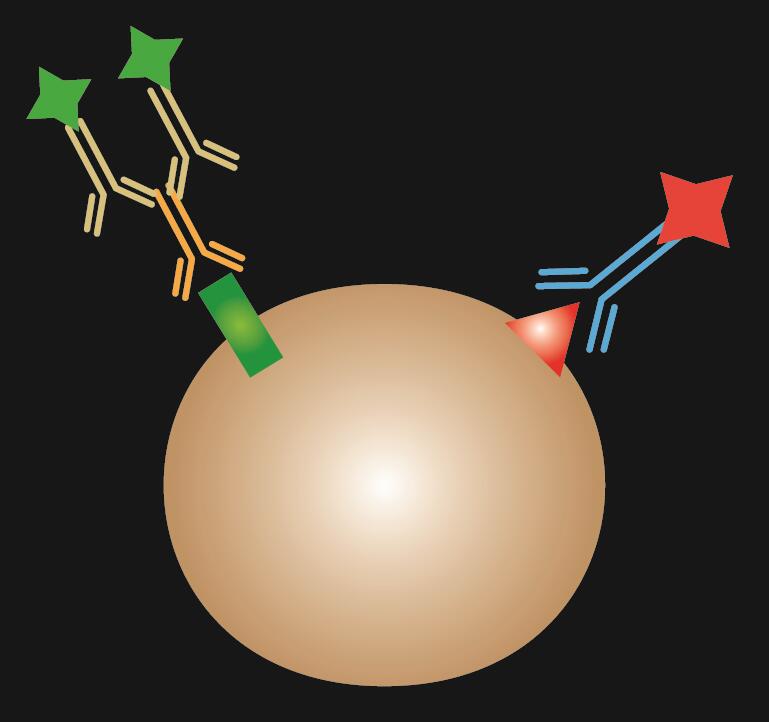
La IF indirecta utiliza dos anticuerpos para la tinción: un anticuerpo primario que se une específicamente al epítopo y un anticuerpo secundario emparejado conjugado con un colorante fluorescente.
La IF combinada es una combinación de tinción de IF directa e indirecta.
Tabla 1. Comparación de la IF directa, indirecta y combinada.
| Tipo de IF | Directa | Indirecta | Combinada |
|---|---|---|---|
| Diagrama esquemático | 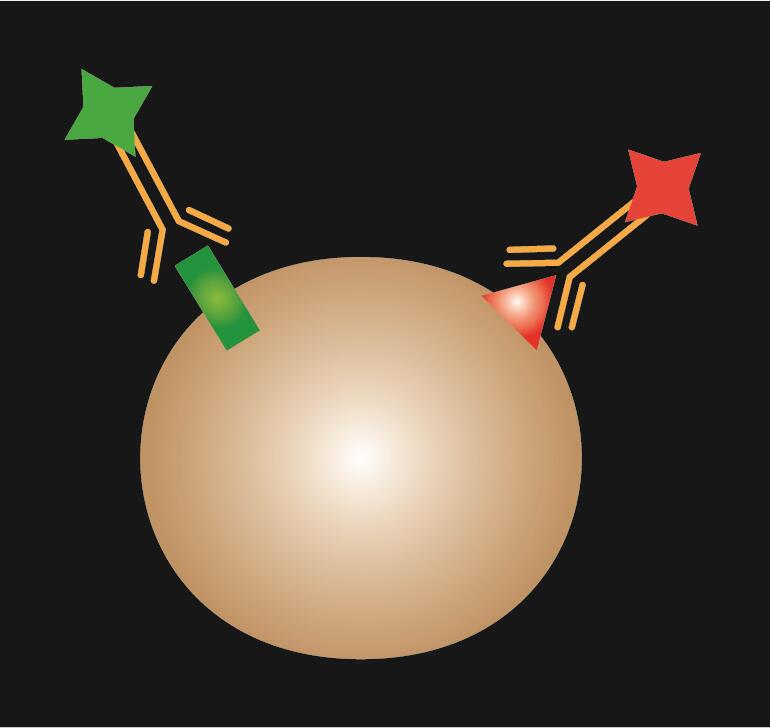 |
. 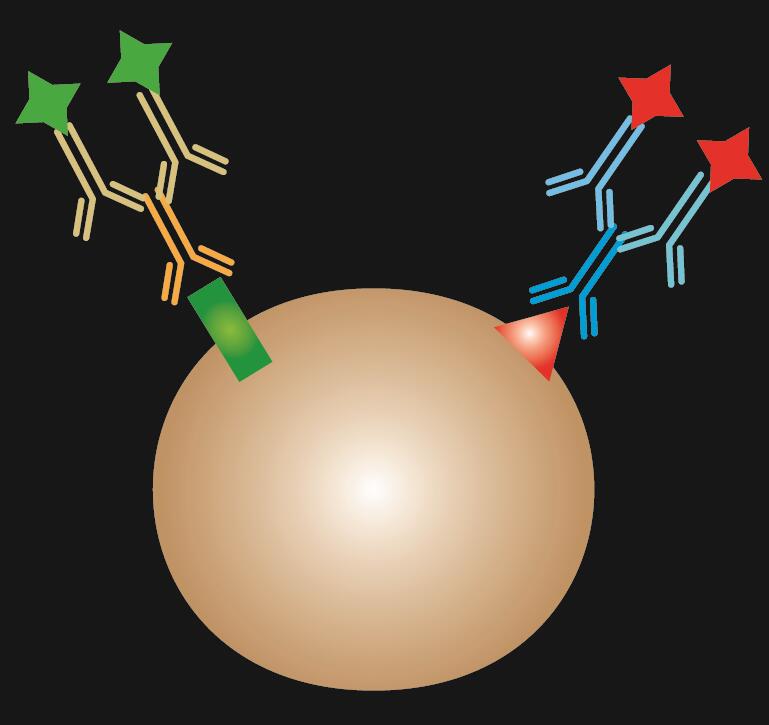 |
 |
| Ventajas |
|
|
|
| Desventajas |
|
|
|
Entre los tres tipos de IF, el método IF indirecto es el más popular.
El método de IF puede utilizarse en secciones de tejido, líneas celulares cultivadas y células individuales. El proceso de IF es similar al de la Inmunohistoquímica (IHC).
- Recogida y fijación de muestras
Las muestras deben fijarse rápidamente después de la extracción del tejido, y es mejor realizar la prefijación mediante infusión cardíaca con formaldehído al 4% o paraformaldehído en animales pequeños como los roedores. Se recomienda que los tejidos no tengan más de 10 mm de grosor y que el volumen del fijador sea al menos 15-20 veces mayor que el volumen del tejido. La fijación es muy importante para mantener la morfología y la estructura de la célula, así como la integridad del antígeno. Por lo tanto, las soluciones de fijación deben elegirse cuidadosamente según los diferentes antígenos y muestras de tejido.
Tabla 2. Estrategia de fijación para antígenos parciales.
| Antígeno | Solución de fijación | Condición de fijación |
|---|---|---|
| Más proteína | 95~100% alcohol 4% paraformaldehído |
3~10 min a 37℃ 4~24 hr a 4℃ |
| Enzima | Acetona | 15 min a RT |
| Hormona | Alcohol al 95% más ácido acético glacial al 1~5% | 30 min a 4℃ |
| Inmunoglobulina | Alcohol al 95% Carbono tetracloruro de carbono |
10 min a 37℃ y luego 15 min a 4℃ |
| Proteína fibrosa | 95% de alcohol más 1~5% de ácido acético glacial | 10 min a 37℃ luego 15 min a 4℃ |
| Virus | Acetona Tetracloruro de carbono Alcohol |
5~10 min a RT luego 30~60 min a 4℃ |
| Polisacáridos y bacterias | Acetona 10% formaldehído Metanol |
3~10 min a RT y luego 30~60 min a 4℃ |
| Lipoide | Formaldehído al 10% | 3~10 min a RT |
| Célula cultivada | Calentada al 4% de paraformaldehído | 15~20 min a RT |
- Deshidratación e incrustación
La deshidratación es necesaria en la preparación de secciones de tejido por las siguientes razones:
1. Sección de parafina: La parafina es inmiscible con el agua.
2. Sección congelada: Los cristales de hielo congelados destruirían la morfología de las células.
La deshidratación se realiza siempre sumergiendo el tejido en una solución de etanol de gradiente creciente o en una solución de sacarosa.
Posteriormente, las muestras de tejido pueden incrustarse añadiendo cera de parafina fundida para las secciones de parafina, mientras que el compuesto OCT se añade para las secciones congeladas. Este paso proporciona la dureza adecuada para las muestras de tejido blando y permite que el tejido se corte fácilmente.
- Sección y tinción
Los tejidos embebidos pueden seccionarse en rodajas finas con microtomo o microtomo de congelación. El grosor de los cortes debe decidirse en función del diámetro celular y del objetivo del ensayo de IF. Los cortes más finos (≤10 μm) se sugieren para ser montados directamente en portaobjetos adhesivos antes de la tinción, ya que son fáciles de estacar en los múltiples pasos de lavado. Los cortes más gruesos (10~30 μm) permiten obtener mejores imágenes con el método de flotación libre, ya que el anticuerpo primario puede penetrar en ambos lados del corte. Y las secciones de flotación libre se montan en portaobjetos después de la tinción. Las secciones de flotación libre de tejidos pequeños, como la raíz de los ganglios dorsales (DRG) de ratón, son difíciles de realizar y es fácil perder la muestra. Por lo tanto, se recomienda el método de la sección en barra para algunas muestras de tejidos pequeños. Los pasos de tinción deben realizarse en la oscuridad cuando se trate de un anticuerpo conjugado con un colorante fluorescente.
Llegar a los protocolos de IF:
- Sección en barra
- Sección de flotación libre
- Células cultivadas
- Imagen y análisis
La señalización positiva se virtualiza bajo un microscopio fluorescente en un fondo oscuro. La localización de interés se determina normalmente mediante la co-tinción de una proteína de la que se conoce la localización. Alternativamente, la cantidad de células positivas o la intensidad de fluorescencia de la señalización positiva podría medirse para un análisis cuantitativo. Por ejemplo, la intensidad de fluorescencia más fuerte se refiere a una expresión relativamente alta de la proteína objetivo.
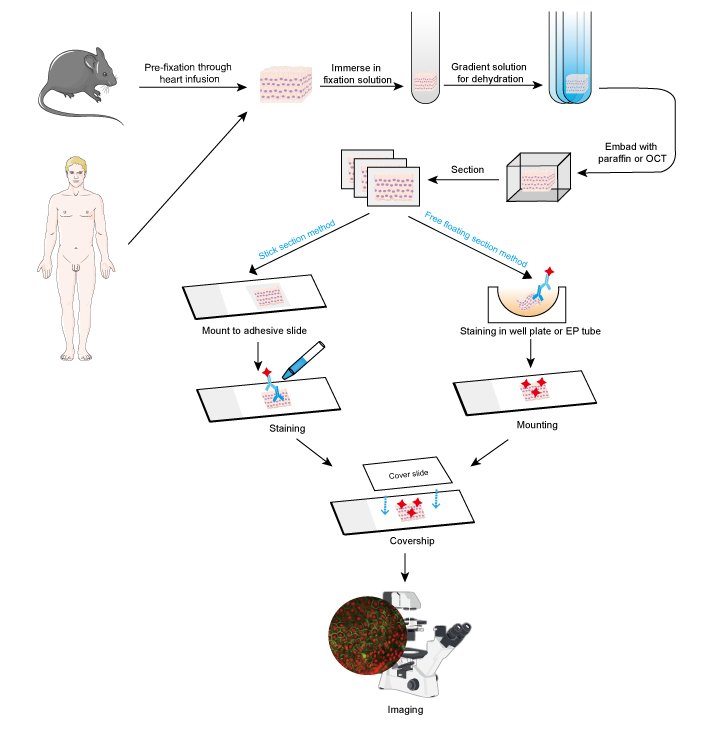
Figura 1. Flujo de trabajo de la IF en secciones de tejido.
La IF y la IHC son dos enfoques potentes para el análisis de la morfología con importantes aplicaciones de diagnóstico y pronóstico. Hay que tener en cuenta varias diferencias en su investigación:
Tabla 3. Comparación entre IHC e IF
| IHC | IF | |
|---|---|---|
| Método de etiquetado | Cromogénico | Fluorescente |
| Paso de procesamiento | Más como sustrato requerido | Menos |
| Imagen |
|
|
| Microscopio | Microscopio de luz | Microscopio de fluorescencia |
| Estabilidad | Estable durante años | Menos estable debido al fotoblanqueo |
| Ejemplo (hipocampo de ratón) |
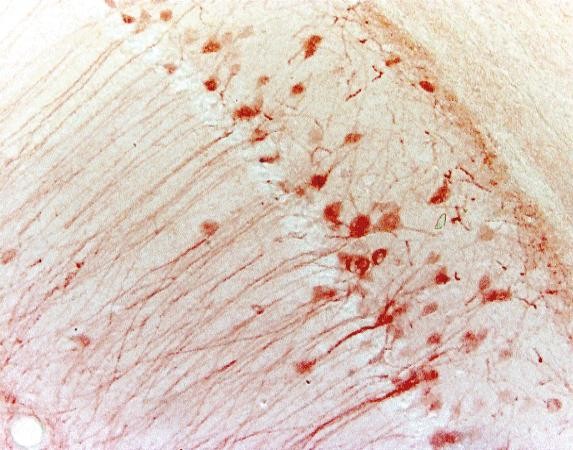 |
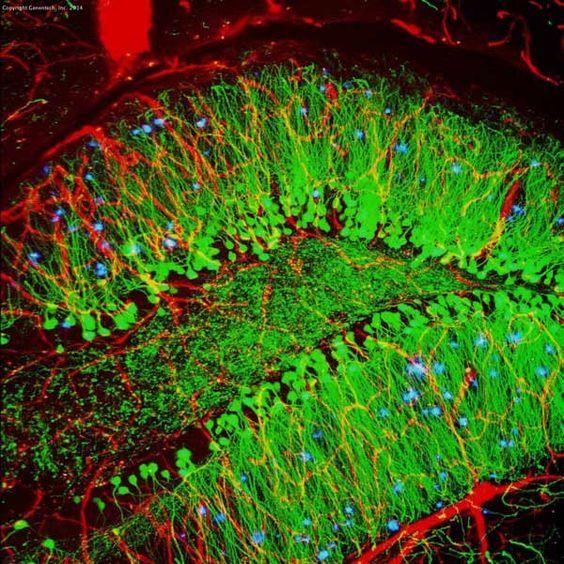 |