La vía de apoptosis de la perforina/granzima es la principal vía de señalización utilizada por los linfocitos citotóxicos para eliminar las células infectadas por virus y/o transformadas. Los estudios realizados en ratones con genes alterados indican que la perforina, en combinación con la granzima, podría inducir la apoptosis. Es vital para la función de efector citotóxico y tiene un papel indispensable, pero no definido, en la apoptosis mediada por la granzima.
Perforina y granzima
La perforina es una proteína formadora de poros y también se conoce como toxinas de gránulos citoplasmáticos. La granzima es una familia de proteasas de serina estructuralmente relacionadas que se almacenan dentro de los gránulos citotóxicos de los linfocitos citotóxicos (CL). La perforina y la granzima inducen la apoptosis de las células diana de forma cooperativa (Figura 1). La granzima es necesaria para desencadenar la apoptosis de las células diana, pero depende de que la perforina la entregue adecuadamente. Tanto la perforina como la granzima se unen a la superficie de la célula diana como parte de un único complejo macromolecular asociado a la serglicina, lo que disminuye aún más la probabilidad de difusión pasiva de las granzimas.
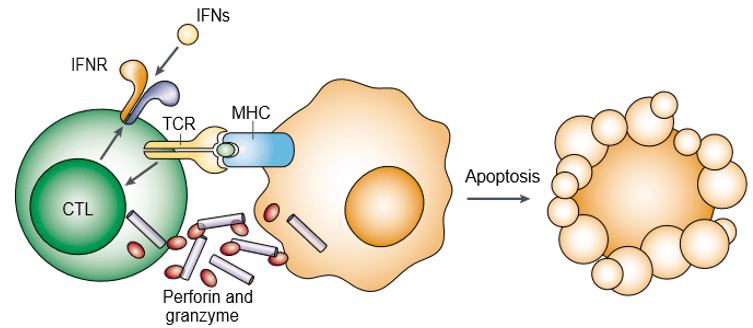
Figura 1. La perforina y la granzima inducen la apoptosis de las células diana de forma cooperativa.
En los seres humanos, existen las granzimas A, B, H, K y M, mientras que en los ratones existen las granzimas A, B, C, D, E, F, G, K, L, M y N. La granzima A (GrA) y la granzima B (GrB) son las más abundantes y han sido las más estudiadas. Las funciones de las granzimas A y B en la inducción de la apoptosis de la célula diana se han investigado ampliamente in vitro, y se conocen mejor que el papel de la perforina a nivel molecular.
Proceso y regulación de la vía de la apoptosis de la perforina/granzima
Una vez secretadas por los linfocitos citotóxicos, las granzimas entran en las células diana, lo que constituye un paso vital en la muerte celular. Las principales proteínas líticas empaquetadas dentro de los gránulos son diferentes granzimas y la proteína formadora de poros perforina, que facilita la internalización de las granzimas por parte de las células.
La granzima B desencadena principalmente la activación de las caspasas de forma indirecta, en lugar de hacerlo mediante el procesamiento directo de las caspasas. Lo consigue activando directamente a los miembros pro-apoptóticos «sólo BH3» de la familia BCL-2, como el agonista de la muerte con dominio de interacción BH3 (Bid). Bid, junto con las proteínas proapoptóticas de la familia BCL-2, Bax y/o Bak, provoca la fuga de mediadores mitocondriales proapoptóticos, como el citocromo c, al citosol. La liberación de citocromo c activa la pro caspasa-9 y, al unirse al factor activador de la proteasa apoptótica 1 (Apaf-1), la pro caspasa-9 se convierte en la caspasa-9 madura, que continúa formando el apoptosoma y activa la caspasa-3 que se encuentra aguas abajo. La caspasa-3 activada es capaz de escindir sustratos específicos como el ICAD (inhibidor de la DNasa activado por la caspasa, CAD), permitiendo que el CAD se transloque al núcleo para fragmentar el ADN. Además de Bid, la granzima B puede inactivar Mcl-1, que es un miembro de la familia antiapoptótica Bcl-2, para liberar la proteína pro-antiapoptótica Bim de la familia Bcl-2 en la membrana mitocondrial externa. Y la granzima B también puede mediar el efector caspasa-3 y el iniciador caspasa-8 para regular la vía de la apoptosis.
A diferencia de la granzima B, la granzima M no depende de la mitocondria para regular, pero la granzima M puede activar la granzima B mediante la escisión del inhibidor de la proteína 9 (PI-9), que es el inhibidor de la granzima B. La granzima M también puede escindir directamente el ICAD para desencadenar la DAO como la granzima B.
La granzima A induce la pérdida del potencial de la membrana interna mitocondrial y la liberación de especies reactivas de oxígeno (ROS). Genera mellas en el ADN monocatenario, en lugar de fragmentos de ADN oligonucleosómico. En respuesta a las ROS, el complejo SET asociado al RE, que incluye SET, Ape1, pp32, HMG2, NM23-H1 y TREX1, se traslada al núcleo, donde la granzima A escinde tres miembros del complejo SET que participan en la reparación del ADN: HMG2, Ape1 y SET.
La vía de la apoptosis de la perforina/granzima en la enfermedad
Los estudios en ratones con genes interrumpidos indican claramente que la vía de la perforina está implicada íntimamente en la defensa contra los patógenos virales y las células transformadas. Pero también se han demostrado in vivo funciones insospechadas de la perforina como mediador crucial de la vigilancia inmunitaria de las células transformadas espontáneamente y en la regulación de la homeostasis de las células B y la memoria de las células T. Paradójicamente, la perforina desempeña un papel decisivo en la patogénesis de ciertos modelos de enfermedades autoinmunes, como la diabetes dependiente de la insulina en ratones diabéticos no obesos (NOD), pero podría suprimir otras enfermedades autoinmunes, como la encefalomielitis autoinmune experimental (EAE).
Se están determinando las vías de apoptosis de la perforina/granzima que regulan la polarización y exocitosis de los gránulos, y estas vías podrían verse alteradas por la interacción de las células cancerosas con algunos linfocitos citotóxicos. Los recientes descubrimientos de que la entrada de la granzima en las células diana implica la unión a receptores de membrana específicos y de que algunos tumores sintetizan inhibidores de la serina proteasa que pueden neutralizar las granzimas han indicado nuevas formas potenciales en las que los tumores podrían escapar del ataque inmunitario.