Nome genérico: loperamide hydrochloride
Dosage Form: capsules
Medically revisado por Drugs.com. Última atualização em 22 de janeiro de 2021.
- Visão geral
- Efeitos secundários
- Dosagem
- Profissional
- Interacções
- Outros
- Descrição de Imodium
- Imodium – Clinical Pharmacology
- Indicações e Uso para Imodium
- Contraindicações
- Avisos
- Precauções
- Geral
- Informação para pacientes
- Interacções com Drogas
- Carcinogênese, mutagênese, comprometimento da fertilidade
- Gravidez
- Gravidez Categoria C
- Mães amamentadoras
- Pediatria
- Reações adversas
- Dados de ensaio clínicos
- Pós – experiência de marketing
- Abuso e dependência de drogas
- Abuso
- Dependência
- Oversação
- Dose e Administração de Imodium
- Diarréia Aguda
- Diarreia Crônica
- Crianças menores de 2 anos
- Idosos
- Imparidade renal
- Imparidade hepática
- Como é fornecido o Imodium
- Perguntas mais frequentes
- Mais sobre Imodium (loperamide)
- Recursos de consumo
- Recursos profissionais
- Outras Formulações
- Guias de tratamento relacionadas
Descrição de Imodium
Imodium® (loperamide hydrochloride), 4-(p-clorofenil)-4-hidroxi-N,N-dimetil-a,a-difenil-1-piperidinebutamida monoidrocloridrato, é um antidiarréico sintético para uso oral.
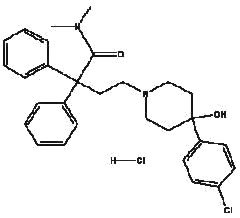
Imodium® está disponível em cápsulas de 2mg.
Os ingredientes inativos são: Lactose, amido de milho, talco, e estearato de magnésio. As cápsulas de Imodium® contêm FD&C Yellow No. 6.
Imodium – Clinical Pharmacology
Estudos in vitro e animais mostram que o Imodium® (cloridrato de loperamida) age retardando a motilidade intestinal e afetando o movimento da água e eletrólitos através do intestino. A loperamida liga-se ao receptor opiáceo na parede do intestino. Consequentemente, inibe a libertação de acetilcolina e prostaglandinas, reduzindo assim a peristaltismo e aumentando o tempo de trânsito intestinal. A loperamida aumenta o tom do esfíncter anal, reduzindo assim a incontinência e a urgência.
No homem, Imodium® prolonga o tempo de trânsito do conteúdo intestinal. Reduz o volume fecal diário, aumenta a viscosidade e a densidade aparente e diminui a perda de líquidos e eletrólitos. A tolerância ao efeito antidiarréico não foi observada. Estudos clínicos indicaram que a semi-vida aparente de eliminação da loperamida no homem é de 10,8 horas com um intervalo de 9,1 – 14,4 horas. Os níveis plasmáticos do medicamento inalterado permanecem abaixo de 2 nanogramas por mL após a ingestão de uma cápsula de 2mg de Imodium®. Os níveis plasmáticos são mais altos aproximadamente cinco horas após a administração da cápsula e 2,5 horas após a administração do líquido. Os níveis plasmáticos máximos de loperamida foram semelhantes para ambas as formulações. A eliminação da loperamida ocorre principalmente por N-demetilação oxidativa. Pensa-se que o citocromo P450 (CYP450) isozimas, CYP2C8 e CYP3A4, desempenham um papel importante no processo de loperamida N-demetilação desde que a quercetina (inibidor do CYP2C8) e o cetoconazol (inibidor do CYP3A4) inibiram significativamente o processo de N-demetilação in vitro em 40% e 90%, respectivamente. Além disso, o CYP2B6 e o CYP2D6 parecem desempenhar um papel menor na desmetilação da N-demetilação por loperamida. A excreção da loperamida inalterada e seus metabólitos ocorre principalmente através das fezes. Nos pacientes em que os parâmetros bioquímicos e hematológicos foram monitorizados durante os ensaios clínicos, não se observaram tendências para anormalidades durante a terapia com Imodium®. Da mesma forma, urinóis, eletrocardiograma e exames oftalmológicos clínicos não mostraram tendências à anormalidade.
Indicações e Uso para Imodium
Imodium® (cloridrato de loperamida) é indicado para o controle e alívio sintomático da diarréia aguda inespecífica e da diarréia crônica associada à doença inflamatória intestinal. Imodium® também é indicado para reduzir o volume de descarga de ileostomias.
Contraindicações
Imodium® está contra-indicado em pacientes com hipersensibilidade conhecida ao cloridrato de loperamida ou a qualquer um dos excipientes.
Imodium is contraindicated in patients with abdominal pain in the absence of diarrhea.
Imodium is not recommended in infants below 24 months of age.
O sódio não deve ser usado como terapia primária:
– em pacientes com disenteria aguda, que é caracterizada por sangue nas fezes e febre alta, – em pacientes com colite ulcerativa aguda, – em pacientes com enterocolite bacteriana causada por organismos invasivos incluindo Salmonella, Shigella e Campylobacter, – em pacientes com colite pseudomembranosa associada ao uso de antibióticos de amplo espectro.
Avisos
Esgotamento dos glúidos e eletrólitos freqüentemente ocorrem em pacientes que têm diarréia. Nesses casos, a administração de líquidos e eletrólitos apropriados é muito importante. O uso de Imodium® não exclui a necessidade de terapia apropriada com fluido e eletrólitos.
Em geral, o Imodium não deve ser usado quando a inibição do peristaltismo deve ser evitada devido ao possível risco de seqüelas significativas incluindo íleo, megacólon e megacólon tóxico. O Imodium deve ser descontinuado imediatamente quando a constipação, distensão abdominal ou íleo se desenvolvem.
O tratamento da diarréia com Imodium é apenas sintomático. Sempre que uma etiologia subjacente puder ser determinada, tratamento específico deve ser dado quando apropriado (ou quando indicado).
Patientes com AIDS tratados com Imodium para diarréia devem ter a terapia interrompida nos primeiros sinais de distensão abdominal. Houve relatos isolados de megacólon tóxico em pacientes com AIDS com colite infecciosa de patógenos virais e bacterianos tratados com cloridrato de loperamida.
Imodium® deve ser usado com especial cuidado em crianças pequenas devido à maior variabilidade de resposta nesta faixa etária. A desidratação, particularmente em crianças mais novas, pode influenciar ainda mais a variabilidade da resposta ao Imodium®.
Precauções
Geral
Reacções alérgicas extremamente raras, incluindo anafilaxia e choque anafiláctico, foram relatadas. Na diarréia aguda, se não for observada melhora clínica em 48 horas, a administração de Imodium® (cloridrato de loperamida) deve ser interrompida e os pacientes devem ser aconselhados a consultar seu médico. Embora não haja dados farmacocinéticos disponíveis em pacientes com comprometimento hepático, o Imodium deve ser usado com cautela em tais pacientes devido à redução do metabolismo de primeira passagem. Pacientes com disfunção hepática devem ser monitorados de perto para sinais de toxicidade do SNC. Não há dados farmacocinéticos disponíveis em pacientes com insuficiência renal. Como foi relatado que a maioria da droga é metabolizada e os metabólitos ou a droga inalterada é excretada principalmente nas fezes, não são necessários ajustes de dosagem em pacientes com insuficiência renal. Não foram realizados estudos formais para avaliar a farmacocinética da loperamida em indivíduos idosos. Entretanto, em dois estudos que inscreveram pacientes idosos, não houve grandes diferenças na disposição do medicamento em pacientes idosos com diarréia em relação a pacientes jovens.
Informação para pacientes
Patientes devem ser aconselhados a verificar com seu médico se a diarréia não melhora em 48 horas ou se eles notam sangue nas fezes, desenvolvem febre ou desenvolvem distensão abdominal. Cansaço, tonturas ou sonolência podem ocorrer no quadro de síndromes de diarréia tratadas com Imodium. Portanto, é aconselhável ter cuidado ao conduzir um carro ou ao operar máquinas. (ver Reacções adversas).
Interacções com Drogas
Dados não clínicos mostraram que a loperamida é um substrato de P-glicoproteína. A administração concomitante de loperamida (16 mg dose única) com uma dose única de 600 mg de quinidina ou ritonavir, ambos inibidores da glicoproteína P, resultou em um aumento de 2 a 3 vezes nos níveis plasmáticos de loperamida. Devido ao potencial de aumento dos efeitos centrais quando a loperamida é coadministrada com quinidina e com ritonavir, deve-se ter cuidado quando a loperamida é administrada na dose recomendada (2 mg, até 16 mg de dose máxima diária) com inibidores de P-glicoproteína.
Quando uma dose única de 16 mg de loperamida é coadministrada com uma dose única de 600 mg de saquinavir, a loperamida diminuiu a exposição à saquinavir em 54%, o que pode ser de relevância clínica devido à redução da eficácia terapêutica da saquinavir. O efeito da saquinavir sobre a loperamida é de menor importância clínica. Portanto, quando a loperamida é administrada com saquinavir, a eficácia terapêutica da saquinavir deve ser acompanhada de perto.
Carcinogênese, mutagênese, comprometimento da fertilidade
Em um estudo de 18 meses com doses orais de até 40 mg/kg/dia (21 vezes a dose máxima humana de 16 mg/dia, com base em uma comparação da área de superfície corporal), não houve evidência de carcinogênese.
Loperamida não foi genotóxica no teste Ames, o cromoteste SOS em E. coli, o teste letal dominante em ratos fêmeas, ou o ensaio de transformação de células embrionárias de camundongos.
Fertilidade e desempenho reprodutivo foi avaliado em ratos usando doses orais de 2,5, 10 e 40 mg/kg/dia (somente fêmeas) em um segundo estudo. A administração oral de 20 mg/kg/dia (aproximadamente 11 vezes a dose humana baseada na comparação da área de superfície corporal) e maior produção de forte comprometimento da fertilidade feminina. O tratamento de ratos fêmeas com até 10 mg/kg/dia por boca (aproximadamente 5 vezes a dose humana baseada na comparação da área de superfície corporal) não teve efeito sobre a fertilidade. O tratamento de ratos machos com 40 mg/kg/dia por via oral (aproximadamente 21 vezes a dose humana baseada na comparação da área de superfície corporal) produziu prejuízo da fertilidade masculina, enquanto que a administração de até 10 mg/kg/dia (aproximadamente 5 vezes a dose humana baseada na comparação da área de superfície corporal) não teve efeito.
Gravidez
Efeitos Teratogênicos
Gravidez Categoria C
Estudos de teratologia têm sido realizados em ratos usando doses orais de 2,5, 10 e 40 mg/kg/dia, e em coelhos usando doses orais de 5, 20 e 40 mg/kg/dia. Esses estudos não revelaram evidências de comprometimento da fertilidade ou danos ao feto em doses de até 10 mg/kg/dia em ratos (5 vezes a dose humana baseada na comparação da área de superfície corporal) e 40 mg/kg/dia em coelhos (43 vezes a dose humana baseada na comparação da área de superfície corporal). O tratamento de ratos com 40 mg/kg/dia por boca (21 vezes a dose humana baseada na comparação da área de superfície corporal) produziu um comprometimento acentuado da fertilidade. Os estudos não produziram evidências de atividade teratogênica. Não existem estudos adequados e bem controlados em mulheres grávidas. A loperamida só deve ser usada durante a gravidez se o benefício potencial justificar o risco potencial para o feto.
Efeitos não-teratogênicos
Em um estudo de reprodução peri- e pós-natal em ratos, a administração oral de 40 mg/kg/dia produziu prejuízo do crescimento e sobrevivência da prole.
Mães amamentadoras
Pequenas quantidades de loperamida podem aparecer no leite materno humano. Portanto, o Imodium não é recomendado durante a amamentação.
Pediatria
Veja a seção “Avisos” para informações sobre a maior variabilidade de resposta nesta faixa etária. Em caso de superdosagem acidental de Imodium® por crianças, veja a seção “Overdosage” para sugestões de tratamento.
Reações adversas
Dados de ensaio clínicos
Os efeitos adversos relatados durante as investigações clínicas de Imodium® (cloridrato de loperamida) são difíceis de distinguir dos sintomas associados com a síndrome diarréica. As experiências adversas registradas durante os estudos clínicos com Imodium® foram geralmente de natureza menor e autolimitada. Elas foram mais comumente observadas durante o tratamento de diarréia crônica.
Os eventos adversos relatados são resumidos independentemente da avaliação da causalidade dos investigadores.
1) Eventos adversos de 4 estudos controlados por placebo em pacientes com diarréia aguda
Os eventos adversos com incidência de 1.0% ou mais, que foram relatados pelo menos com a mesma freqüência em pacientes com cloridrato de loperamida que com placebo, são apresentados na tabela abaixo.
| Acute Diarrhea | ||
|---|---|---|
| Loperamide Hydrochloride | Placebo | |
| Não. de pacientes tratados | 231 | 236 |
| Gastrointestinal AE% | > | |
| Constipation | 2,6% | 0.8% |
Os eventos adversos com incidência de 1,0% ou maior, que foram mais frequentemente relatados em pacientes com placebo do que com cloridrato de loperamida, foram: boca seca, flatulência, cólica abdominal e cólica.
2) Os eventos adversos de 20 estudos controlados por placebo em pacientes com diarréia crônica
Os eventos adversos com incidência de 1,0% ou maior, que foram relatados pelo menos com a mesma freqüência em pacientes com cloridrato de loperamida que com placebo, são apresentados abaixo na tabela abaixo.
| Diarreia Crônica | ||
|---|---|---|
| Cloridrato de Loperamida | Placebo | |
| Não. de pacientes tratados | >285 | 277 |
| Gastrointestinal AE% | ||
| Constipation | 5.3% | >0,0% |
| Sistema nervoso central e periférico AE% | > | > |
| >Tonturas | 1,4% | 0,7% |
>
Os eventos adversos com incidência de 1.0% ou maior, que foram mais frequentemente relatados em pacientes com placebo do que com cloridrato de loperamida: náuseas, vômitos, dor de cabeça, meteorismo, dor abdominal, cólica e cólica abdominal.
3) Os eventos adversos de setenta e seis estudos controlados e não controlados em pacientes com diarréia aguda ou crônica
Os eventos adversos com incidência de 1.0% ou mais em pacientes de todos os estudos são apresentados na tabela abaixo.
| Diarreia Aguda | Diarreia Crônica | Todos os estudos * | |
|---|---|---|---|
| *Todos os pacientes de todos os estudos, incluindo aqueles em que não foi especificado se os eventos adversos ocorreram em pacientes com diarréia aguda ou crônica. | |||
| Não. de pacientes tratados | 1913 | 1371 | 3740 |
| Gastrointestinal AE% | > | ||
| Nausea | 0,7% | 3,2% | 1.8% |
| Constipação | 1,6% | 1,9% | 1,7% |
| Cólicas abdominais | 0.5% | 3,0% | 1,4% |
Pós – experiência de marketing
Foram relatados os seguintes eventos adversos:
Desordens da pele e tecido subcutâneo
Rash, prurido, urticária, angioedema e casos extremamente raros de erupção bolhosa incluindo eritema multiforme, Síndrome de Stevens-Johnson e Necrólise Epidérmica Tóxica foram relatadas com o uso de Imodium
Desordens do sistema imunológico
Ocorrências isoladas de reacções alérgicas e, em alguns casos, foram relatadas reacções de hipersensibilidade graves, incluindo choque anafilático e reacções anafilactóides com o uso de Imodium.
Desordens gastrointestinais
Boca seca, dor abdominal, distensão ou desconforto, náuseas, vómitos, flatulência, dispepsia, obstipação, íleo paralítico, megacólon, incluindo megacólon tóxico (ver Contra-indicações e Avisos).
Desordens renais e urinárias
Retenção urinária
Desordens do sistema nervoso
Sonolência, tonturas
Desordens gerais e condições administrativas do local
Cansaço
Um número de eventos adversos relatados durante as investigações clínicas e experiência pós-comercialização com loperamida são sintomas frequentes da síndrome diarréica subjacente (dor/discomforto abdominal, náuseas, vômitos, boca seca, cansaço, sonolência, tontura, prisão de ventre e flatulência). Estes sintomas são frequentemente difíceis de distinguir dos efeitos indesejáveis das drogas.
Abuso e dependência de drogas
Abuso
Um estudo clínico específico concebido para avaliar o potencial de abuso da loperamida em doses elevadas resultou num achado de potencial de abuso extremamente baixo.
Dependência
Estudos em macacos dependentes de morfina demonstraram que o cloridrato de loperamida em doses superiores às recomendadas para humanos impediram sinais de retirada de morfina. Entretanto, em humanos, o teste da pupila de desafio de naloxona, que quando positivo indica efeitos opiáceos, realizado após uma única dose alta, ou após mais de dois anos de uso terapêutico do Imodium® (cloridrato de loperamida), foi negativo. Imodium® (loperamida formulada com estearato de magnésio) administrado oralmente é altamente insolúvel e penetra mal no SNC.
Oversação
Em casos de superdosagem, (incluindo superdosagem relativa devido a disfunção hepática), pode ocorrer retenção urinária, íleo paralítico e depressão do SNC. As crianças podem ser mais sensíveis aos efeitos do SNC que os adultos. Ensaios clínicos demonstraram que uma lama de carvão ativado administrada prontamente após a ingestão de cloridrato de loperamida pode reduzir a quantidade de droga que é absorvida na circulação sistêmica em até nove vezes. Se o vômito ocorrer espontaneamente após a ingestão, um slurry de 100 gms de carvão ativado deve ser administrado oralmente assim que os fluidos possam ser retidos.
Se o vômito não tiver ocorrido, a lavagem gástrica deve ser realizada seguida pela administração de 100 gms do slurry de carvão ativado através do tubo gástrico. No caso de superdosagem, os pacientes devem ser monitorados para sinais de depressão do SNC por pelo menos 24 horas.
Se ocorrerem sintomas de superdosagem, naloxona pode ser administrada como antídoto. Se responsivo à naloxona, sinais vitais devem ser monitorados cuidadosamente para a recorrência dos sintomas de overdose de drogas por pelo menos 24 horas após a última dose de naloxona.
Em vista da ação prolongada da loperamida e a curta duração (uma a três horas) da naloxona, o paciente deve ser monitorado de perto e tratado repetidamente com naloxona como indicado. Como relativamente pouco fármaco é excretado na urina, não se espera que a diurese forçada seja eficaz para a hiperdosagem de Imodium® (cloridrato de loperamida).
Em ensaios clínicos um adulto que tomou três doses de 20mg num período de 24 horas teve náuseas após a segunda dose e vomitou após a terceira dose. Em estudos destinados a examinar o potencial de efeitos colaterais, a ingestão intencional de até 60 mg de cloridrato de loperamida em uma única dose para indivíduos saudáveis resultou em nenhum efeito adverso significativo.
Dose e Administração de Imodium
(1 cápsula = 2 mg)
Patientes devem receber fluido e reposição eletrolítica adequados conforme necessário.
Diarréia Aguda
Adultos: A dose inicial recomendada é de 4mg (duas cápsulas) seguida de 2 mg (uma cápsula) após cada fezes não formadas. A dose diária não deve exceder 16mg (oito cápsulas). A melhora clínica é geralmente observada em 48 horas.
Crianças: Em crianças de 2 a 5 anos de idade (20 kg ou menos), a formulação líquida não prescrita (Imodium® A-D 1 mg/7,5 mL) deve ser usada; para idades entre 6 a 12 anos, podem ser usadas Cápsulas Imodium® ou Imodium® A-D Líquido. Para crianças de 2 a 12 anos de idade, o seguinte horário para cápsulas ou líquido normalmente irá preencher os requisitos de dosagem inicial:
Primeiro Dia de Dose Recomendada
Dois a cinco anos: 1 mg d.i.d. (3mg dose diária) (13 a 20 kg)
Seis a oito anos: 2 mg d.i.d. (4mg dose diária) (20 a 30 kg)
Oito a doze anos: 2mg d.i.d. (6mg dose diária) (maior que 30 kg)
Dose Diária Posterior Recomendada
Dose Diária Seguindo o primeiro dia de tratamento, recomenda-se que as doses posteriores de Imodium® (1 mg/10 kg de peso corporal) sejam administradas somente após uma fezes soltas. A dose diária total não deve exceder as doses recomendadas para o primeiro dia.
Diarreia Crônica
Crianças: Embora Imodium® tenha sido estudado em um número limitado de crianças com diarréia crônica; a dose terapêutica para o tratamento da diarréia crônica em uma população pediátrica não foi estabelecida.
Crianças: A dose inicial recomendada é de 4 mg (duas cápsulas) seguida de 2 mg (uma cápsula) após cada fezes não formadas até que a diarréia seja controlada, após o que a dosagem de Imodium® deve ser reduzida para atender às necessidades individuais. Quando a dose diária ideal tiver sido estabelecida, esta quantidade pode então ser administrada como dose única ou em doses divididas.
A dose média diária de manutenção em ensaios clínicos foi de 4 a 8 mg (duas a quatro cápsulas). Uma dose de 16 mg (oito cápsulas) raramente foi excedida. Se a melhora clínica não for observada após o tratamento com 16 mg por dia durante pelo menos 10 dias, é improvável que os sintomas sejam controlados por administração posterior. A administração de Imodium® pode ser continuada se a diarréia não puder ser controlada adequadamente com dieta ou tratamento específico.
Crianças menores de 2 anos
O uso de Imodium em crianças menores de 2 anos não é recomendado. Tem havido relatos raros de íleo paralítico associado à distensão abdominal. A maioria desses relatos ocorreu no contexto de disenteria aguda, overdose e com crianças muito pequenas com menos de dois anos de idade.
Idosos
Não foram realizados estudos farmacocinéticos formais em indivíduos idosos. Entretanto, não houve grandes diferenças relatadas na disposição dos medicamentos em pacientes idosos com diarréia em relação aos pacientes jovens. Nenhum ajuste na dosagem é necessário em idosos.
Imparidade renal
Não há dados farmacocinéticos disponíveis em pacientes com insuficiência renal. Como os metabólitos e a droga inalterada são principalmente excretados nas fezes, nenhum ajuste de dosagem é necessário para pacientes com insuficiência renal (ver seção PRECAUÇÕES).
Imparidade hepática
Embora não haja dados farmacocinéticos disponíveis em pacientes com insuficiência hepática, o imodium deve ser usado com cautela em tais pacientes por causa da redução do metabolismo de primeira passagem. (ver Precauções).
Como é fornecido o Imodium
Cápsulas – cada cápsula contém 2 mg de cloridrato de loperamida. As cápsulas têm um corpo verde claro e uma tampa verde escuro com “JANSSEN” impressa num segmento e “Imodium” no outro segmento. As cápsulas de Imodium® são fornecidas em frascos de 100.
NDC 50458-400-10
(100 CAPSULES)
Store at 15°-25°C (59°-77°F).
Revisado Setembro 1996, Julho 1998, Abril 2004
Aprovado Outubro 2005
©Janssen Pharmaceutica Inc. 1998
Rx Apenas
Publicado nos EUA
U.S. Patente 3, 714,159
| Imodium loperamide hydrochloride capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
> > |
||||||||||||||||||||||
> |
||||||||||||||||||||||
rotulador – McNeil Consumer Healthcare
Perguntas mais frequentes
- Como parar a diarreia – qualquer medicamento ou sugestão de remédio?
Mais sobre Imodium (loperamide)
- Efeitos secundários
- Durante a gravidez ou amamentação
- Dosagem Informações
- Fotos de Drogas
- Interações de Drogas
- Comparar Alternativas
- Grupo de Apoio
- 24 Revisões
- Classe de Drogas: antidiarreicos
- Alertas FDA (2)
>
>
Recursos de consumo
- >
- Leitura avançada
Recursos profissionais
- Informação de prescrição
- Solução oral em laseroperamida (FDA)
Outras marcas Anti-Diarreia, Up and Up Anti-Diarrheal Solution
Outras Formulações
- Imodium A-D
Guias de tratamento relacionadas
- Diarreia, Acute
- Diarreia, Chronic
- Diarreia de Viajante
- Diarreia
Relatação Médica