Paciente con lesión subepitelial gástrica
Martín Gómez Zuleta, MD (1)
(1) Unidad de Gastroenterología, Departamento de Medicina Interna, Universidad Nacional de Colombia. Hospital Tunal. Bogotá, Colombia..
Recibido: 05-10-10 Aceptado: 25-11-10
Abstract
Aunque las lesiones subepiteliales se encuentran raramente en el tracto gastrointestinal superior, pueden causar incertidumbre en el enfoque diagnóstico y en el manejo. Se describen los hallazgos endosonográficos y se revisan las recomendaciones actuales a la luz de un caso para permitir un enfoque racional de estas lesiones.
Palabras clave
Tumores de la submucosa, ecografía endoscópica, GIST.
Caso clínico
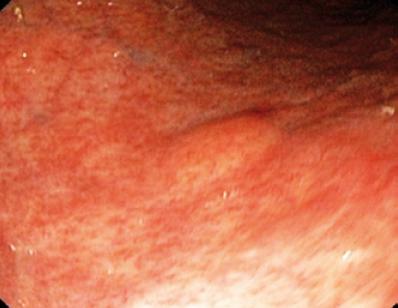
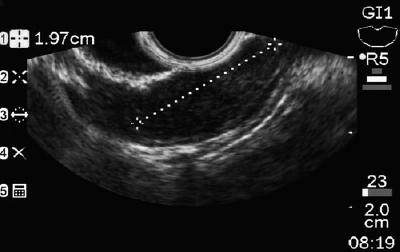
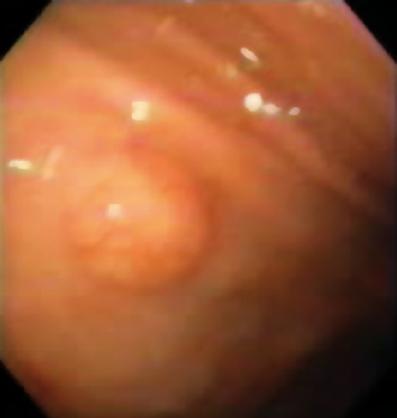
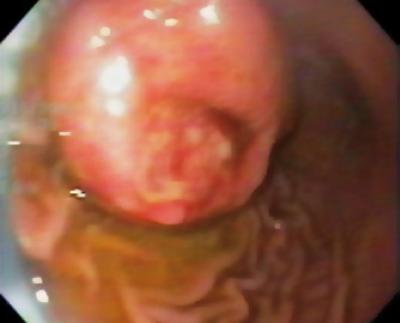
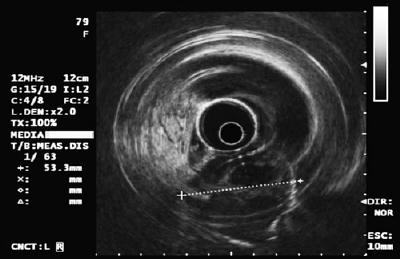
Un hombre de 50 años con dispepsia fue enviado a una endoscopia superior en la que se encontró una lesión subepitelial de 9 mm en el cuerpo gástrico (Figura 1). La biopsia de la mucosa suprayacente fue normal. El paciente no tenía antecedentes médicos y su examen físico era normal.
Figura 1. Lesión subepitelial gástrica.
Enfoque inicial: ¿Qué podríamos hacer entonces?
Se denomina lesión subepitelial a una masa o protuberancia en la luz de un órgano cubierto por epitelio normal. Son lesiones poco frecuentes que se espera que estén presentes en 1 de cada 300 endoscopias (1, 2). Las causas pueden ser lesiones intrínsecas benignas o malignas de la pared del tracto gastrointestinal o compresión extrínseca causada por estructuras adyacentes normales o patológicas (3).
Estas lesiones se suelen encontrar de forma incidental y a menudo no tienen relación con los síntomas, como era el caso de nuestra paciente. Esto puede hacer dudar al médico de si debe hacer un seguimiento más específico y realizar una investigación adicional (4). En nuestra opinión todas estas lesiones deben ser evaluadas para aclarar su origen. Siempre debemos tomar una biopsia de la mucosa suprayacente (salvo que sospechemos un origen vascular o quístico), ya que muchas de estas lesiones pueden tener un origen en la lámina propia o en la mucosa muscular. En estos casos se puede llegar a ellas con fórceps y hacer un diagnóstico preciso. Si las biopsias son normales, es aquí donde debemos definir si debemos parar o continuar el estudio.
Una vez realizada la endoscopia y detectada una lesión subepitelial, podemos pasar inmediatamente a evaluarla. Inicialmente debemos describir su tamaño, forma, color y movilidad, y si es o no pulsátil. Finalmente podemos valorar su consistencia con unas pinzas de biopsia cerradas, permitiéndonos detectar si es quística, sólida o blanda, depresible y en forma de almohada (lesión que se recupera lentamente). Las lesiones en forma de almohada con halos amarillos son altamente sugestivas de lipomas. Si la lesión es una ligera irregularidad de la mucosa y tiene una depresión central, es sugestiva de un páncreas ectópico. Normalmente los quistes o las varices tienen una mucosa lisa y simétrica. Los GIST (tumores del estroma gastrointestinal) pueden estar ligeramente ulcerados, pero son firmes y móviles (9). También es útil cambiar la posición del paciente para descartar la posibilidad de una lesión extrínseca, cuyo aspecto endoscópico cambiará si el paciente cambia de posición, inhala o si el estómago del paciente está lleno de aire (10-12).
¿Cuál es el diagnóstico diferencial?
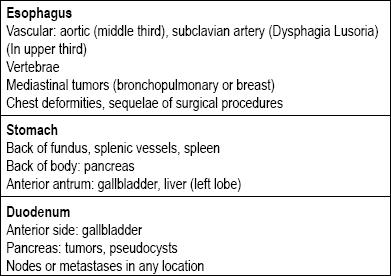
Hay muchos tipos de lesiones en el tracto gastrointestinal que pueden clasificarse como subepiteliales. Sus causas suelen depender de si la lesión se encuentra en el esófago, el estómago, el duodeno o el recto. El siguiente punto a considerar es si se trata realmente de una lesión de la pared, o si se trata de una compresión extrínseca, ya que existen estructuras alrededor de todo el tracto gastrointestinal que pueden dar lugar a una compresión (Tabla 1) (5-8).
Tabla 1. Causas primarias de las compresiones extraluminales del tracto digestivo superior.
¿Deben evaluarse todas las lesiones con ecografía endoscópica (EUS)?
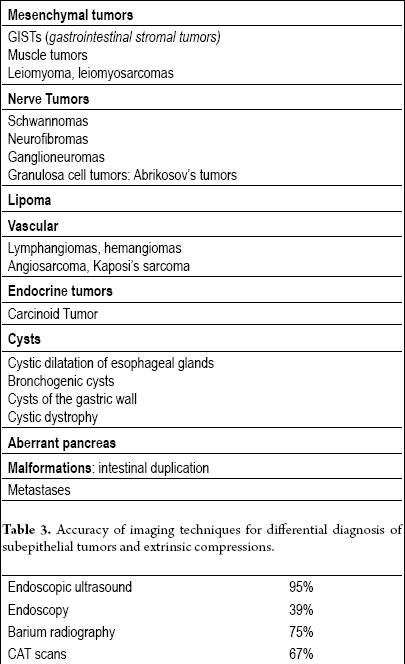
En realidad, todas las lesiones subepiteliales (Tabla 2) deben ser evaluadas con técnicas de imagen adicionales, pero si la lesión tiene menos de un centímetro de diámetro (especialmente si es amarilla), no es necesaria una evaluación porque hay una alta probabilidad de que sea un lipoma.
Tabla 2. Tumores subepiteliales del tracto gastrointestinal.
La ecografía endoluminal o endoscópica (EUS) es la técnica de elección (13, 14). La precisión de la EUS para diferenciar una compresión extraluminal de un tumor subepitelial es superior al 95%. Esto es mucho mejor que otras técnicas de imagen como la ecografía convencional o el TAC (15-17) (Tabla 3).
Tabla 3. Precisión de las técnicas de imagen para el diagnóstico diferencial de los tumores subepiteliales y las compresiones extrínsecas.
Una vez que hemos determinado que la lesión es intrínseca a la pared, y no es una compresión extrínseca, debemos valorar a qué capa de la pared corresponde. Normalmente, la pared del estómago se divide en mucosa, submucosa, muscularis propria y serosa. La capa mucosa se divide en epitelio, membrana basal, lámina propia y mucosa muscular. Con EUS y con el equipo de radio se puede dividir la pared en 5 capas (18):
La primera capa hiperecoica corresponde a la parte más superficial de la mucosa gástrica.
La segunda capa hipoecoica corresponde a la parte más profunda de la mucosa que se puede correlacionar con la mucosa muscular.
La tercera capa hiperecoica corresponde a la capa submucosa.
La cuarta capa hipoecoica corresponde al músculo propiamente dicho.
La quinta capa hiperecoica corresponde a la serosa o adventicia.
Normalmente no hay lesiones en las capas uno y cinco (19), por lo que se limitan a tres capas. Suelen ser hipoecoicas, anecoicas o hiperecoicas.
Diagnóstico con ecografía endoscópica
Describiremos cada presentación según su capa.
Capa dos
Corresponde a la parte más profunda de la mucosa o a la lámina propia y a la muscularis mucosa. Las lesiones que surgen en esta capa son poco frecuentes y suelen ser hipoecoicas.
Las lesiones hipoecoicas: La mayoría de los tumores que surgen en esta capa son musculares, generalmente leiomiomas. Pueden tener calcificaciones y los grandes pueden ser heterogéneos y mostrar nódulos a diferencia de las lesiones pequeñas que son homogéneas. (20).
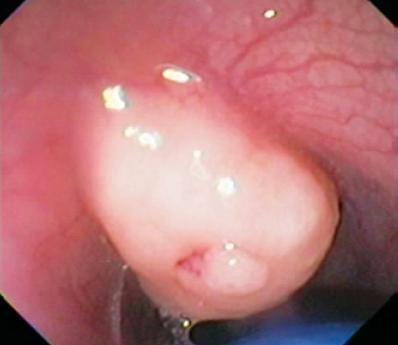
En esta capa también encontramos los tumores de Abrikosovs o células granulares. Suelen ser pequeños y, a diferencia del leiomioma, deforman el balón del endoscopio debido a su dureza (Figuras 2 y 3). Los carcinoides también pueden originarse en esta capa, generalmente en el fondo de ojo o en el recto (Figura 4).
Figura 2. Lesión subepitelial de color amarillo en el esófago distal.
Figura 3. La EUS muestra una lesión isoecoica en la tercera capa de ecos que deforma el balón, lo que sugiere un tumor de células granulares de 2 cm
Figura 4. Lesión subepitelial con un patrón reticular en el centro que sugiere un tumor neuroendocrino.
Las lesiones anecoicas: Habitualmente se observa que en esta capa pueden originarse quistes de inclusión o de retención.
Capa de eco tres
Es una banda de tejido de aspecto hiperecoico en la EUS. Numerosos tumores pueden originarse en esta capa.
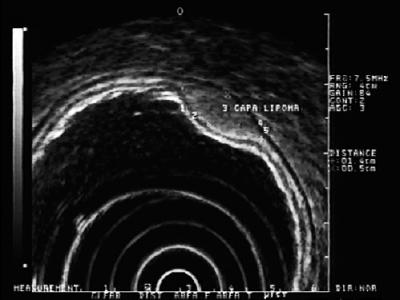
Lesiones hiperecoicas: Las lesiones más frecuentemente encontradas en esta capa son los lipomas. Se caracterizan por ser lesiones hiperecoicas homogéneas. Suelen tener forma de almohada cuando se empujan con las pinzas endoscópicas (Figura 5) (9).
Figura 5. EUS: lesión hiperecoica en la capa 3 de la submucosa compatible con lipoma.
Los neurofibromas suelen ser hiperecoicos. Se originan en la submucosa o en la muscularis propria.
Las lesiones hipoecoicas en esta capa pueden corresponder a pancreas ectópicos o aberrantes. Estas lesiones suelen ser heterogéneas y ocasionalmente pueden verse en el centro estructuras ductales anecoicas que pueden corresponder a conductos. En una endoscopia se ve una lesión con el centro deprimido (21).
Las lesiones hipoecoicas también pueden corresponder a tumores carcinoides. Aunque no son tumores subepiteliales porque son neuroendocrinos y no mesenquimales, pueden localizarse en la pared digestiva y dar lugar al mismo tipo de nódulos. Suelen ser pequeños (menos de un cm), hipoecoicos (pero más ecogénicos que musculares) y asientan en la mucosa. El estudio histológico suele ser posible a partir de una biopsia (22, 23).
Los linfomas gástricos también pueden presentarse como lesiones hipoecoicas o hiperecoicas de la submucosa (24).
Las lesiones anecoicas que se observan en esta capa son probablemente estructuras vasculares o quistes (25).
La capa ecogénica cuatro
Corresponde a la capa muscular. De ahí que la mayoría de los tumores de esta capa sean de origen muscular.
Las lesiones hiperecoicas son muy raras, pero pueden estar relacionadas con linfomas, tumores neurogénicos o metástasis (26).
Las lesiones hipoecoicas: La mayoría de los tumores de esta capa son hipoecoicos, sobre todo los tumores estromales (GIST) cuando se sitúan en el estómago. Sin embargo, si se localizan en el esófago suelen denominarse leiomiomas. Otras lesiones que pueden tener este aspecto son las metástasis originadas en los pulmones o las mamas y el tumor glómico (27). Los linfomas también pueden comprometer esta capa pero generalmente se acompañan de compromiso de las capas superiores.
GIST (tumor del estroma gastrointestinal) es el nombre de la lesión sobre la que nuestros conocimientos han mejorado mucho en los últimos años (28-30). Estos tumores parecen originarse en células totipotenciales que son también los puntos de origen de las llamadas células intersticiales de Cajal. Pueden diferenciarse en grupos: predominantemente musculares, predominantemente neurales o una combinación de ambos. El diagnóstico se realiza por la identificación inmunohistoquímica de la proteína CD-117 (también conocida como proteína c-kit) que es un receptor de membrana con actividad tirosina quinasa (31).
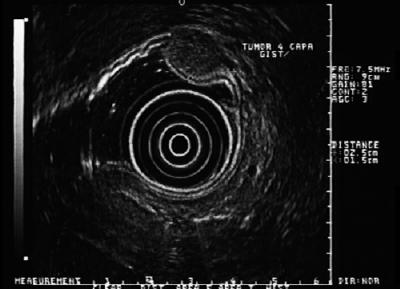
La importancia de estas lesiones es que el 30% pueden tener un comportamiento maligno y dar lugar a metástasis. Sólo en Estados Unidos se registran entre 5.000 y 6.000 casos al año (32). Su distribución en el tracto gastrointestinal es: estómago (40-70%), intestino delgado (20-40%), colon y recto (5-15%) y esófago (<5%) (33). Esto significa que si tenemos una lesión hipoecoica de cuarta capa en el esófago, probablemente sea un leiomioma, pero si está en el estómago, suele ser un GIST (Figura 6, 7 y 8). La mayoría de los pacientes se encuentran en la quinta o sexta década de vida. Suelen tener una lesión localizada en la cuarta capa o muscularis propria, aunque también puede localizarse en la muscularis mucosa (34). La mayoría de los pacientes son asintomáticos hasta que el tumor adquiere el tamaño suficiente para ulcerarse, sangrar o hacer metástasis.
Figura 6. La ecografía muestra una lesión hipoecoica de la cuarta capa compatible con GIST.
Figura 7. Lesión ulcerada sugestiva de GIST.
Figura 8. La ecografía de la figura 7 muestra una lesión hipoecoica de la cuarta capa ecográfica altamente sugestiva de un GIST, de más de 5 cm.
Por ello, si identificamos un GIST mayor de 3 cm es una indicación de cirugía aunque sea asintomático (otros autores sugieren un límite de 4 cm). (35). Sin embargo, las lesiones de menos de 3 cm representan desafíos para el manejo porque la mayoría son benignas. No obstante, debe aclararse que todos los GIST son potencialmente malignos, y se han reportado GIST pequeños que han hecho metástasis, especialmente en el tracto gastrointestinal inferior. Actualmente no podemos predecir con la ecografía endoscópica el potencial maligno de un GIST. Sin embargo, sabemos que las lesiones mayores de 4 cm, con bordes irregulares y/o espacios quísticos en su interior, o con focos ecogénicos tienen altas probabilidades de ser malignas (36).
Por otro lado la aspiración con aguja fina guiada por ecografía endoscópica (EUS-FNA) no sólo puede diagnosticar GIST mediante la identificación de CD-117, sino también la presencia de la proteína Ki-67 que indica proliferación y sugiere comportamiento maligno (37). Es muy importante destacar que las lesiones de GIST son muy peligrosas. Debemos seguirlas continuamente, evaluando el tamaño del tumor y la tasa de proliferación según los riesgos establecidos. Incluso después de una resección completa, estas lesiones pueden recidivar, especialmente en el lugar de origen, pero también en el peritoneo o el hígado. Entre el 40% y el 90% de las lesiones recurren a pesar de la resección completa. El 50% de las recidivas afectan al hígado. Los GIST tienen un riesgo de recurrencia 4 veces mayor cuando el sitio primario es el intestino que cuando está en el estómago (38).
¿Cuál es la precisión de la ecografía endoscópica?
Múltiples estudios han demostrado que la ecografía endoscópica es muy precisa para determinar si una lesión está o no en la pared, y para establecer de qué capa de la pared es la lesión. Esto permite elegir el mejor enfoque diagnóstico. Un estudio determinó la capa de origen en 48 de 50 pacientes (96%) con confirmación quirúrgica (39). La concordancia interobservador es muy buena, especialmente cuando se identifican lesiones como los leiomiomas y las lesiones vasculares. Es importante señalar que el aspecto ecográfico de las lesiones no permite determinar sus causas con un 100% de certeza. Un estudio de Karaca et al. (40) sobre 22 pacientes sometidos a una EUS seguida de mucosectomía mostró que la precisión de la EUS era sólo del 45%. Sin embargo, las lesiones eran en su mayoría menores de 20 mm, y la precisión de la ecografía aumentó al 66% para diferenciar los tumores malignos de los benignos. Como los criterios ecográficos pueden ser imprecisos, parece razonable que, si es posible, intentemos obtener un diagnóstico específico. Esto puede lograrse con EUS-FNA o con la resección de la mucosa de la lesión, como se demuestra en este trabajo. Mekky et al. estudiaron a 141 pacientes sometidos a EUS-FNA controlados quirúrgicamente. Encontraron una precisión del 95,6% para sus resultados finales (41).
¿Monitoreo, biopsia por punción o resección?
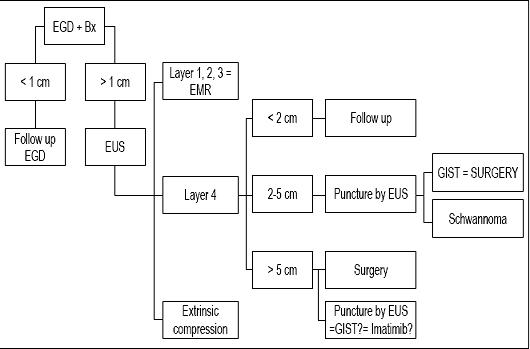
La decisión de monitorear, utilizar o realizar una resección depende de varios factores como el tamaño de la lesión, su aspecto endoscópico, la capa de origen y sus características ecogénicas. Si nos encontramos ante una lesión subepitelial de menos de 1 cm, no está justificado realizar más pruebas, pero sí una endoscopia de seguimiento. Si la lesión es mayor de 1 cm, la ecografía es obligatoria. Si la lesión es pequeña y depende de la primera, segunda o tercera capa ecográfica, se puede realizar una resección diagnóstica de la mucosa, que también es terapéutica. Sin embargo, si la lesión se encuentra en la cuarta capa y mide menos de 2cm, se recomienda el control sólo con endoscopia. Si mide entre 2cm y 5cm, lo ideal es la EUS-FNA. Si se comprueba que se trata de una lesión benigna, se puede realizar un examen de seguimiento al cabo de 6 meses. Si no ha crecido, no es necesario realizar más controles. Si es maligna, tiene potencial de malignidad o es mayor de 5 cm, se recomienda el tratamiento (42).
En conclusión, como nuestro paciente tenía una lesión menor de 1 cm, creemos que su lesión merecía sólo una endoscopia de seguimiento (ver algoritmo, figura 9). Se propuso un nuevo examen de seguimiento en un año. Si la lesión no ha crecido, se programarán seguimientos adicionales cada 2 o 3 años, pero si crece propondremos una EUS-FNA y un estudio inmunohistoquímico.
Figura 9. Algoritmo de tratamiento en lesiones subepiteliales. EGD: endoscopia superior. Bx: Biopsia. EUS: ecografía endoscópica. REM: resección endoscópica de la mucosa.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. Revisión técnica del instituto de la asociación gastroenterológica americana sobre el manejo de las masas subepiteliales gástricas. Gastroenterología 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Precisión de la ultrasonografía endoscópica en las lesiones de la submucosa gastrointestinal superior: un estudio prospectivo multicéntrico. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Características endosonográficas de los páncreas ectópicos gástricos distinguibles de los tumores mesenquimales. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Papel de la ecografía endoscópica en el tratamiento de los tumores submucosos del esófago y del estómago. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsia por aspiración con aguja fina de quistes de duplicación gástrica con guía ecográfica endoscópica. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Técnicas en endoscopia gastrointestinal 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Resección endoscópica de la mucosa. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Ecografía endoscópica en los tumores del estroma gastrointestinal (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografía digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Un estudio sobre los tumores miogénicos del tracto gastrointestinal superior mediante ultrasonografía endoscópica con especial referencia al diagnóstico diferencial de las lesiones benignas y malignas. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Acuerdo interobservador para EUS en la evaluación y diagnóstico de masas submucosas. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoscopic ultrasonography in the diagnosis of gastric submucosal tumor. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterología 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Evaluación prospectiva de una sonda de ultrasonido con catéter sobre el alambre. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ecografía endoscópica para la evaluación de tumores del músculo liso en el tracto gastrointestinal superior: una experiencia con 42 casos. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Imágenes gastrointestinales: ecografía endoscópica. Gastroenterología 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Rendimiento del muestreo de tejido para las lesiones submucosas evaluadas por EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ecografía endoscópica para la estadificación inicial y el seguimiento en pacientes con linfoma gástrico de bajo grado del tejido linfoide asociado a la mucosa tratados médicamente. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnóstico de quistes de duplicación del intestino anterior mediante ultrasonografía endoscópica. Gastroenterología 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Diferenciación endosonográfica de los tumores de células estromales benignos y malignos. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Características endosonográficas predictivas de los tumores de células estromales gastrointestinales benignos y malignos. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patología y criterios de diagnóstico de los tumores del estroma gastrointestinal (GIST): Una revisión. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Eficacia y seguridad del mesilato de imatinib en tumores del estroma gastrointestinal avanzados. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Tumores del estroma gastrointestinal y otras lesiones mesenquimales del intestino. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinal stromal tumors: De un enfoque quirúrgico a uno molecular. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumores del estroma gastrointestinal. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Medición de lesiones por endoscopia: una visión general. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Un estudio sobre los tumores miogénicos del tracto gastrointestinal superior mediante ultrasonografía endoscópica con especial referencia al diagnóstico diferencial de las lesiones benignas y malignas. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Evaluación del pronóstico del tumor del estroma gastrointestinal. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumores del estroma gástrico. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. tumores de la submucosa y fols gástricos gruesos. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. Revisión técnica del instituto de la asociación gastroenterológica americana sobre el manejo de las masas subepiteliales gástricas. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Precisión de la ultrasonografía endoscópica en las lesiones submucosas gastrointestinales superiores: un estudio prospectivo multicéntrico. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonographic features of gastric ectopic pancreases distinguishable from mesenchymal tumors. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Papel de la ecografía endoscópica en el tratamiento de los tumores submucosos del esófago y del estómago. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsia por aspiración con aguja fina de quistes de duplicación gástrica con guía ecográfica endoscópica. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoscopic mucosal resection for gastric neoplasms. Técnicas en endoscopia gastrointestinal 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Resección endoscópica de la mucosa. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Ecografía endoscópica en tumores del estroma gastrointestinal (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografía digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Un estudio sobre los tumores miogénicos del tracto gastrointestinal superior mediante ultrasonografía endoscópica con especial referencia al diagnóstico diferencial de las lesiones benignas y malignas. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Acuerdo interobservador para EUS en la evaluación y diagnóstico de masas submucosas. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoscopic ultrasonography in the diagnosis of gastric submucosal tumor. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastrointestinal ultrasound images. Gastroenterología 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Evaluación prospectiva de una sonda de ultrasonido con catéter sobre el alambre. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ecografía endoscópica para la evaluación de tumores del músculo liso en el tracto gastrointestinal superior: una experiencia con 42 casos. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Imágenes gastrointestinales: ecografía endoscópica. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Rendimiento de la toma de muestras de tejido para lesiones submucosas evaluadas por EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ecografía endoscópica para la estadificación inicial y el seguimiento en pacientes con linfoma gástrico de bajo grado del tejido linfoide asociado a la mucosa tratados médicamente. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnóstico de quistes de duplicación del intestino anterior mediante ultrasonografía endoscópica. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Diferenciación endosonográfica de los tumores de células estromales benignos y malignos. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Características endosonográficas predictivas de los tumores de células estromales gastrointestinales benignos y malignos. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patología y criterios diagnósticos de los tumores del estroma gastrointestinal (GIST): Una revisión. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Eficacia y seguridad del mesilato de imatinib en tumores del estroma gastrointestinal avanzados. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Tumores del estroma gastrointestinal y otras lesiones mesenquimales del intestino. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinal stromal tumors: De un enfoque quirúrgico a uno molecular. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumores del estroma gastrointestinal. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Medición de lesiones por endoscopia: una visión general. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Un estudio sobre los tumores miogénicos del tracto gastrointestinal superior mediante ultrasonografía endoscópica con especial referencia al diagnóstico diferencial de las lesiones benignas y malignas. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Evaluación del pronóstico del tumor del estroma gastrointestinal. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumores del estroma gástrico. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. tumores de la submucosa y fols gástricos gruesos. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.