Contenidos
- 1 Introducción
- 2 Aspectos estructurales
- 3 Función
- 4 Relevancia para la salud humana & Enfermedad
- 5 Enlaces externos
Introducción
La lipasa gástrica humana (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) es la lipasa responsable de iniciar la digestión de las grasas alimentarias en el estómago . Esta enzima estable al ácido es secretada por las células principales fúndicas del estómago humano y cataliza entre el 10 y el 20% de los procesos lipolíticos totales (es decir, los que implican la descomposición de las grasas) en adultos sanos . La HGL cataliza específicamente la hidrólisis del triacilglicerol para producir diacilglicerol y un subproducto carboxilato, un proceso que facilita la posterior descomposición de las grasas por parte de la lipasa pancreática. En cuanto a las implicaciones de la enfermedad, hay pruebas que sugieren que la secreción de HGL está alterada en individuos con gastritis (la condición gástrica más común, en la que el revestimiento del estómago está inflamado) . Además, los individuos con una función pancreática comprometida (y, por tanto, con niveles reducidos de lipasa pancreática) deben depender en gran medida de la HGL para digerir las grasas de la dieta.
Aspectos estructurales destacados
La HGL, una enzima hidrolasa formada por dos subunidades de 379 residuos de aminoácidos, posee una que contiene los residuos Ser-153, His-353 y Asp-324. Esta estructura es esencial para la descomposición de los lípidos, coordinada con una en Leu-67 y Gln-154 , que sirve para estabilizar el estado de transición. Estructuralmente, la lipasa gástrica humana presenta un complejo (las hojas beta se muestran en amarillo, las hélices alfa en naranja, las espirales en espiral en verde y los carbohidratos resueltos en morado). El de HGL en los residuos 215-244 da paso a las (regiones hidrofóbicas señaladas en rojo) tanto que rodean el sitio activo como que interfieren con la tapa. Se cree que estas áreas atraen a los lípidos y promueven el acoplamiento.
Función
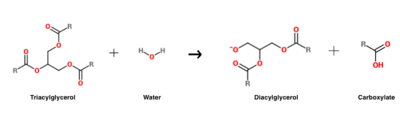
La reacción de hidrólisis del triacilglicerol que es catalizada por HGL .
La HGL funciona a un pH óptimo de aproximadamente cinco, y cataliza principalmente la hidrólisis de triacilgliceroles de cadena corta.
Como esterasa con una serina catalíticamente activa, la HGL exhibe un mecanismo parecido al de la serina esterasa establecida. La serina del sitio activo, situada dentro del , es facilitada primero por la formación vecina de un puente salino entre Asp-136 e His-152, que induce la apropiación de un protón de Ser-153. El Ser-153, ahora altamente nucleófilo, atacará el carbono carbonilo del grupo acetato en una molécula de triacilglicerol. La especie tetraédrica es estabilizada por el agujero del oxianión. Sin embargo, en cuanto la especie se desensambla en el acetato unido covalentemente y la lipasa, la serina se somete a una desacilación en la que el agua actúa como nucleófilo. Este paso final restaura la Ser-153 a su estado protonado .
Relevancia para la salud humana & Enfermedad
La acción hidrolítica de la HGL es algo accesorio en los adultos sanos, en los que la HGL modula el 10-20% de la descomposición de las grasas de la dieta como máximo . Sin embargo, la presencia de HGL es crucial en los bebés prematuros, que a menudo presentan una función pancreática deficiente, así como en los adultos con insuficiencia pancreática patológica (por ejemplo, pancreatitis crónica) . Estos individuos son incapaces de producir cantidades adecuadas de lipasa pancreática y, por lo tanto, deben depender principalmente del HGL para la digestión de las grasas alimentarias . En estos individuos, la HGL es responsable de hidrolizar el 30-60% de los triglicéridos de la dieta.
Tomasik et al. (2013) investigaron la regulación hormonal de la secreción de HGL en niños y adolescentes con gastritis. Se comparó la actividad de la HGL en tres grupos: un grupo experimental formado por adolescentes diagnosticados de gastritis por Helicobacter pylori (n = 10), otro grupo experimental formado por adolescentes con una forma de gastritis no inducida por H. pylori (n = 10), y un grupo de control de adolescentes sanos (n = 14). La actividad del HGL, además de las concentraciones plasmáticas del péptido similar al glucagón-1, la colecistoquinina y el péptido insulinotrópico dependiente de la glucosa, se observaron mediante el análisis de muestras de jugo gástrico que se habían recogido mediante mediciones endoscópicas de cada paciente.
Los pacientes cuya gastritis superficial fue inducida por patógenos distintos del H. pylori mostraron niveles más bajos de actividad HGL en comparación tanto con los adolescentes sanos (p < .005) como con los que fueron diagnosticados de gastritis por H. pylori (p < .005). Las concentraciones plasmáticas medias del péptido insulinotrópico dependiente de la glucosa fueron más bajas en los pacientes sanos (p < 0,005) que en los que tenían gastritis no causada por H. pylori (p < .003) y en los que tenían gastritis causada por H. pylori (p < 0,01). La regulación de la secreción de HGL por el péptido similar al glucagón-1 (GLP-1) y la colecistoquinina (CCK) resultó estar alterada en los adolescentes con gastritis; en apoyo de este hallazgo, se ha sugerido en la literatura existente que el GLP-1 y la CCK inhiben la secreción de HGL . Además, el péptido insulinotrópico dependiente de la glucosa resultó ser un potente activador de la actividad de la lipasa gástrica humana en todos los grupos experimentales y de control.
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG