La Interleucina 12 (IL-12) es una citoquina proinflamatoria con un peso molecular de 70 kDa compuesta por dos subunidades, IL-12p35 (35 kDa) e IL-12p40 (40 kDa). La estructura heterodimérica única se comparte con tres miembros de la familia, a saber, la IL-23 (p19/p40), la IL-27 (p28/Ebi3) y la IL-35 (p35/Ebi3).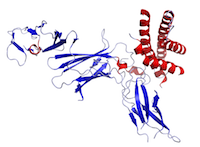
La IL-12, también denominada IL-12p70, fue descubierta de forma independiente en 1989 por Kobayashi M. et al. (denominada factor estimulante de las células asesinas naturales) y en 1990 por Stern A.S. et al. (denominado factor de maduración de linfocitos citotóxicos).
Figura Esta es una estructura de la IL-12 creada a partir de los datos del Protein Data Bank (PDB: 1F45) y representada con PyMOL.
La IL-12 induce la diferenciación de las células T CD4+ ingenuas en células Th1 y activa las células NK. Tras la activación, las células NK producen IFN-γ e IL-2, pero también IL-12, lo que apunta a un mecanismo de retroalimentación positiva. La IL-12 protege a las células CD4+ Th1 de la muerte apoptótica inducida por el antígeno y se ha descubierto que tiene efectos sinérgicos con la IL-18 en el desarrollo de las células Th1. Además, la IL-12 desempeña un papel en el tráfico y la migración de las células T al inducir la expresión de moléculas de adhesión funcionales como los ligandos P y E-selectina en las células Th1, pero no en las Th2. Por lo tanto, las células Th1 son reclutadas selectivamente a sitios que promueven una respuesta inmune Th1. Funcionalmente, estas células ayudan a eliminar los patógenos intracelulares; en contraste con las células Th2 que son responsables de la inmunidad humoral que protege contra los invasores extracelulares. El equilibrio entre la IL-12, que favorece las respuestas Th1, y la IL-4, que favorece las respuestas Th2, determina la preferencia temprana expresada en la respuesta inmunitaria.
La IL-12p35 comparte una homología de secuencia sustancial con la citocina IL-6, mientras que la cadena p40 es estructuralmente homóloga al dominio extracelular de la cadena α del receptor de IL-6 (IL-6R). Esto sugiere que la estructura de la IL-12 ha evolucionado a partir de una citocina primordial de la familia IL-6 y de uno de sus receptores. Aunque los transcritos de IL-12p35 se encuentran en muchos tipos de células, la IL-12p35 libre no se secreta sin la subunidad IL-12p40. Esta última subunidad es producida predominantemente por monocitos activados, macrófagos, neutrófilos y células dendríticas. Las actividades biológicas de la IL-12p70 están mediadas por la unión a un complejo receptor de membrana (IL-12R) compuesto por dos subunidades: IL-12R-β1 e IL-12R-β2. Mientras que la subunidad IL-12R-β1 se expresa de forma constitutiva, la expresión de IL-12R-β2 en las células Th1 está regulada por el IFN-γ y se correlaciona con la capacidad de respuesta a la IL-12. Tras la unión de la IL-12, se activa la vía de señalización JAK-STAT, siendo STAT4 el mediador predominante de las respuestas de las células T.