Es importante conocer la estructura de Lewis de una molécula para entender sus propiedades físicas, la hibridación y la forma de la molécula. Hoy vamos a repasar la estructura de Lewis del I3- o también conocido como ion trioduro ya que tiene carga negativa. Hay tres moléculas de yodo en esta molécula y de ahí que el nombre del compuesto sea Trioduro. Para entender la estructura de Lewis de la molécula, debemos conocer los electrones de valencia de la molécula de yodo.
Estructura de Lewis
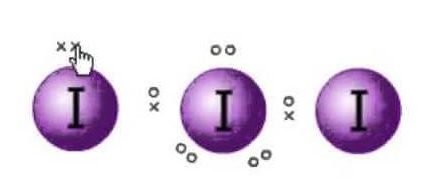
La estructura de Lewis es la representación de los electrones de las moléculas. Hay pares solitarios y electrones de valencia que ayudan a determinar la hibridación y la forma de la molécula. Como hay moléculas de yodo, una molécula de yodo estará en el centro. Además, el yodo está en el séptimo grupo de la tabla periódica y tiene siete electrones de valencia en su órbita externa.

Tenemos aquí tres moléculas de yodo que junto con un electrón extra que le da una carga negativa. Así que el número total de electrones de valencia son : 7×3 + 1= 22.
Hay 22 electrones de valencia en total en esta molécula. Ahora hay una regla del octeto que cada átomo sigue. Según esta regla, cada átomo debe tener ocho electrones en su órbita exterior. Si hay 8 electrones en la capa exterior del átomo central, hay otros dos átomos que necesitan completar su octeto. Como todos los átomos necesitarán ocho electrones en su capa exterior para completar el octeto, un electrón del átomo de yodo central será tomado por los dos átomos de yodo vecinos. Eso significa 8-1-1=6.
Como los electrones serán tomados por ambos átomos.
Así que ahora los electrones de valencia en el átomo central de yodo serán seis. Estos seis electrones formarán los pares de electrones solitarios que no se unen. Como ahora forma el par de electrones, habrá tres pares solitarios, y dos pares de enlace de los electrones ya que cada átomo de yodo tiene un enlace con el átomo central compartiendo un electrón cada uno en total hay 3 pares solitarios y 2 pares de enlace en el átomo central.
Hibridación
Para conocer la hibridación de cualquier molécula, hay una fórmula simple que se puede utilizar. Esta fórmula se utiliza para averiguar el número de hibridación que ayuda a conocer la hibridación de la molécula.
Los números de hibridación y la hibridación que determina se indican como sigue:
- 2: hibridación sp
- 3: hibridación sp2
- 4: hibridación sp3
- 5: hibridación
La fórmula para hallar el número es,
Número de hibridación: Número del electrón de valencia + monovalente + (carga negativa) – (carga positiva)/2
Los electrones de valencia de los átomos de yodo son 7 ya que hay siete electrones en la capa más externa. El número del átomo monovalente es dos ya que los dos de los tres yodo son monovalentes. Ahora cuando llegamos a la carga del ion I3- tiene una carga negativa por lo que el valor de esta carga negativa será 1.
Ahora coloque todos los valores de acuerdo con la fórmula,
7+1+2/2
=10/2
=5
Así el número de hibridación es 5 lo que significa que su hibridación es sp3d.
Otra forma de encontrar la hibridación de una molécula dada es con la ayuda de los pares solitarios y los electrones de valencia. El número de pares solitarios en esta molécula es 3, y el número de átomos que comparten electrones de valencia es 2.
Por lo tanto, 3+2=5 lo que también determina la hibridación sp3d.
La forma del ion I3-

La forma de la molécula I3- es Lineal. Hay tres átomos de yodo de los cuales uno tiene una carga negativa extra. Debido a este electrón extra hay 3 pares solitarios de electrones y 2 pares de enlace haciendo su número estérico 5. Como hay tres pares solitarios en el átomo central de yodo, estos pares tratan de repelerse entre sí tanto como sea posible. Así que para estar a mayor distancia, los pares toman las posiciones ecuatoriales, y los otros dos átomos de yodo están a 180 grados el uno del otro. Por lo tanto, la forma general del ion I3- es lineal.
Polaridad
Así que aquí está la parte difícil de este ion, en primer lugar como es una carga en él podemos llamarlo como un ion poliatómico en lugar de llamarlo una molécula. Los iones son las cargas que vemos en las moléculas. Como I3- tiene un electrón, este ion tiene una carga negativa en general. Las moléculas tienen polaridad porque tiene las dos cargas que son un extremo parcialmente cargado positivamente y el extremo parcialmente cargado negativamente. Hay un momento dipolar en las moléculas que depende de la separación de las cargas en la molécula. Si la distancia entre ambos los cargos es más grande el momento de dipolo también será más grande.
Pero cuando hablamos de I3- ion es un ion cargado negativamente. Incluso cuando dibujamos, su estructura de Lewis no vemos ningún momento dipolar o los enlaces polares en él como la carga global en sí es negativo en el ion. Así que no es ni polar ni no polar. Sin embargo, si usted tiene que describir el ion, usted puede utilizar la frase «como una molécula polar» porque I3- es soluble en agua.
En las observaciones finales, para resumir, este artículo entero, I3- es un ion poliatómico que tiene 22 electrones de valencia, 3 pares solitarios, 2 pares de enlace, y la hibridación sp3d. Es de forma lineal y no tiene polaridad.