Introduction
Estimoidun glomerulussuodatusnopeuden (estimated glomerular filtration rate, eGFR), joka on alhaisempi kuin 60 ml/min/1.73 m2, on todettu olevan yhteydessä lisääntyneeseen riskiin sairastua kaikenlaiseen kuolemantapaukseen ja kardiovaskulaarikuolleisuuteen yleisessä väestössä ja riskiryhmiin kuuluvissa väestöissä.1,2 Henkilöt, joiden eGFR on alentunut, kuolevat todennäköisemmin sydän- ja verisuonitauteihin kuin munuaisten vajaatoimintaan.1,3 EGFR
mL/min/1,73 m2:n esiintyvyys kasvaa asteittain iän myötä, ja se on jopa 50 % yli 80-vuotiailla.4,5 Kun otetaan huomioon väestön ikääntyminen kaikkialla maailmassa, munuaistoiminnan odotetaan vaikuttavan yhä enemmän sydän- ja verisuonitauteihin tulevina vuosina.
Joidenkin tutkimusten mukaan iän lisääntyminen heikentää eGFR:n ja kuolleisuuden välistä yhteyttä.1,6 Lisäksi käydään jatkuvaa keskustelua kohtalaisesti alentuneen munuaistoiminnan (eGFR 45-59 ml/min/1,73 m2 ) kliinisestä merkityksestä yli 65-vuotiailla.7,8 Kuolleisuuden on todettu olevan merkittävästi korkeampi eGFR:n ollessa 6,9 mutta vain eGFR:n ollessa 4,10-12. Sydän- ja verisuonitautitapahtumien (CVE) osalta tulokset ovat vielä epäjohdonmukaisempia.12,13 Tämä skenaario on saanut jotkut kirjoittajat ehdottamaan ikäkalibroitua raja-arvoa eli eGFR 8, mikä on mielenkiintoista, koska iäkkäillä ihmisillä esiintyy paljon lievempiä alenemia.
Joissakin tuloksissa esiintyvät ristiriitaisuudet voivat johtua eroista kreatiniinin mittausmenetelmissä, eGFR:n estimointiyhtälöissä tai tutkittujen väestöryhmien ominaispiirteissä. Lisäksi alueilla, joilla sepelvaltimotaudin esiintyvyys on alhainen, tehdyissä tutkimuksissa ei ollut mukana yli 74-vuotiaita henkilöitä14,15 tai niissä ei annettu yksityiskohtaisia tietoja ikäryhmittäin.16,17
Tämän tutkimuksen tavoitteena oli arvioida ikäkohtaista yhteyttä eGFR:n ja kokonaiskuolleisuuden (ACM) sekä sydän- ja verisuonitautien ilmaantuvuuden välillä yli 60-vuotiailla yli 60-vuotiailla eteläeurooppalaisessa populaatiossa, jossa sepelvaltimotautien ilmaantuvuus on vähäinen.18
MenetelmätSuunnittelu ja tutkimusjoukko
Toteutimme retrospektiivisen kohorttitutkimuksen, johon kuuluivat kaikki vuonna 1950 tai sitä ennen syntyneet henkilöt, jotka oli rekisteröity johonkin 40:stä perusterveydenhuollon keskitetyllä laboratoriolla varustetusta keskitetystä terveyskeskuksesta, jotka ovat osa Koillis-Espanjassa sijaitsevaa Costa de Ponentin perusterveydenhuoltopalvelua (joka palvelee 873 549 henkilön väestöä) ja joiden kreatiniini mitattiin 1. tammikuun 2010-31. joulukuun 2011 välillä. Suljimme pois potilaat, joilla oli munuaissairauden vaihe 5 (eGFR
Tietolähteet
Kliiniset perustason tiedot saatiin perusterveydenhuollon sähköisistä sairauskertomuksista; sydän- ja verisuonitautien perustason osalta otimme huomioon myös aikaisemmat sairaalahoitoon ottamiset sydän- ja verisuonitautien tai revaskularisaatiotoimenpiteiden vuoksi vuoden 2005 jälkeen. Määritimme indeksipäiväksi sen, jolloin ensimmäinen kreatiniinimittaus tehtiin sisäänottojakson aikana; lähtötilanne määriteltiin indeksipäivää edeltävän vuoden ja sitä seuraavan kuukauden välisenä aikana rekisteröityjen ominaisuuksien mukaan.
Renaalisen toiminnan arviointi
Serumkreatiniinipitoisuudet mitattiin yhdessä ainoassa laboratoriossa käyttäen standardoitua Jaffe-kompensoitua kineettistä menetelmää, joka oli jäljitettävissä isotooppilaimennus-massaspektrofotometriseen referenssimenetelmään. eGFR arvioitiin Chronic Kidney Disease Epidemiology Collaborationin (CKD-EPI) kreatiniiniyhtälön19 avulla ilman rotuun perustuvaa korjausta, jota ei ollut saatavilla.
Luokittelimme eGFR:n kliinisiin luokkiin KDIGO 2012 Clinical Practice Guideline -ohjeen mukaisesti: 15-29, 30-44, 45-59, 60-89 ja 90-119.20
Kovariaatiot
Keräsimme tietoja iästä, sukupuolesta, tupakointistatuksesta (ei koskaan tupakoija, aktiivinen tupakoija ja entinen tupakoija), hyperkolesterolemiasta (seerumin kolesteroli > 6.4 mmol/l tai statiinihoito), sydän- ja verisuonitautien riskitekijät (verenpainetauti, diabetes mellitus) ja aiemmat sydän- ja verisuonitautidiagnoosit (CHD, aivoverisuonisairaus, perifeerinen valtimosairaus ja sydämen vajaatoiminta).
Tulokset
Kuolema-ajankohtaa koskevat tiedot saatiin sairaaloiden tai hallinnollisista rekistereistä, joissa ei ollut erittelyä kuolemansyyn osalta; kaikki CVE:n päätetapahtumat saatiin sairaalahoitotietueista, jotka sisälsivät tietoja kaikista Katalonian, Espanjan koillisosan alueen, sairaaloista. Ensisijainen päätetapahtuma oli ACM ja toissijainen päätetapahtuma oli mikä tahansa CVE, mukaan lukien CHD (akuutti sydäninfarkti , epästabiili angina pectoris tai angina pectoris ) ja aivohalvaus (ei-hemorraginen aivohalvaus , tai ohimenevä iskeeminen kohtaus ). Analysoimme kovat CVE:t (akuutti sydäninfarkti ja ei-hemorraginen aivohalvaus), CHD ja aivohalvaus erikseen.
Osallistujia seurattiin 1 kuukauden kuluttua indeksipäivämäärästä, kunnes he kuolivat, siirtyivät toiseen terveydenhuoltojärjestelmään tai tutkimuksen loppuun (31.12.2013).
Tutkimusprotokolla hyväksyttiin paikallisessa kliinisen tutkimuksen eettisessä toimikunnassa (HVTK:n eettisen toimikunnan IDIAP Jordi Gol P11/43). Emme pyytäneet osallistujilta tietoista suostumusta, koska tutkimuseettinen komitea ei pitänyt sitä tarpeellisena.
Statistinen analyysi
Kaikki muuttujat analysoitiin ikäryhmittäin (60-74 vuotta ja ≥ 75 vuotta). Käytimme näitä ikäryhmiä, koska ne vastaavat useimpia nykyisiä järjestelmiä sydän- ja verisuonitautiriskin arvioimiseksi.18 Jatkuvat muuttujat kuvataan keskiarvona ± keskihajonta tai mediaanina (ei-normaalisti jakautuneet), ja kategoriset muuttujat kuvataan absoluuttisina ja suhteellisina frekvensseinä. Käytimme Studentin t-testiä ja Kruskall-Wallisin testiä arvioidaksemme normaalisti ja epänormaalisti jakautuneiden jatkuvien muuttujien ryhmien välisiä eroja. Käytimme kategorisille muuttujille khiin neliö -testiä ja testasimme myös lineaarista trendiä eGFR-luokkien välillä. Tapahtumat laskettiin Kaplan-Meierin käyrillä 3 vuoden kohdalla.
Kussakin ryhmässä käytimme Coxin suhteellisten vaarojen malleja arvioidaksemme jatkuvana muuttujana olevan eGFR:n ja ACM:n riskin välisen yhteyden vaarasuhteita (HR). Varmistimme eGFR:n vaikutuksen lineaarisuuden käyttämällä Cox-malleissa lineaarisia splineja, joissa oli 4 vapausastetta. Koska niiden henkilöiden määrä, joiden eGFR oli ≥ 120 (n = 14), oli pieni ja estimaattien tarkkuus heikkeni tämän pisteen yläpuolella, nämä henkilöt jätettiin pois lisäanalyyseistä. Käytimme myös Coxin suhteellisten vaarojen malleja testataksemme KDIGO 2012:n kliinisten raja-arvopisteiden perusteella määritellyn kategorisen eGFR:n ja ACM:n välistä yhteyttä. Kaikkien CVE-mallien osalta analyysi suoritettiin käyttäen kilpailevien riskien selviytymismenetelmiä (Fine-Gray proportional subdistributional hazards regression), jotta otettiin huomioon tapauskuolleisuuden mahdollinen vaikutus estimaatteihin.
Haittojen suhteellisuusolettamaa suhteessa aikaan arvioitiin altistumismuuttujan (eGFR:n) osalta graafisesti (Schoenfeldin jäännökset).
Cox-suhteellisten vaarojen mallit sekä jatkuvalle että kategoriselle eGFR:lle oikaistiin iän, sukupuolen, tupakointistatuksen, hyperkolesterolemian, diabetes mellituksen, verenpainetaudin ja aikaisemman sydän- ja verisuonisairauden (sepelvaltimotauti, aivoverisuonitauti, perifeerinen valtimotauti tai sydämen vajaatoiminta) osalta. Mallit mukautettiin lisäksi hoitojen osalta, joista oli saatavilla tietoja (statiinit ja reniini-angiotensiinijärjestelmän lääkkeet).
Vaikka CKD-EPI kehitettiin käyttäen otosta, jossa oli laaja ikäjakauma (18-97 vuotta), mukana oli vain muutama 80-vuotias tai vanhempi henkilö. Siksi teimme herkkyysanalyysin käyttäen Berlin Initiative Study-1 -yhtälöä21 , joka oli kehitetty nimenomaan ≥ 70-vuotiaiden henkilöiden yhteisöllisessä otoksessa.
Lopulliset mallit validoitiin Hosmer-Lemeshow’n testillä ja vastaanottimen käyttöominaiskäyrän alapuolella olevalla alueella. Molemmissa menetelmissä sensurointi ja kilpailevat tapahtumat otettiin huomioon.
Kaikki tilastolliset analyysit tehtiin käyttäen R-versiota 3.2.3 (R: kieli ja ympäristö tilastollista tietojenkäsittelyä varten R Foundation for Statistical Computing, Wien, Itävalta), jossa käytettiin 2-puoleisia testejä ja P-
TULOKSET
Jokaista 138 040:stä kelpoisuusehdot täyttävästä henkilöstä (73.1 % koko alueen ≥ 60-vuotiaasta väestöstä), 6797 jätettiin pois, koska he olivat kotihoidossa, 509:llä oli vaiheen 5 munuaissairaus ja 501:ää oli seurattu Kuva 1 lisämateriaalissa). Mukaan otettujen ja pois suljettujen henkilöiden välillä ei ollut kliinisesti merkittäviä eroja iän (P = .374) tai sukupuolen suhteen (56,1 % ja 55,1 % naisia; P
Koko otoksen mediaani-ikä oli 70 vuotta , ja 56,1 % osallistujista oli naisia. EGFR:n mediaani oli 82,42 ; 13,5 %:lla osallistujista oli eGFR Taulukko 1), eGFR P
P ml/min/1,73 m2 -luokan esiintyvyys.
Tutkimuspopulaation perusominaisuudet, Stratifioituna iän ja arvioidun glomerulusfiltraatioluvun luokan mukaan
| ALL | 90-119 ml | 60-89 ml | 45-59 ml | 30-44 ml | 15-29 mL | P yleinen | P trendi | ||
|---|---|---|---|---|---|---|---|---|---|
| 60- 74-v.vuotiaat | |||||||||
| Potilaat | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | Potilaat | ||
| Iänj, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | |||
| Sukupuoli, nainen | 47 549 (53.8) | 19 927 (57.7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | |||
| Tupakointi | |||||||||
| Ei koskaan tupakoi | 54 452 (61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | |||
| Aktiivinen tupakoitsija | 10 458 (11.8) | 4714 (13.6) | 5189 (10.7) | 422 (9.91) | 107 (10.9) | 26 (12.2) | |||
| Entinen tupakoitsija | 23 446 (26.5) | 8307 (24.0) | 13 452 (27.8) | 1263 (29.7) | 347 (35.2) | 77 (36.2) | |||
| Hyperkolesterolemia | 44 990 (50.9) | 16 710 (48.4) | 24 994 (51.7) | 2529 (59.4) | 613 (62.2) | 144 (67.6) | |||
| Diabetes mellitus | 19 998 (22.6) | 7950 (23.0) | 10 226 (21.1) | 1296 (30.4) | 431 (43.7) | 95 (44.6) | |||
| Hypertensio | 49 781 (56.3) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86.9) | |||
| Sepelvaltimotauti | 6200 (7.02) | 1825 (5.28) | 3629 (7.51) | 173 (17.5) | 46 (21.6) | ||||
| Aivoverisuonisairaus | 4231 (4.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120 (12.2) | 36 (16.9) | |||
| PAD | 1686 (1.91) | 510 (1.48) | 906 (1.87) | 171 (4.02) | 76 (7.71) | 23 (10.8) | |||
| Sydämen vajaatoiminta | 1891 (2.14) | 453 (1.31) | 1011 (2.09) | 259 (6.08) | 132 (13.4) | 36 (16.9) | |||
| Aiempi CVD* | 12 012 (13.6) | 3628 (10.5) | 6854 (14.2) | 1080 (25.4) | 361 (36.6) | 89 (41.8) | |||
| Statiineja | 39 392 (44.6) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | |||
| RASD | 40 619 (46.0) | 13 468 (39.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | |||
| ≥ 75-vuotta-vuotiaat | |||||||||
| Potilaat | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||
| Ikä, y | 79.8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | |||
| Tupakointi | |||||||||
| Ei koskaan tupakoi | 30 251 (72.2) | 1202 (68.0) | 20 086 (71.8) | 5836 (72.9) | 2616 (75.8) | 511 (74.7) | |||
| Aktiivinen tupakoitsija | 1866 (4.46) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3.51) | |||
| Entinen tupakoitsija | 9760 (23.3) | 440 (24.9) | 6607 (23.6) | 1844 (23.0) | 720 (20.9) | 149 (21.8) | |||
| Hyperkolesterolemia | 20 705 (49.4) | 798 (45.1) | 13 621 (48.7) | 4115 (51.4) | 1823 (52.9) | 348 (50.9) | |||
| Diabeteksen mellitus | 11 889 (28.4) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36.0) | |||
| Hypertensio | 30 563 (73.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | |||
| Sepelvaltimotauti | 5074 (12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | |||
| Aivoverisuonisairaus | 4567 (10.9) | 171 (9.67) | 2781 (9.94) | 1034 (12.9) | 486 (14.1) | 95 (13.9) | |||
| PAD | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | |||
| Sydämen vajaatoiminta | 3275 (7.82) | 90 (5.09) | 1648 (5.89) | 822 (10.3) | 551 (16.0) | 164 (24.0) | |||
| Aiempi sydän- ja verisuonitauti* | 11 691 (27.9) | 389 (22.0) | 6900 (24.7) | 2657 (33.2) | 1419 (41.1) | 326 (47.7) | |||
| Statiinit | 19 029 (45.4) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49.0) | |||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498 (72.8) | |||
CVD, sydän- ja verisuonitauti; PAD, perifeerinen valtimotauti; RASD, reniini-angiotensiinijärjestelmän lääkkeet.
Jos ei toisin mainita, tiedot ilmaistaan lukumääränä (%) tai mediaanina .
Sisältää aivoverenkierron, PAD:n ja sydämen vajaatoiminnan.
Testataksemme eGFR:n yhteyksiä Cox-malleissa määrittelimme molemmissa ryhmissä referenssiksi eGFR = 80 (jota käytettiin myös CKD-Prognostic Consortium -meta-analyysissä)6 , koska tämä oli eGFR:n mediaani populaatiossa, ja eGFR:n mediaani väestössä ja eGFR:n mediaani oli 60-90 kliinisenä luokkana, koska tämä sisälsi suurimman määrän yksilöitä, ja se oli myös kliinisesti merkittävä.
Seurannan mediaani oli 38,2 kuukautta . Yhteensä kirjattiin 6474 kuolemantapausta, 1573 CHD-tapahtumaa ja 2236 aivoverisuonitapahtumaa. Kaikki päätetapahtumat olivat merkitsevästi yleisempiä vanhemmassa ikäryhmässä (P Taulukko 2), lukuun ottamatta aivohalvaustapahtumia, jotka olivat hieman harvinaisempia henkilöillä, joiden eGFR oli 15-29.
Tapahtumat tutkimuspopulaatiossa iän ja estimoidun glomerulusten suodatusnopeuden mukaan jaoteltuna Kaplan-Meierin estimaattien mukaan kolmen vuoden kuluttua. Log Rank -testi (P Overall), Lineaarinen trendi Waldin testi (P Trendi)
| Kaikki | 90-119 ml | 60- | 60-89 ml | 45-59 ml | 30-44 ml | 15-29 ml | P yleistä | P trendi | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 60- 74-vuotiaat | |||||||||||||||||
| Potilaat | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||||||||||
| Kaikki-kuolleisuus, % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | |||||||||||
| Mikä tahansa CVE, % | 2.09 | 1.51 | 2.26 | 3.78 | 5.60 | 7.94 | |||||||||||
| Kova CVE, % | 1.46 | 1.06 | 1.56 | 2.76 | 4.05 | 4.78 | |||||||||||
| CHD, % | 0.96 | 0.74 | 1.02 | 1.38 | 2.83 | 4.80 | |||||||||||
| Isku, % | 1.16 | 0.79 | 1.27 | 2.44 | 2.88 | 3.17 | |||||||||||
| ≥ 75-vuotta-vuotiaat | |||||||||||||||||
| Potilaat | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||||||||||
| Kaikista syistä johtuva kuolleisuus, % | 9.88 | 10.5 | 7.89 | 11.7 | 17.8 | 28.5 | |||||||||||
| Mikä tahansa CVE, % | 4.34 | 3.31 | 3.90 | 4.80 | 6.77 | 8.35 | |||||||||||
| Kova CVE, % | 3.24 | 2.22 | 2.90 | 3.75 | 4.90 | 5.93 | |||||||||||
| CHD, % | 1.69 | 1.30 | 1.48 | 1.77 | 2.86 | 5.41 | |||||||||||
| Aivohalvaus, % | 2.74 | 2.13 | 2.49 | 3.17 | 4.00 | 3.34 | |||||||||||
CHD, koronaarihalvaustaudit; CVE, kardiovaskulaarinen tapahtuma.
Kummassakin mallissa, ACM:n ja minkä tahansa CVE:n osalta, havaittiin altistumismuuttujan (eGFR; tietoja ei ole esitetty.
EGFR:n ja ACM:n riskin välinen yhteys noudatti U:n muotoista kaavaa molemmissa ikäryhmissä, mutta se oli heikentynyt enemmän vanhemmissa ryhmissä (kuva 1). Sitä vastoin minkä tahansa CVE:n HR:t osoittivat lineaarista jakaumaa, jossa riski kasvoi asteittain korkeammasta eGFR:stä matalampaan; tämä kuvio oli samanlainen molemmissa ikäryhmissä ja myös muiden sydän- ja verisuonitautien päätetapahtumien osalta (lisämateriaalin kuva 2). Kaikkien päätetapahtumien osalta ≥ 75-vuotiaiden HR:t muuttuivat merkitseviksi alle eGFR = 60:n (kuvio 1), eGFR = 55:n ja eGFR = 60:n välillä ACM:n osalta ja eGFR ∼ 50:n kohdalla minkä tahansa CVE:n osalta.
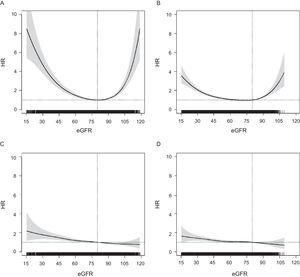

Yhteys eGFR-luokkien ja kokonaiskuolleisuuden ja minkä tahansa sydän- ja verisuonitapahtuman riskin välillä, arvioituna oikaistuilla Coxin suhteellisten vaarojen malleilla, joissa kuolema otetaan huomioon sydän- ja verisuonitapahtumien kanssa kilpailevana tapahtumana (kokonais-P-arvo
Lopullisissa malleissa havaittiin, että mallista saatavat tulokset osoittivat, että ne ovat kalibrointi- ja erottelukyvyn kannalta hyvin erottelukelpoisia (lisäaineiston kuvio 5 ja taulukko ja taulukko lisäkarttana).
JOHTOPÄÄTÖKSET
Populaatiossa, joka koostui ≥ 60-vuotiaista henkilöistä maassa, jossa sydän- ja verisuonitautiriski on pieni, ACM:n ja minkä tahansa CVE:n riski kasvoi asteittain eGFR:n pienentyessä sekä 60-74-vuotiailla että ≥ 75-vuotiailla muista riskitekijöistä ja sydän- ja verisuonitaudeista riippumatta. Vanhemmassa ikäryhmässä HR:t muuttuivat kuitenkin merkitseviksi alemmalla eGFR:llä (alle eGFR = 60), ja ne olivat rajallisesti merkitseviä minkä tahansa CVE:n osalta eGFR = 45-59 -luokassa. EGFR:ään liittyvä kuolleisuusriskin lisäys oli suurempi 60-74-vuotiailla kuin ≥ 75-vuotiailla, mutta oli samanlainen CVE-riskin osalta. Lisäksi eGFR:n ja kuolleisuuden välinen yhteys noudatti U-muotoista mallia, jossa kuolleisuus lisääntyi luokassa 90-119 ja oli suurempi ≥ 75-vuotiailla.
Tässä tutkimuspopulaatiossa ikäluokat määrittelivät kaksi hyvin eriytynyttä ryhmää, joissa niiden henkilöiden määrä, joilla oli eGFR
Odotetusti sydän- ja verisuonitautitulosten ilmaantuvuus oli alhaisempi kuin mitä raportoitiin iäkkäiden henkilöiden kohdalla muissa kuin Välimeren alueen maissa22 , mutta korkeampi kuin nuorempien henkilöiden kohdalla alueemme väestössä.23 Aivoverisuonitapahtumat olivat yleisempiä kuin sepelvaltimotapahtumat, mikä on kuvattu myös iäkkäitä henkilöitä koskevissa tutkimuksissa.22
Yhteensopivasti aiempien raporttien kanssa,1,6,14,22,24 havaitsimme U:n muotoisen suhteen eGFR:n kuin jatkuvan muuttujan ja ACM:n välillä molemmissa ikäryhmissä. Huomionarvoista on, että eGFR = 90-119 -luokassa havaittu ACM:n liiallinen riski oli suurempi iäkkäillä potilailla. Tämä riskin lisääntyminen saattaa heijastaa muiden kuolemaan johtavien sairauksien aiheuttamaa lihasten rappeutumista; tämä on kreatiniiniin perustuvien arviointikaavojen tunnettu rajoitus.19 Sitä vastoin havaitsimme, että uuden CVE:n riski kasvoi suuremmasta eGFR:stä pienempään. Tämä on yhdenmukaista joidenkin aiempien raporttien13,23,25 kanssa, vaikka toiset ovatkin raportoineet vähemmän selvästä U-muotoisesta suhteesta sydän- ja verisuonikuolleisuuden6,12 ja sydän- ja verisuonitautien osalta.15 Näin ollen tapahtuneet CVE:t, joihin kreatiniinipohjaisten arviointikaavojen rajoitukset näyttävät vaikuttavan vähemmän, voivat olla luotettavampi indeksi eGFR:n ennustava vaikutus sydän- ja verisuonitautiriskin kannalta.
Ikäaikaisempien iäkkäiden ihmisten kohtalaisesti heikentyneen iäkkäiden ihmisten eGFR:n kliinisen merkityksen suhteen on ristiriitaista tietoa. Vain harvoissa tutkimuksissa on käytetty nykyisin suositeltua yhtälöä eGFR:ään liittyvän riskin arvioimiseksi ja tulosten vertailemiseksi eri ikäryhmien välillä. Tietojemme mukaan meidän tutkimuksemme on ensimmäinen tutkimus, jossa tämä tehdään iäkkäässä väestössä, joka asuu alueella, jossa CHD:n esiintyvyys on alhainen.
CKD-PC:n meta-analyysissä6 raportoitiin ACM:n osalta merkitsevä mukautettu HR eGFR:n ollessa 9. Samanlaisen löydöksen tekivät 60-69-, 70-79- ja ≥ 80-vuotiaat. Sitä vastoin kahdeksankymppisillä Cardiovascular Health Study -tutkimuksessa12 todettiin merkitsevä HR vain eGFR:n ollessa ≤ 43. Etelä-Euroopassa kuolleisuuden on todettu lisääntyvän yli 65-vuotiailla, joilla on eGFR16 , ja 60-74-vuotiailla, joilla on eGFR15. 35-74-vuotiailla, joilla ei ole sydän- ja verisuonitauteja, eGFR:n todettiin olevan lähes merkitsevä ACM:n ennustaja14 , ja eGFR = 45-59:n kohdalla riski oli merkittävästi suurempi.
Kardiovaskulaarikuolleisuuden osalta 65-74-vuotiaiden ja ≥ 75-vuotiaiden ryhmien HR:t olivat merkitseviä eGFR:n osalta6 , kun taas Cardiovascular Health Study -tutkimuksessa, jossa käytettiin kreatiniiniin perustuvia yhtälöitä, ei havaittu vastaavaa yhteyttä kahdeksankymppisillä.12 PREVEND-tutkimuksessa todettiin yhteyttä eGFR:n kanssa alle 60-vuotiailla, mutta ei ≥ 60-vuotiailla.13 Etelä-Euroopassa on raportoitu lisääntynyt sydän- ja verisuonikuolleisuuden riski eGFR:n ollessa 16 ja sydän- ja verisuonitautien riski (marginaalisesti merkitsevä) eGFR:n ollessa 15 ja eGFR:n ollessa 23
Tutkimuksessamme ACM:n ja minkä tahansa sydän- ja verisuonitautitapauksen HR-arvot kasvoivat tasaisesti eGFR:n pienentyessä alle luokkaan 60-89 sekä 60-74-vuotiaiden ryhmissä että ikäryhmissä iältään 60-74-vuotiailla ja ikäryhmittäin >75-vuotiailla. Kuten aiemmissa raporteissa, HR-arvot ja riskigradientti olivat pienempiä vanhimmassa ryhmässä,6,9 ja jatkuvan eGFR:n analyysissä HR-arvot muuttuivat merkitseviksi eGFR:n ollessa 6
Useimmissa nykyisissä kansainvälisissä ohjeistuksissa otetaan huomioon kaikki henkilöt, joilla on eGFR 18,20,26. Tässä tutkimuksessa 20 %:lla osallistujista, jotka olivat iältään ≥ 75-vuotiaita, oli iältään ≥ 50-vuotiaita, eGFR = 45-59, ja heistä 74 %:lla iältään iältään ≥ 50. Näin ollen kaikkien 45-59-vuotiaiden ikääntyneiden henkilöiden katsominen suuremman riskin omaaviksi altistaisi monet henkilöt, joilla ei ole ”merkittävää lisäriskiä”, aggressiivisemmille tavoitteille ja kardiovaskulaaristen riskitekijöiden hoidolle. Lisäksi KHK-tapahtumien 11 %:n suurentunut suhteellinen riski 60-74-vuotiailla ei ehkä riitä siihen, että eGFR = 45-59 -luokkaa pidettäisiin KHK-riskiä vastaavana riskinä maissa, joissa KHK:n esiintyvyys on vähäistä.
Vahvuudet ja rajoitukset
Tutkimuksemme suurimpana vahvuutena on mukana olleiden yksilöiden hyvin suuri määrä ja se, että ne poimittiin edustavasta väestöpohjaisesta näytteestä, joka kuvastaa perusterveydenhuollossa hoidettavien potilaiden todellista tilannetta. Lähes kaikki > 60-vuotiaat henkilöt (93 %) olivat Katalonian perusterveydenhuollon piirissä, ja suurella osalla heistä oli kreatiniinimittaus, luultavasti siksi, että se on osa ennaltaehkäisevää perusterveydenhuollon terveystarkastusta ja rutiiniseurantaa, joka koskee muita yleisiä kroonisia sairauksia tässä väestössä. Lisäksi kreatiniinin mittausmääritykset kalibroitiin referenssimenetelmään käyttäen suositusten mukaisesti isotooppilaimennusmassaspektrofotometriaa, ja ne suoritettiin keskitetyssä laboratoriossa, mikä vähentää entisestään vaihtelua.
Tämän tutkimuksen tuloksia on tulkittava myös erilaisten rajoitusten valossa. Ensinnäkin eGFR-arvot ja -luokat määritettiin yhden mittauksen perusteella, mikä on tavallista epidemiologisissa ennustetutkimuksissa. Regressiolaimennuksen harhan vuoksi tämä voi aliarvioida todellista yhteyttä eGFR:n ja kiinnostavien lopputulosten välillä. Avohoidon laboratoriotietokannoista saatujen matalien eGFR-mittausten on kuitenkin osoitettu olevan suhteellisen vakaita iäkkäillä henkilöillä.27 Toiseksi emme ottaneet huomioon joidenkin sellaisten tekijöiden vaikutusta, jotka voivat muuttaa munuaistoimintaa, kuten kasvaimet, nefrotoksiset lääkkeet, infektiot tai kliinisesti samanaikaiset tapahtumat. Uskomme, että mukaan otettujen potilaiden suuri määrä minimoi nämä vaikutukset. Kolmanneksi arvioimme eGFR:n seerumin kreatiniinimittausten perusteella käyttäen CKD-EPI-kaavaa, ja hyväksymme kreatiniiniin perustuvien arviointikaavojen rajoitukset, joiden vaikutus on suurempi korkeammalla eGFR:llä.19 Emme korjanneet rotua, vaikka valkoihoinen etnisyys on vallitseva väestössämme, erityisesti tässä ikäryhmässä. Vaikka CKD-EPI:n diagnostisesta ja ennusteellisesta käytöstä iäkkäillä henkilöillä käydään keskustelua ja uusia kaavoja on kehitetty, CKD-EPI on tällä hetkellä suositeltu lähestymistapa20 , ja sitä käytetään laajalti perusterveydenhuollossa. Lisäksi herkkyysanalyysissä, jossa eGFR laskettiin Berlin Initiative Study-1 -yhtälön mukaisesti, saatiin samanlaisia tuloksia. Neljänneksi emme pystyneet arvioimaan virtsan albumiinin vaikutusta, koska näitä tietoja ei ollut saatavilla. Vaikka eGFR:ää ja albumiinia suositellaan molempia CKD:n arvioinnissa, ne ovat osoittaneet itsenäisiä ennustetekijöitä1 , ja tässä esitetyt tulokset lisäävät arvokasta tietoa eGFR:n vaikutuksesta sydän- ja verisuonitautiriskiin ja raja-arvoihin iäkkäillä henkilöillä. Viidenneksi tiedot saatiin sähköisistä terveyskertomuksista, eikä virheellistä havaitsemista voida sulkea pois. Perusterveydenhuollon sydän- ja verisuonitauteja koskevien tietojen on osoitettu olevan laadukkaampia kuin muita sairauksia koskevat tiedot, ja ne soveltuvat epidemiologisiin tutkimuksiin väestössämme.28,29 Kuolemaan johtanutta CVE:tä sairaalan ulkopuolella ei otettu mukaan. Erityisesti olemme saattaneet alihavaita aivohalvaustapahtumia potilailla, joilla oli pitkälle edennyt munuaissairaus ja jotka eivät joutuneet sairaalaan, ja nämä tapahtumat olivat todennäköisesti vakavampia ja niihin liittyi enemmän liitännäissairauksia, jotka johtivat kuolemaan. Aivohalvaustapahtumien malli henkilöillä, joiden eGFR oli 45-80, oli samankaltainen kuin muiden aivoverenkiertohäiriöiden kohdalla; emme usko, että tämä mitätöi tuloksiamme, koska keskityimme lievään CKD:hen. Kuudenneksi mallit oikaistiin sydän- ja verisuonitautien riskitekijöillä ja sairauksilla sekä statiinihoidolla ja reniini-angiotensiinijärjestelmän lääkkeillä, mutta ei muilla liitännäissairauksilla, lääkkeillä tai sosioekonomisilla tekijöillä, jotka voivat vaikuttaa CVE:n esiintyvyyteen. Lisäksi meillä ei ollut käytössämme tietoja kuolemansyystä. Kaikista syistä johtuva kuolleisuus sisältää useita syitä, jotka eivät liity munuaisten toimintaan vaan muihin ikään liittyviin sairauksiin, diabetes mellitukseen tai sydämen vajaatoimintaan, kuten infektioihin tai kaatumisiin. Vaikka mukautimme joitakin näistä liitännäissairauksista, emme voi sulkea pois muita sekoittavia tekijöitä, kuten haurautta.30
yhteenveto
Johtopäätökset
Johtopäätöksenä voidaan todeta, että ≥ 60-vuotiailla henkilöillä, jotka asuvat maassa, jossa CHD:n ilmaantuvuus on alhainen, havaitsimme ACM:n ja minkä tahansa CVE:n riskin kasvavan eGFR:n pienentyessä sekä 60-74-vuotiaiden että ≥ 75-vuotiaiden ryhmissä. HR:t muuttuivat kuitenkin merkittäviksi eGFR:n ollessa
RAHOITUS
Tämä hanke sai tukea Espanjan talous- ja kilpailukykyministeriön Carlos III -terveysinstituutin tutkimusapurahasta, joka myönnettiin terveysstrategian vuoden 2011 ehdotuspyynnön perusteella yhteiskunnallisiin haasteisiin suunnatun kansallisen tutkimusohjelman puitteissa. Ohjelma on osa kansallista teknisen, tieteellisen ja innovaatiotutkimuksen suunnitelmaa 2008-2011, jota yhteisrahoitetaan Euroopan unionin EAKR:n (Euroopan aluekehitysrahasto) varoista (PI11/02220). Talous- ja kilpailukykyministeriö Carlos III -terveysinstituutin kautta (Red RedIAPP RD12/0007) ja EAKR-varat Generalitat de Catalunya AGAURin (A for Management of Universities and Research Grants) kautta (2014 SGR 1225) (2014 SGR 902). M. Grau sai rahoitusta Miguel Servet -apurahasta (Espanjan talous- ja kilpailukykyministeriön Carlos III -terveysinstituutti) (PI12/03287).
Kiinnostusyhteydet
L. Pascual-Benito sai luentopalkkioita Alterilta.
- –
Henkilöillä, joiden eGFR
ml/min/1,73 m2 on suurentunut kardiovaskulaarinen riski. Alentuneen eGFR:n esiintyvyys kasvaa asteittain iän myötä ja on jopa 50 % yli 80-vuotiailla. Iäkkäillä ihmisillä yleisemmin esiintyvien lievempien alenemien (eGFR 45-59 ml/min/1,73 m2) kliinisestä merkityksestä käydään jatkuvasti keskustelua. Lisäksi tutkimuksissa, jotka on tehty alueilla, joilla CHD:n esiintyvyys on alhainen, ei ole ollut mukana yli 74-vuotiaita henkilöitä, tai niissä ei ole annettu yksityiskohtaisia tietoja eri ikäryhmistä.MITÄ TÄMÄ TUTKIMUS LISÄÄ?
- –
Populaatiossa, joka koostui ≥ 60-vuotiaista henkilöistä, jotka asuivat maassa, jossa sydän- ja verisuonitautiriski on pieni, ACM:n ja minkä tahansa CVE:n riski kasvoi asteittain eGFR:n pienentyessä sekä 60-74-vuotiailla että ≥ 75-vuotiailla riippumatta muista riskitekijöistä ja sydän- ja verisuonitaudeista. Vanhemmassa ikäryhmässä HR:t muuttuivat kuitenkin merkitseviksi, kun eGFR oli alle 60. EGFR:n aiheuttama kuolleisuusriskin lisäys oli suurempi 60-74-vuotiaiden ryhmässä kuin ≥ 75-vuotiaiden ryhmässä, mutta oli samankaltainen CVE-riskin osalta.