- ¿Qué hace que una molécula sea polar?
- Echa un vistazo a la fórmula estructural del dióxido de carbono:
- ¿Por qué el agua es polar?
El agua es una molécula polar porque su oxígeno es fuertemente electronegativo y, como tal, atrae el par de electrones hacia sí mismo (lejos de los dos átomos de hidrógeno), adquiriendo así una carga ligeramente negativa.
La polaridad de una molécula no sólo depende de los átomos que la componen, sino también de cómo están dispuestos alrededor del átomo central, es decir, de la disposición espacial de dichos átomos. Para entenderlo mejor, vamos a tratar el tema con más detalle.
¿Qué hace que una molécula sea polar?
La polaridad de una molécula está relacionada con el desplazamiento de los electrones en una dirección determinada. Esto, a su vez, depende de la polaridad de los enlaces presentes en la molécula, ya que estos enlaces también contienen electrones.
Dentro de una molécula, el átomo con mayor poder de atracción de electrones hacia sí mismo (es decir, es más electronegativo que el otro átomo) adquirirá una ligera carga negativa sobre sí mismo, y el enlace entre los dos átomos se volverá polar.
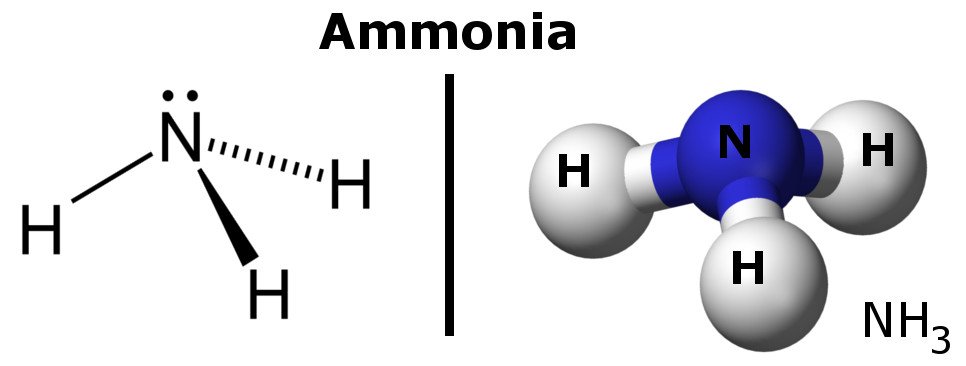
El amoníaco es una molécula polar porque tiene regiones de ligeras cargas negativas y positivas.
En definitiva, se podría decir que la densidad de electrones de un enlace polar se acumula hacia un extremo del enlace, lo que hace que ese extremo posea una ligera carga negativa, mientras que el otro extremo tiene una ligera carga positiva. Esto hace que una molécula sea polar.
De la misma manera, si una molécula no tiene regiones de carga positiva y negativa, se considera no polar.
Sin embargo, algo interesante a tener en cuenta es que cuanto mayor sea la diferencia de electronegatividad, más polar será el enlace dentro de una molécula. Los compuestos de carbonilo son polares porque el carbono del carbonilo es ligeramente positivo. Por lo tanto, ¿no debería ser polar el dióxido de carbono, que contiene un carbono positivo y dos oxígenos parcialmente negativos?
Bueno, el dióxido de carbono consiste en dos átomos de oxígeno unidos a un átomo de carbono. Los átomos de oxígeno son mucho más electronegativos que los átomos de carbono, y como tal, deberían tener una carga parcialmente negativa, mientras que el átomo de carbono debería tener una carga ligeramente positiva. Sin embargo, curiosamente, eso no ocurre.
Eche un vistazo a la fórmula estructural del dióxido de carbono:
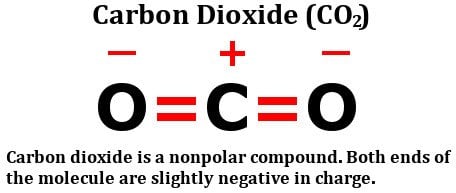
Está formada por dos átomos de oxígeno igualmente electronegativos, sí, pero fíjese en cómo están dispuestos estos átomos alrededor del átomo de carbono. Ambos se encuentran en ángulos perfectos de 180 grados con respecto al carbono. En consecuencia, tiran de la densidad de electrones del carbono con igual fuerza en direcciones opuestas. El resultado neto es que la densidad de electrones en el átomo de carbono no se ve afectada, lo que hace que la molécula de dióxido de carbono sea no polar.
El dióxido de carbono es un gran ejemplo de cómo la geometría de una molécula juega un papel crucial en la determinación de si es polar o no polar. Ahora, veamos una molécula de agua:
¿Por qué el agua es polar?
La fórmula química del agua es H20, lo que significa que contiene dos átomos de hidrógeno y uno de oxígeno. Los átomos de hidrógeno sólo constan de un electrón en su envoltura, mientras que el átomo de oxígeno tiene 6 electrones de valencia.
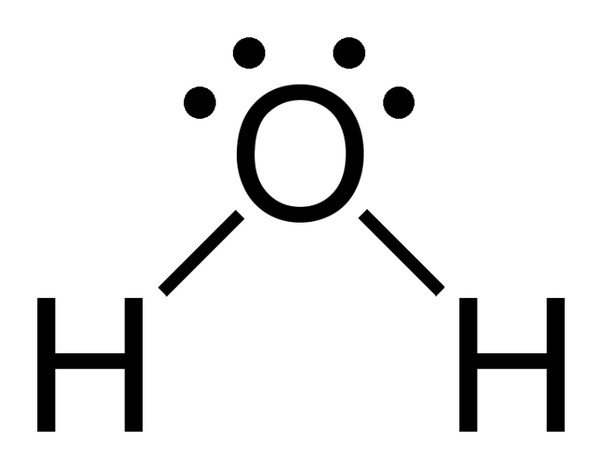
Fíjate en los 2 pares de electrones solitarios del átomo de oxígeno del agua.
Como el oxígeno tiene 6 electrones en su envoltura de valencia, comparte un electrón con cada átomo de hidrógeno. De esta manera, queda con 4 electrones no enlazados en sus 2 orbitales. Estos pares de electrones enlazados y no enlazados se disponen en forma tetraédrica alrededor del oxígeno, por lo que los dos enlaces parecen tener una forma doblada.
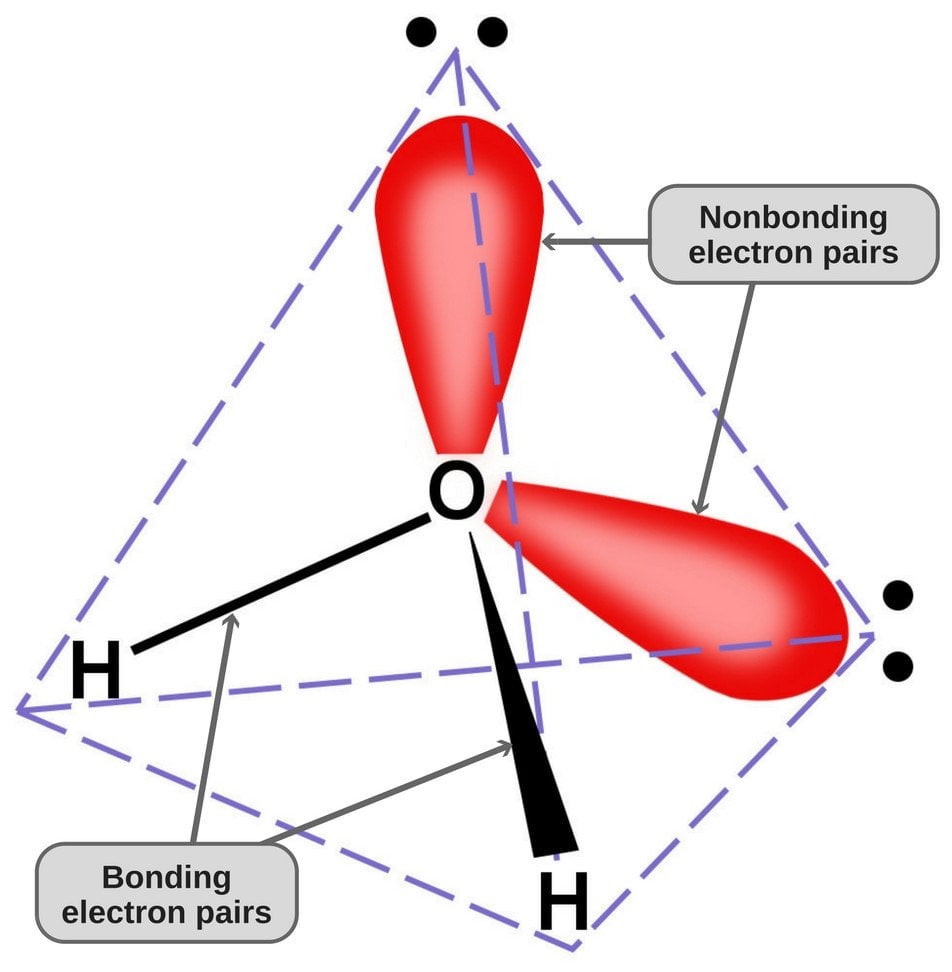
La geometría tetraédrica de la molécula de agua.
Ahora bien, tanto los átomos de oxígeno como los de hidrógeno tienen diferentes electronegatividades (el valor de la electronegatividad del hidrógeno es 2,1, mientras que la del oxígeno es 3,5); por lo tanto, ambos enlaces son polares. Como el oxígeno es más electronegativo que el hidrógeno, la densidad de electrones se desplaza hacia el oxígeno en ambos enlaces, con lo que la región que rodea al oxígeno es más negativa que las áreas que rodean a los dos átomos de hidrógeno.
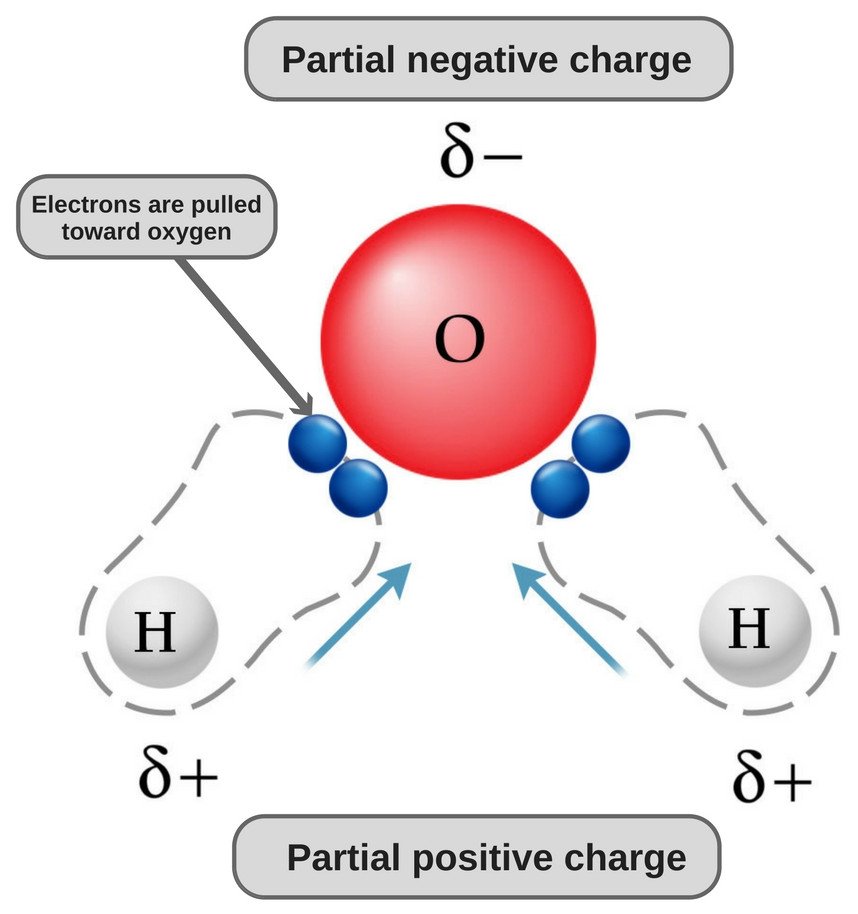
¡Por eso la molécula de agua se vuelve polar!