- Abstract
- Palabras clave
- Introducción
- Métodos tempranos para la producción de pigmentos
- Método del ácido sulfúrico
- Método de cloración
- Separación del hierro
- Proceso de horno eléctrico
- Ruta hidrometalúrgica
- Método de alta presión
- Proceso atmosférico
- Oxihidrólisis
- Oxihidrólisis en lecho fluidizado
- Oxihidrólisis por pulverización
- Producción de titanio
Abstract
La ilmenita de baja calidad puede lixiviarse con HCl concentrado a presión atmosférica y a 80oC. Tras la filtración para separar la materia insoluble, la solución que contiene TiO2+ y Fe2+ se calienta para precipitar el hidróxido de titanio y recuperar el HCl. A continuación, el hidróxido de titanio se calcina para obtener un rutilo sintético que contenga un 95+% de TiO2, mientras que el FeCl2 se somete a oxihidrólisis o a fluidificación para recuperar el HCl y el Fe2O3. El proceso puede aplicarse naturalmente a la ilmenita de alto grado. Evita el proceso de horno eléctrico que sólo se aplica a la ilmenita de alto grado y es superior al proceso de ácido sulfúrico que es altamente contaminante. El producto de este proceso puede utilizarse para preparar el pigmento blanco, así como el metal de titanio.
Palabras clave
Lixiviación de HCl, Proceso Magpei, Rutilo sintético, Oxihidrólisis, Horno eléctrico, Cloración, Proceso de ácido sulfúrico
Introducción
Los principales minerales de titanio son el rutilo, TiO2 y la ilmenita, FeTiO3 (Figura 1 y 2). El rutilo es fácil de procesar para convertirlo en titanio metálico o en pigmento de TiO2 por el método de la cloración, mientras que la ilmenita es más complicada por su alto contenido en hierro. Dado que las reservas mundiales de titanio son en un 90% en forma de ilmenita y sólo en un 10% en forma de rutilo, el tratamiento de la ilmenita es evidentemente una cuestión importante en la metalurgia.

Figura 1: Muestra de museo de rutilo, ~ 90 % TiO2

Figura 2: Muestra de museo de ilmenita, FeTiO3 (59.4 % TiO2)
Los yacimientos de ilmenita pueden ser masivos como en la provincia de Quebec (Figura 3) o como arenas negras (Figura 4) asociadas a magnetita, monacita y otros minerales valiosos que se separan por métodos físicos (Figura 5). En la primera separación magnética se utiliza un imán débil para separar la magnetita mientras que en la segunda se utiliza un imán de alta intensidad para separar la ilmenita.

Figura 3: Una muestra de ilmenita masiva de Quebec

Figura 4: Arenas negras de playa como en la India
Métodos tempranos para la producción de pigmentos
Método del ácido sulfúrico
En 1916, la Titanium Pigment Corporation de Niagara Falls, Nueva York, y la Titan Company de Noruega comenzaron simultáneamente la producción comercial de este nuevo pigmento blanco. Entonces, los principales pigmentos blancos utilizados en las pinturas eran el plomo blanco, el blanco de zinc y la litopona. En este método, la ilmenita se trataba con H2SO4 concentrado a 110-120°C para formar sulfatos ferrosos y de titanilo:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
La reacción se lleva a cabo en grandes tanques de hormigón revestidos con ladrillos resistentes a los ácidos (Figura 6), calentados por inyección directa de vapor a alta presión o en un molino de batea (Figura 7) . La masa solidificada producida en el reactor al final de la reacción se descargaba del reactor por disolución en agua o en ácido diluido. Después de eliminar el residuo insoluble por filtración, la solución que contenía 120-130 g/L de TiO2 y 250-300 g/L de FeSO4 se concentró al vacío a 10°C para cristalizar FeSO4-7H2O, que se centrifugó a continuación. A continuación, el óxido de titanio se precipita de la solución por dilución y siembra, dando lugar a la formación de H2SO4 diluido para su eliminación (Figuras 8 y 9). Sin embargo, el mayor productor de pigmentos de Salvador, Brasil, sigue utilizando esta tecnología porque elimina los productos de desecho en el océano, que son retirados por la marea.

Figura 5: Beneficio de las arenas negras para recuperar sus componentes valiosos

Figura 6: Grandes tanques de hormigón revestidos con ladrillos resistentes al ácido
Figura 7: Molino de bolo calentado

Figura 8: Producción de pigmento de TiO2 mediante el proceso de ácido sulfúrico

Figura 9: Blanco de titanio, ~ 100% TiO2
Método de cloración
DuPont, en Estados Unidos, produce el pigmento desde 1950 por cloración directa del mineral de ilmenita, separación de los productos por destilación fraccionada y, a continuación, oxidación del TiCl4 (Figura 10):

Figura 10: Proceso Du Pont simplificado para la producción de pigmentos a partir de ilmenita
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
El problema de este proceso es la recuperación del cloro del cloruro férrico o la comercialización de las grandes cantidades de este coproducto.
Separación del hierro
Debido a los problemas de contaminación asociados a la eliminación del ácido sulfúrico diluido y del FeSO4, el hierro del mineral se separa en una fase temprana. Esto se consigue de dos maneras: por horno eléctrico y por vías hidrometalúrgicas.
Proceso de horno eléctrico
El método de horno eléctrico se desarrolló en la década de 1950 . El mineral se mezclaba con una cierta cantidad de antracita que era suficiente para reducir el componente de óxido de hierro del mineral, y luego se cargaba en un horno eléctrico a 1 650°C donde el óxido de hierro se reduce a metal mientras que el titanio se separa como escoria (Figura 11). Las reacciones que tienen lugar durante la reducción son las siguientes:

Figura 11: Proceso de horno eléctrico para la separación del hierro
FeTiO3 + C → Fe + CO + TiO2(escoria)
Fe2O3 + 3C → 2Fe + 3CO
Este método lo utiliza el QIT de Río Tinto en su planta de Sorel, cerca de Montreal, y en Richards Bay, en Sudáfrica. También se utiliza en la Unión Soviética en Zaporozhye (Ucrania) y en Japón.
La escoria de titanio es principalmente titanato de hierro y magnesio, (Fe,Mg)Ti4O10, y una pequeña cantidad de silicatos; los análisis típicos son de 72-85% de TiO2 total. Una pequeña cantidad de TiO2 se reduce a Ti2O3. La reducción de los óxidos de hierro no se lleva a término, por lo que queda algo de óxido de hierro en la escoria para disminuir su punto de fusión. El punto de fusión del TiO2 es de 1840°C y el de la ilmenita de 1435°C.
La escoria tiene un alto contenido en titanio y un bajo contenido en hierro (Figura 12) y, por lo tanto, es preferible a la ilmenita para fabricar el pigmento de TiO2 o el metal de titanio. Sin embargo, la escoria producida en Quebec no es apta para la cloración debido a su alto nivel de impurezas, alrededor del 16,6% frente al 6% de otras escorias. Estas impurezas no sólo consumen cantidades innecesarias de cloro, sino que también crean un problema de eliminación. Además, algunas de estas impurezas, por ejemplo calcio y magnesio interferirán con el propio proceso de cloración, que se lleva a cabo a 800°C formando una fase fundida (CaCl2 p.m. 770°C, MgCl2 p.m. 708°C).

Figura 12: Escoria de titanio molida, FeTi4O10 (70-80 % TiO2)
Por estas razones, la escoria de titanio se utilizó únicamente para fabricar pigmentos mediante el proceso de ácido sulfúrico . La escoria se trató de la misma manera que la ilmenita, con la excepción de que no fue necesario separar el sulfato ferroso porque la mayor parte del hierro ya se había separado por reducción en el paso anterior (Figura 13). Sin embargo, el proceso de tratamiento con ácido sulfúrico de la escoria seguía adoleciendo del problema de la eliminación del ácido residual, por lo que se abandonó en la década de 1980 y se sustituyó por una nueva tecnología basada en la mejora de la escoria hasta el 94,5% de TiO2 mediante la lixiviación de la mayoría de las impurezas con HCl a presión para hacerla apta para la cloración.

Figura 13: Lixiviación de la escoria de titanio para la producción de pigmento de TiO2, ya obsoleta
Ruta hidrometalúrgica
La ruta hidrometalúrgica se desarrolló en la década de 1960 y consistía en lixiviar el hierro de la ilmenita y obtener un residuo rico en titanio (90-95% de TiO2) conocido como «rutilo sintético» . En un caso, el proceso Altair, se obtuvo un TiO2 de grado pigmentario. Todos estos procesos utilizan un proceso de oxihidrólisis para tratar el cloruro ferroso y obtener HCl para su reciclaje y Fe2O3 como subproducto.
Método de alta presión
En este método, la ilmenita de alto grado se descompone en autoclaves con un 20% de HCl a 120°C y 200 kPa; el hierro se solubiliza como cloruro ferroso dejando un sólido que contiene aproximadamente un 95% de TiO2 que tiene el análisis químico del rutilo por lo que se llama rutilo sintético (Figura 14):

Figura 14: Rutilo sintético
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
La ilmenita de baja calidad no puede ser tratada por este método ya que todos los silicatos y la materia insoluble contaminarán el producto. El rutilo sintético se trata entonces con cloro para preparar TiCl4, a partir del cual se obtiene TiO2 o titanio metálico sin problemas de contaminación. Este proceso se utiliza en Estados Unidos, Inglaterra, Japón, Taiwán y Australia. La oxihidrólisis podría llevarse a cabo de diversas maneras, como se describe a continuación.
Proceso atmosférico
En 2014 se descubrió por Magpie Incorporation en Canadá que la ilmenita de bajo grado puede disolverse a 80°C con HCl concentrado a presión atmosférica. Tras la filtración para eliminar la materia insoluble, la solución se destila para recuperar el HCl y para hidrolizar el ion titanilo a TiO2. Tras la filtración, el residuo se calcina para producir rutilo sintético (Figura 16):

Figura 15: Producción de rutilo sintético a partir de ilmenita

Figura 16: Producción de 98+% de TiO2 a partir de una ilmenita de baja calidad
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Es evidente que la nueva tecnología de lixiviación a presión ambiente es superior a la antigua mejora de fundición en horno eléctrico-autoclave.
Oxihidrólisis
La solución de cloruro férrico se regenera a HCl y Fe2O3 mediante oxihidrólisis:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Es la misma tecnología que se utiliza para tratar la solución de encurtidos. Se utilizan dos métodos
Oxihidrólisis en lecho fluidizado
En un reactor de lecho fluidizado la solución de cloruro ferroso se introduce en un gran lecho de óxido férrico caliente donde el calentamiento lo proporcionan los gases de combustión calientes de fluidización (Figura 17). A medida que el gas de combustión fluye a través del lecho de óxido bien agitado, alcanza rápidamente el equilibrio térmico con el lecho. La solución se alimenta sobre el lecho de óxidos. La alimentación líquida moja la capa exterior de las partículas de óxido calientes y se evapora rápidamente para formar una capa similar a una cebolla de nuevo óxido sólido sobre el óxido existente, produciendo así partículas densas y homogéneas.

Figura 17: Reactor de lecho fluidizado para la oxihidrólisis de cloruro ferroso
Oxihidrólisis por pulverización
En este tipo de tostador de oxihidrólisis, la solución de cloruro ferroso se pulveriza en un recipiente cilíndrico vacío, mientras que la energía necesaria es suministrada por el flujo ascendente de gases calientes generados en los quemadores inferiores (Figura 18). Los tostadores de pulverización tienen diámetros grandes para mantener bajas las velocidades de los gases. Si la velocidad del gas es alta, se elutrian demasiadas partículas con el gas de salida, y la calidad del producto y la eficiencia del tostador disminuyen. El gas de salida y los óxidos salen del tostador a contracorriente a unos 400°C a 500°C. El tiempo de permanencia de las partículas pulverizadas en la zona de reacción a alta temperatura es muy corto, por lo que deben crearse gotas de líquido muy pequeñas, que puedan calentarse rápidamente, mediante atomización. El rápido calentamiento da lugar a la formación de una costra de óxido sólido en la superficie de cada gota. A medida que el grueso de la gota se calienta, el contenido de agua se vaporiza y atraviesa la capa de óxido. Por lo tanto, el óxido tostado en spray se compone de esferas huecas muy finas y «esponjosas».

Figura 18: Regeneración de HCl a partir de una solución de cloruro ferroso por oxihidrólisis en un tostador por pulverización
Producción de titanio
El titanio metálico se produce por cloración del rutilo, del rutilo sintético o de la escoria de titanio y, a continuación, por reducción en un reactor metalotérmico del TiCl4 por el magnesio al titanio (Figuras 19 y 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
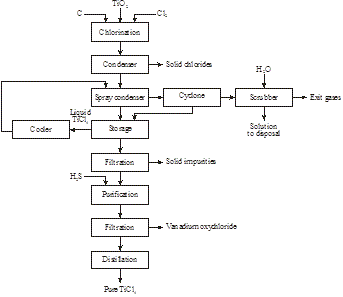
Figura19: Producción de TiCl4 a partir de rutilo, rutilo sintético o escoria de titanio

Figura 20: Producción de titanio a partir de TiCl4
TiCl4 + Mg → Ti + MgCl2
El cloruro de magnesio se electroliza para recuperar el magnesio y el cloro para su reciclaje. La figura 21 muestra el reactor metalotérmico retirado del horno después de la reducción, del que se recupera la esponja de titanio (figura 22).

Figura 21: Reactor metalotérmico retirado del horno

Figura 22: Esponja de titanio (arriba) y MgCl2 (abajo) retirados del reactor
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) «Titanium», pp. 1129-1179 en Handbook of Extractive Metallurgy editado por F. Habashi, publicado por WILEY-VCH, Weinheim, Alemania.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canadá.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reimpreso en Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. The Processing of Titanium Ores for Pigment and Metal Production. Arab Min J 11: 74-84