- Introducción
- Epidemiología
- Manifestaciones clínicas
- Diagnóstico
- Directrices prácticas para el diagnóstico de los síndromes diarreicos por C. difficile
- Diagnóstico endoscópico de la diarrea y colitis por C. difficile
- Tratamiento
- Manejo de la diarrea recurrente por C. difficile
- Colitis grave por C. difficile
- Conclusión
Introducción
La diarrea asociada a Clostridium difficile (DACD) ha sido reconocida con mayor frecuencia como una causa de enfermedad nosocomial. La frecuencia e incidencia de la DAC varía ampliamente y está influida por múltiples factores, como los brotes nosocomiales, los patrones de uso de antimicrobianos y la susceptibilidad individual. No hay informes de estudios prospectivos realizados por hospitales que hagan un seguimiento de la toxina A o A/B positiva y de los resultados de la DAC y sus complicaciones.
Los Centros para el Control y la Prevención de Enfermedades (CDC) han analizado las tendencias seculares en la incidencia de la DAC, y han informado de un aumento constante desde 1987 hasta 2001 (1). En este informe, el 30% de los 440 médicos especialistas en enfermedades infecciosas que participaron en una encuesta a través de Internet informaron de que están observando tasas más elevadas de DAC, DAC más grave y DAC recidivante que en el pasado. Existe la impresión general de que se ha producido un aumento de la proporción de casos con complicaciones graves y mortales, así como un aumento de la tasa de recaídas entre los pacientes afectados.
Además de la morbilidad y la mortalidad, la carga económica de la infección por C. difficile en términos de retrasos en el alta y otros costes hospitalarios es considerable.
Epidemiología
La frecuencia e incidencia de la DAC varía entre hospitales y dentro de una misma institución a lo largo del tiempo. El riesgo de contraer la enfermedad aumenta en pacientes con exposición a antibióticos, cirugía gastrointestinal, aumento de la duración de la estancia en centros sanitarios, enfermedades subyacentes graves, condiciones de inmunocompromiso y edad avanzada.
C. difficile se elimina en las heces. Cualquier superficie, dispositivo o material (p. ej., inodoro, bañera y termómetro rectal electrónico) que se contamine con heces puede servir de reservorio para las esporas de C. difficile. Las esporas se transfieren a los pacientes principalmente a través de las manos del personal sanitario que ha tocado una superficie o un elemento contaminado (2-6).
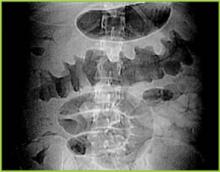
Figura 1 . La radiografía digital de la tomografía computarizada muestra un engrosamiento nodular de la corteza terrestre en el colon transverso.
El organismo y la fisiopatología de la diarrea por C. difficile
C. difficile es un bacilo grampositivo, anaerobio, formador de esporas, responsable del desarrollo de diarrea y colitis asociadas a los antibióticos. C. difficile se describió por primera vez en 1935 como un componente de la flora fecal de los recién nacidos sanos y, en un principio, no se consideró patógeno (7). El bacilo recibió el nombre de difficile porque crece lentamente y es difícil de cultivar. En la actualidad, C. difficile es responsable de casi todas las causas de colitis pseudomembranosa y de hasta el 20% de los casos de diarrea asociada a antibióticos sin colitis. Aunque se encuentra en las heces de sólo el 5% de la población general, hasta el 21% de los adultos se colonizan con este organismo mientras están hospitalizados (2,6).
Una alteración de la microflora colónica normal, generalmente causada por la terapia con antibióticos, es el principal factor que predispone a la infección por C. difficile. Casi todos los antibióticos se han asociado con la diarrea y la colitis por C. difficile. Los antibióticos más frecuentemente asociados son la clindamicina, las cefalosporinas, la ampicilina y la amoxicilina (Tabla 1) (8).
Además de la terapia con antibióticos, la edad avanzada y la gravedad de la enfermedad subyacente son factores de riesgo importantes para la infección por C. difficile. Otros factores de riesgo son la presencia de una sonda nasogástrica, los procedimientos gastrointestinales, la medicación antisecretoria ácida, la estancia en la unidad de cuidados intensivos y la duración de la hospitalización (9).
La diarrea por C. difficile está causada principalmente por la elaboración de toxinas A y B producidas por la multiplicación bacteriana dentro de la luz intestinal. Estas toxinas se unen a la mucosa del colon y ejercen sus efectos nocivos sobre ella. El organismo rara vez daña el colon por invasión directa, y la diarrea es causada por los efectos de las toxinas producidas dentro de la luz intestinal que se adhieren a la superficie de la mucosa. La mayoría de los aislados toxigénicos producen ambas toxinas, y alrededor del 5-25% de los aislados no producen ni la toxina A ni la B, y no causan colitis ni diarrea (3-5).
Manifestaciones clínicas
La infección por C. difficile puede producir una amplia gama de manifestaciones clínicas, incluyendo el transporte asintomático, la diarrea de leve a moderada y la enfermedad fulminante con colitis pseudomembranosa (10). En los pacientes que desarrollan CDAD, los síntomas suelen comenzar poco después de la colonización. La colonización puede ocurrir durante el tratamiento con antibióticos o hasta varias semanas después de un curso de antibióticos. La CDAD se asocia típicamente con el paso de deposiciones frecuentes y blandas, consistentes con la proctocolitis. Puede haber moco o sangre oculta, pero es raro que haya sangre visible.
Diagnóstico
El diagnóstico de la DAC se basa en los antecedentes de tratamiento antibiótico reciente o actual, el desarrollo de diarrea u otros indicios de colitis aguda, y la demostración de infección por C. difficile toxigénico, normalmente mediante la detección de la toxina A o la toxina B en la muestra de heces.
Figura 1 . La radiografía digital de la tomografía computarizada muestra un engrosamiento nodular de la corteza en el colon transverso.
Directrices prácticas para el diagnóstico de los síndromes diarreicos por C. difficile
- El diagnóstico debe sospecharse en cualquier persona con diarrea que haya recibido antibióticos en los dos meses anteriores y/o cuya diarrea comience 72 horas o más después de la hospitalización.
- Cuando se sospecha el diagnóstico, debe enviarse una única muestra de heces al laboratorio para analizar la presencia de C. difficile y/o sus toxinas.
- Cuando la diarrea persiste a pesar de que el resultado de las toxinas en las heces es negativo, pueden enviarse una o dos muestras adicionales para analizarlas con las mismas o diferentes pruebas (4). La endoscopia se reserva para situaciones especiales, como cuando se necesita un diagnóstico rápido y los resultados de la prueba se retrasan o la prueba no es muy sensible, cuando el paciente tiene íleo y no se dispone de heces, o cuando también se consideran otras enfermedades del colon.
Aún no existe una prueba sencilla, económica, rápida, sensible y específica para diagnosticar la diarrea y la colitis por C. difficile, ni todas las pruebas disponibles son adecuadas para su adopción por parte de todos los laboratorios (Tabla 2) (11).
Diagnóstico endoscópico de la diarrea y colitis por C. difficile
La sigmoidoscopia y la colonoscopia no están indicadas para la mayoría de los pacientes con DDC (10,12). Sin embargo, la endoscopia es útil en situaciones especiales, como cuando el diagnóstico es dudoso o la situación clínica exige un diagnóstico rápido. Los resultados del examen endoscópico pueden ser normales en pacientes con diarrea leve o pueden mostrar colitis inespecífica en casos moderados. El hallazgo de pseudomembranas colónicas en un paciente con diarrea asociada a antibióticos es prácticamente patognomónico de colitis por C. difficile. Unos pocos pacientes sin ninguna característica diagnóstica en el rectosigmoide tienen pseudomembranas en las zonas más proximales del colon (13). Otros hallazgos endoscópicos incluyen eritema, edema, friabilidad y colitis inespecífica con pequeñas ulceraciones o erosiones.
Tratamiento
El primer paso en el tratamiento de la diarrea y la colitis por C. difficile es suspender los antibióticos precipitantes si es posible (10,12). La diarrea se resuelve en aproximadamente el 15-25% de los pacientes sin una terapia específica contra C. difficile (14,15). Sin embargo, el tratamiento conservador por sí solo puede no estar indicado en pacientes con enfermedades sistémicas o con múltiples problemas médicos, ya que es difícil predecir qué pacientes mejorarán espontáneamente. Si no es posible suspender el antibiótico precipitante debido a otras infecciones activas, el régimen de antibióticos del paciente debe modificarse, si es posible, para utilizar agentes con menos probabilidades de causar DAC (p. ej, aminoglucósidos, trimetoprima, rifampicina o una quinolona).
Deben evitarse los agentes antiperistálticos, como el difenoxilato más atropina (Lomotil), o la loperamida (Imodium), y los analgésicos narcóticos porque pueden retrasar la eliminación de las toxinas del colon y, por tanto, exacerbar la lesión colónica inducida por la toxina o precipitar el íleo y la dilatación tóxica (12,16). El tratamiento específico para erradicar C. difficile debe utilizarse en pacientes con síntomas inicialmente graves y en pacientes cuyos síntomas persisten a pesar de la interrupción del tratamiento antibiótico. Aunque el diagnóstico de colitis por C. difficile debería establecerse idealmente antes de aplicar la terapia antimicrobiana, las directrices actuales del ACG recomiendan que se inicie una terapia empírica en casos muy sugestivos de pacientes gravemente enfermos (Tabla 3 en la página 54) (12).
Actualmente, la vancomicina o el metronidazol orales, utilizados durante 7 a 10 días, se consideran terapia de primera línea por la mayoría de los autores y las directrices actuales. La mayoría de los autores y las directrices del ACG recomiendan el metronidazol a una dosis de 250 mg 4 veces al día como fármaco de elección para el tratamiento inicial de la colitis por C. difficile (12). Estas recomendaciones se basan en gran medida en la eficacia, el menor coste y la preocupación por el desarrollo de cepas resistentes a la vancomicina. Las principales desventajas del metronidazol incluyen un perfil farmacológico menos deseable y contraindicaciones en niños y mujeres embarazadas.
La vancomicina, por otra parte, a una dosis de 125 mg 4 veces al día, es segura y bien tolerada y alcanza niveles de heces 20 veces superiores a la concentración inhibitoria mínima requerida para el tratamiento de C. difficile. Los inconvenientes del uso de la vancomicina son el coste y el posible desarrollo de cepas resistentes a la vancomicina. Las directrices actuales del ACG consideran que la vancomicina es el fármaco de elección en los pacientes gravemente enfermos y en los casos en los que se excluye el uso de metronidazol.
Se carece de ensayos clínicos controlados para los pacientes con colitis fulminante que pueden no tolerar el tratamiento oral. La administración de metronidazol por vía intravenosa o la administración de vancomicina por sonda nasogástrica o enema rectal se ha descrito en pequeñas series de casos (17-20). No se recomienda la administración intravenosa de vancomicina, ya que el fármaco no se excreta en el colon (17).
Manejo de la diarrea recurrente por C. difficile
A pesar del éxito del tratamiento inicial de la DAC, entre el 15 y el 20% de los pacientes presentan recurrencia de la diarrea en asociación con un análisis de heces positivo para la toxina de C. difficile. La recurrencia sintomática rara vez se debe al fracaso del tratamiento o a la resistencia antimicrobiana al metronidazol o la vancomicina. Los enfoques para el tratamiento incluyen la terapia conservadora (sin embargo, muchos pacientes son ancianos y enfermos y no pueden tolerar la diarrea), la terapia con antibióticos específicos contra C. difficile, el uso de resinas de unión aniónica, la terapia con microorganismos (probióticos) y la terapia con inmunoglobulinas.
La terapia más común para la diarrea recurrente por C. difficile es un segundo curso del mismo antibiótico utilizado para tratar el episodio inicial (12). En un amplio estudio observacional realizado en Estados Unidos, el 92% de los pacientes con diarrea recurrente por C. difficile respondieron con éxito a un único tratamiento repetido, normalmente con metronidazol o vancomicina (14). Hay pruebas que sugieren que los pacientes con antecedentes de recurrencia tienen un alto riesgo de sufrir nuevos episodios de DAC tras la interrupción del tratamiento antibiótico. No hay datos que sugieran que los episodios secuenciales se vuelvan progresivamente más graves o complicados (21). Se han sugerido diversos esquemas de tratamiento para los pacientes con múltiples recurrencias de diarrea por C. difficile. Un enfoque es administrar un ciclo prolongado de vancomicina (o metronidazol) utilizando un esquema de dosis decreciente seguido de una terapia de pulso (Tabla 4).
La colestiramina, una resina de intercambio aniónico administrada en una dosis de 4 gramos 3 o 4 veces al día durante 1 a 2 semanas, se une a las toxinas de C. difficile y puede utilizarse junto con los antibióticos para tratar las recaídas repetidas. Dado que la colestiramina puede unirse a la vancomicina, así como a las toxinas, debe tomarse con al menos 2 ó 3 horas de diferencia con la vancomicina.
Colitis grave por C. difficile
Se ha informado de que la incidencia de colitis fulminante por C. difficile es del 1,6-3,2% (22). Aunque se carece de cifras precisas recientes de otros centros, se está reconociendo como una causa creciente de complicaciones y muerte. El síndrome clínico de la colitis fulminante por C. difficile puede reconocerse con un conocimiento adecuado del espectro de presentación de la enfermedad.
A. Diarrea: Aunque la diarrea es el sello distintivo de la colitis por C. difficile, no está presente de forma invariable, y su ausencia puede llevar a la confusión diagnóstica. Cuando la diarrea está ausente, esto parece ser secundario a la dismotilidad colónica severa. Incluso cuando está presente, la diarrea puede percibirse como un componente menor de un cuadro séptico inespecífico.
 Reimpreso con permiso de BUMC Proceedings 1999; 12:249-250
Reimpreso con permiso de BUMC Proceedings 1999; 12:249-250
Figura 1 . La radiografía digital de la TC muestra un engrosamiento nodular de la corteza en el colon transverso.
 Reimpreso con permiso de BUMC Proceedings 1999; 12:249-250
Reimpreso con permiso de BUMC Proceedings 1999; 12:249-250
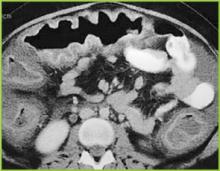
Figura 2 . La imagen de TC del abdomen superior confirma un marcado engrosamiento haustral en el colon transverso.
Figura 3 . La imagen de TC del abdomen medio demuestra un marcado engrosamiento de todo el colon. Hay cambios inflamatorios leves en la grasa pericolónica.
B. Enfermedad grave: La colitis fulminante es una forma inusual de infección por C. difficile, que se presenta sólo en el 3% de los pacientes, pero que representa prácticamente todas las complicaciones graves. Los pacientes con formas más graves de la enfermedad pueden presentarse con o sin diarrea. Cuando los pacientes desarrollan una colitis localizada en el ciego y el lado derecho del colon, la diarrea puede ser mínima o estar ausente. En ausencia de diarrea, las únicas pistas para el diagnóstico pueden ser los signos sistémicos de toxicidad (fiebre, taquicardia, leucocitosis y/o depleción de volumen).
Un recuento elevado de glóbulos blancos puede ser una pista importante de una colitis fulminante por C. difficile inminente. La rápida elevación del recuento periférico de glóbulos blancos (comúnmente de 30.000 a 50.000) con un exceso significativo de bandas y a veces de formas más inmaduras suele preceder a la inestabilidad hemodinámica y al desarrollo de disfunción orgánica. Incluso en pacientes que presentan síntomas leves durante un periodo prolongado, puede producirse una progresión repentina e inesperada hacia el shock. Es difícil predecir qué pacientes pueden no responder al tratamiento médico. Por lo tanto, los signos de advertencia temprana, como una reacción leucémica, pueden ser muy valiosos.
La hipotensión es un hallazgo tardío y puede ser resistente al apoyo vasopresor. Los signos abdominales varían desde la distensión hasta la sensibilidad generalizada con guardia. La perforación del colon suele ir acompañada de rigidez abdominal, vigilancia involuntaria, sensibilidad de rebote y ausencia de ruidos intestinales. En las radiografías abdominales puede aparecer aire libre. Cualquier sospecha de perforación en este contexto debe provocar una consulta quirúrgica inmediata. Por lo general, la muerte se produce antes de que se produzca el aire libre y la perforación. En un estudio, contrario a la mayoría de la literatura, se encontró que la perforación es rara (22).
La radiografía abdominal puede revelar un colon dilatado (>7 cm en su mayor diámetro), consistente con megacolon tóxico. Los pacientes con megacolon pueden tener un íleo del intestino delgado asociado con un intestino delgado dilatado en las radiografías abdominales simples, con niveles de aire-líquido que imitan la obstrucción del intestino delgado o la isquemia. La TC sin contraste y la endoscopia pueden diagnosticar rápidamente o al menos sugerir fuertemente una colitis fulminante por C.difficile. Los hallazgos de la TC incluyen evidencia de ascitis, engrosamiento de la pared del colon y/o dilatación. Estos hallazgos pueden ser útiles para clasificar la gravedad de la colitis.
Una intervención más agresiva en los pacientes que no responden al tratamiento médico, incluida la identificación rápida de los pacientes que no responden al tratamiento médico, es crucial para un resultado positivo, y en este grupo debe realizarse una intervención quirúrgica temprana (Figuras 1-3).
Es importante que todas las personas involucradas en el cuidado de los pacientes en los hospitales, las residencias de ancianos y los centros de enfermería especializada reciban información sobre el organismo y su epidemiología, los enfoques racionales para el tratamiento y el cuidado de los pacientes con diarrea por C. difficile, la importancia de lavarse las manos entre el contacto con los pacientes, el uso de guantes cuando se atienda a un paciente con diarrea por C. difficile y la evitación del uso innecesario de antimicrobianos.
Conclusión
En los últimos años ha surgido la preocupación por el aumento de la incidencia y las tasas de complicaciones graves de la diarrea por C. difficile en los hospitales norteamericanos (22,23). La revista de la Asociación Médica Canadiense publicó un informe en 2004 en el que se detallaba un brote de CDAD que afectaba a varios hospitales de Montreal. Se ha postulado la introducción de nuevas cepas hipervirulentas y altamente transmisibles de C. difficile como posible causa del brote (24). El deterioro de la infraestructura, las prácticas inadecuadas de control de la infección, el creciente número de pacientes debilitados, el envejecimiento de la población y las cepas hipervirulentas se consideraron factores que probablemente contribuyeron a los recientes brotes en Canadá (25).
Dos investigaciones epidemiológicas en Estados Unidos y Canadá (24,26) examinaron de forma independiente muestras de C. difficile y descubrieron que una versión mutada de la cepa «salvaje» era la responsable de los brotes en Quebec y del aumento de las tasas de CDAD en los hospitales de Estados Unidos recientemente (22,23). Los epidemiólogos clínicos de los CDC investigaron los aislamientos de C. difficile procedentes de hospitales de Estados Unidos con brotes recientes (es decir, 2001-2004) de DAC (22,23). El informe indica la aparición de una nueva cepa epidémica, «BI» (distinta de la cepa «J» de 1989-1992), que puede ser responsable del reciente aumento de las tasas y la aparente gravedad de la CDAD (26).
La CDAD y la colitis en la mayoría de los casos pueden tratarse mediante la administración de metronidazol o vancomicina. En algunos pacientes se desarrolla una toxicidad grave que pone en peligro la vida a pesar del tratamiento médico adecuado y oportuno, y es necesaria la intervención quirúrgica. Se ha informado de que los síntomas sistémicos de la infección por C. difficile no se derivan de la bacteriemia, la perforación del colon o la isquemia, sino de los mediadores inflamatorios inducidos por la toxina que se liberan en el colon (27-29). La intervención quirúrgica temprana debe emplearse en los casos refractarios de enfermedad grave. Sin embargo, la intervención quirúrgica dista mucho de ser ideal y conlleva una tasa muy elevada de complicaciones y un riesgo significativo de mortalidad (22). El futuro enfoque clínico para el tratamiento de la colitis nosocomial por C. difficile podría incluir hiperinmunoglobulinas antitoxina específicas e inhibidores de la cascada inflamatoria (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Tendencia secular en la enfermedad de Clostridium difficile adquirida en el hospital en los Estados Unidos; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis. En: Mandell G, Bennet JE, Dolin R, eds. Principios y práctica de las enfermedades infecciosas. 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Patogénesis, epidemiología y tratamiento. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Historia de su papel como patógeno entérico y el estado actual de los conocimientos sobre el organismo. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. En: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Adquisición nosocomial de Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: Con una descripción de un nuevo anaerobio patógeno, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Tratamiento de la diarrea y colitis por Clostridium difficile. En: Wolfe MM, ed. Gastrointestinal Pharmacotherapy. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Factores de riesgo de infección por Clostridium difficile. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. En: Lamont JT, ed. Gastrointestinal Infections: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Ahorro rectal en la colitis pseudomembranosa asociada a antibióticos: Un estudio prospectivo. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Diez años de vigilancia prospectiva de la enfermedad asociada a Clostridium difficile y su tratamiento en el Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamide-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Vancomicina intracolónica adyuvante para la colitis grave por Clostridium difficile: serie de casos y revisión de la literatura. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Metronidazol intravenoso para el tratamiento de la colitis por Clostridium difficile. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Diarrea recurrente por Clostridium difficile: características y factores de riesgo de los pacientes inscritos en un ensayo prospectivo, aleatorizado y doble ciego. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Colitis por Clostridium difficile: ¿una enfermedad iatrogénica cada vez más agresiva? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4: Papel potencial de los factores de virulencia y los rasgos de resistencia antimicrobiana. Sociedad de Enfermedades Infecciosas de América, 42ª Reunión Anual. Boston, MA, 30 de septiembre – 3 de octubre de 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Incremento de las respuestas a la sustancia P en los ganglios de la raíz dorsal, macrófagos intestinales durante la enteritis por toxina A de Clostridium difficile en ratas. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimulates macrophage-inflammatory protein-2 production in rat intestinal epithelial cells. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survival of anti-Clostridium difficile bovine immunoglobulin concentrate in the human gastrointestinal tract. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis. Gut. 1997;41:366-70.