3.1. Caracterización
Difracción de rayos X (DRX)
ϕy asignación de fase para el material denominado CoMoϕy, Figura 1(a), se realizó mediante la comparación entre el difractograma obtenido y el reportado por Pezerat y Levin et al. . El difractograma para CoMoϕy calcinado a 623 K corresponde a la fase β-CoMoO4, que ha sido reportada previamente por Smith también de acuerdo con el patrón de la base de datos Powder Diffraction File (PDF 21-868). Según la literatura, esta fase es estable a altas temperaturas; por lo tanto, no se esperan cambios en la estructura del material a temperaturas superiores a 623 K. El material denominado CoWsϕy aparentemente es una fase semicristalina o una fase en proceso de formación, Figura 1(b). Cuando este material se calcina, se obtiene un tungstato de cobalto de tipo wolframita poco cristalino (PDF 72-0479).
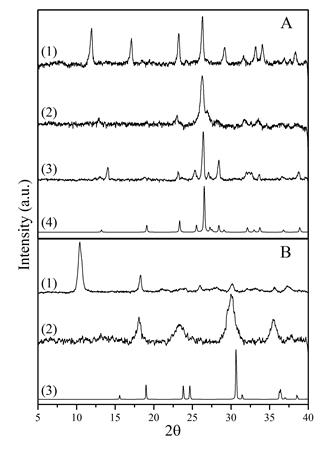
Figura 1 Patrones de DRX para A: (1) CoMoϕy, (2) CoMoϕy calcinado a 623K, (3) CoMoϕy calcinado a 873K, (4) patrón β-CoMoO4. B: (1) CoWsϕy, (2) CoWsϕy calcinado a 673K, (3) patrón de CoWO4
Análisis térmico (AT)
Para CoMoϕy, Figura 2(a), se observa una pérdida de peso del 11.9% se observa entre 373 K y 623 K, que corresponde a dos eventos exotérmicos relacionados con la evolución de especies volátiles del sólido laminar, agua de cristalización y amoníaco, este último presente en la estructura como catión de equilibrio. Por el contrario, con CoWsϕy (Figura 2(b)), se observa un aparente evento único entre 373 K y 673 K, con una pérdida de peso del 5,6%. Sin embargo, se observa un hombro a 570 K, el evento principal a 608 K se asigna a la evolución del agua de cristalización, y el hombro está relacionado con una menor cantidad de catión amonio presente en la estructura de CoWsϕy. Las temperaturas más altas a las que los materiales dejan de presentar eventos térmicos son 623 K para CoMoϕy y 673 K para CoWsϕy. Por esta razón, estas temperaturas se establecieron como temperaturas de calcinación para obtener los catalizadores finales.
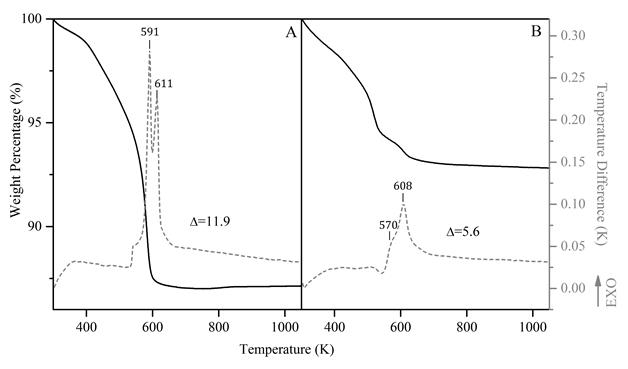
Figura 2 Análisis térmico para (A) CoMoϕy (B) CoWsϕy. Las líneas sólidas representan el análisis termogravimétrico (TGA), las líneas de guiones representan el análisis térmico diferencial (ATD)
Reducción programada por temperatura (TPR)
Los perfiles de TPR para los materiales calcinados se presentan en la Figura 3. Para el CoMoϕy623 se observó consistencia con las temperaturas de reducción reportadas por Brito y Barbosa para el β-CoMoO4. Se estableció que tiene lugar una reducción a estados oxidados de baja valencia, generando mezclas equimolares de especies de Co2Mo3O8 y Co2MoO4, seguida de una reducción a alta temperatura a los metales; estos eventos tienen lugar a 807 K y 1113 K respectivamente. Además, se observa un hombro a 973 K, que puede atribuirse a la reducción de una impureza de fase amorfa obtenida al calcinar el precursor laminar. Esta fase amorfa no se observó por difracción de rayos X.
Para CoWsϕy673 los eventos de reducción se observan a partir de 673 K, con dos picos a 1073 K, y 1123 K. La reducción completa del material se logra a temperaturas cercanas a 1173 K. Este perfil es común para los catalizadores de óxido de tungsteno, que presentan reducción a temperaturas superiores a 1073 K .
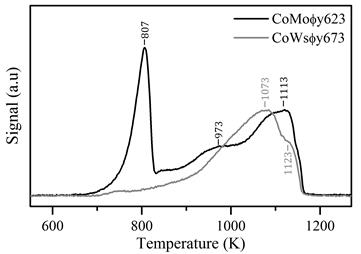
Figura 3 Perfiles de TPR para CoMoϕy623 y CoWsϕy673 por reducción con mezcla de H2/Ar al 10%, desde temperatura ambiente hasta 1273 K a 10 K min-1
Espectroscopia infrarroja por transformada de Fourier (FT-IR)
Se obtuvieron espectros infrarrojos para los precursores y los materiales calcinados (Figura 4). En el caso del CoMoϕy, las bandas de 928 y 620 cm-1 están asociadas a vibraciones de estiramiento O-Mo-O simétricas; las bandas de 865, 806, 751 y 475 cm-1 corresponden a estiramientos O-Mo-O asimétricos. Todas las bandas corresponden a modos de vibración característicos MoO4 2- tetraedros. En el caso del CoMoϕy623, se observan bandas a 943, 841, 784, 704 y 418 cm-1, que corresponden a las bandas de vibración de la estructura β-CoMoO4 . Esto confirma los resultados de la DRX, cf. Figura 1(b).
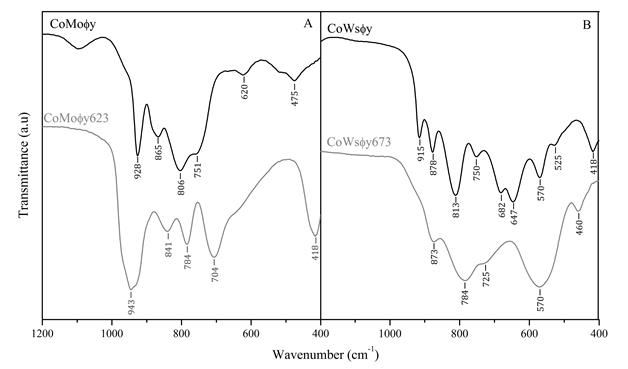
Figura 4 Espectros infrarrojos de los precursores y de los materiales calcinados (A) CoMoϕy y (B) CoWsϕy. Línea negra precursores, línea gris materiales calcinados
En los espectros de CoWsϕy se observan bandas a 915, 813 y 418 cm-1, que coinciden con las bandas de vibración observadas para los óxidos de tipo scheelita, donde el wolframio está en coordinación tetraédrica. Mientras tanto, la banda de 878 cm-1 está relacionada con la vibración simétrica, y las bandas de 750, 682, 647, 570 y 525 cm-1 están relacionadas con las vibraciones asimétricas de los óxidos de tipo wolframita, donde el wolframio tiene coordinación octaédrica . En el caso de CoWsϕy673, hay una buena concordancia con la información reportada para la wolframita , indicando la coordinación octaédrica del cobalto y el tungsteno. La banda a 873 cm-1 está relacionada con el estiramiento simétrico de los 6 octaedros de WO6, mientras que las bandas a 784, 725 y 570 cm-1 están relacionadas con el estiramiento asimétrico del mismo grupo; la banda a 460 cm-1 corresponde a la flexión del mismo. La deformación de los espectros se debe a la baja cristalinidad del sólido observada en el patrón de DRX, Figura 1(b).
Pruebas catalíticas
La Figura 5(a) muestra que el CoMoϕy623 tiene una actividad catalítica medible desde 523 K y el CoWsϕy673 desde 573 K. Las conversiones de propano son relativamente altas (Figura 5(a)), teniendo en cuenta las bajas temperaturas a las que se evaluó la actividad catalítica. El catalizador que presentó el mejor rendimiento, en cuanto a la conversión, fue CoMoϕy623, con un 18,5% de conversión a 623 K, mientras que CoWsϕy673 alcanzó conversiones inferiores al 10% incluso a 673 K. Sin embargo, la selectividad (Figura 5(b)) a 623 K presenta un comportamiento inverso al observado con la conversión. La selectividad a propeno para CoMoϕy623 tiende a ser estable a temperaturas superiores a 573 K, con un valor cercano al 27%.
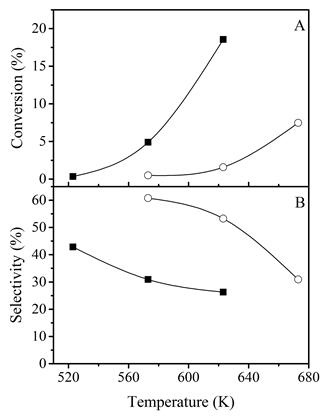
Figura 5 (A) Conversión a propano y (B) selectividad a propeno en función de la temperatura con una velocidad espacial de 50 mLg-1min-1. CoMoϕy623 (-■-), CoWsϕy673 (-(-)
Para explorar el CoMoϕy623 como catalizador, la temperatura de reacción se fijó en 623 K, y la velocidad espacial se probó entre 50 y 150 mL g-1 min-1. Los resultados se muestran en la figura 6. Una velocidad espacial elevada podría evitar una ocupación total de los sitios activos disponibles en el catalizador. Por lo tanto, la conversión podría ser baja. Una menor velocidad espacial implica un mayor tiempo de contacto; esto puede aumentar la conversión y las reacciones secundarias. En el caso del CoMoϕy, el mejor rendimiento a 623 K se obtuvo con una velocidad espacial de 100 mL g-1 min-1. A continuación, se utilizaron temperaturas más altas para aumentar la conversión. Para ello, el material precursor CoMoϕy se calcinó a una temperatura más alta (873 K) y se denominó CoMoϕy873. El patrón de DRX para CoMoϕy873, Figura 1(a), no mostró ningún cambio significativo en la estructura, y también corresponde a β-CoMoO4.
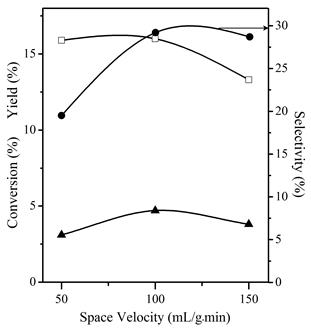
Figura 6 Dependencia de la conversión (-□-), rendimiento a propeno (-(-) y selectividad a propeno (-(-) con la velocidad espacial para CoMoϕy623 a 623 K
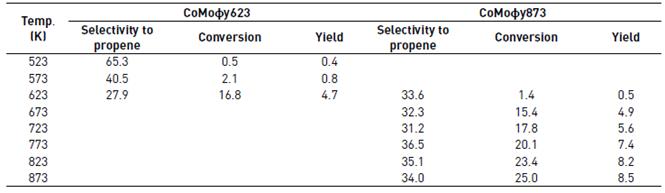
Valores de conversión y selectividad obtenidos con CoMoϕy623 y CoMoϕy873, a 100 mLg-1min-1 de velocidad espacial a diferentes temperaturas, se muestran en la Tabla 2. A la misma temperatura, el CoMoϕy873 proporcionó un menor rendimiento, posiblemente debido a la disminución de la superficie del catalizador producida por la calcinación del precursor a mayor temperatura. A mayores temperaturas, se observa un comportamiento constante para la selectividad de este catalizador en función de la conversión, dentro del error experimental. Por lo tanto, el aumento del rendimiento obtenido con CoMoϕy873 con una mayor temperatura se debe al aumento esperado de la conversión con la temperatura.
Tabla 2 Actividad catalítica del CoMoϕy623 y del CoMoϕy873
Se probó la estabilidad catalítica del CoMoϕy873 a 773 K en reacción continua durante 24 h (véase la Figura 7] y no se observó ninguna pérdida de actividad catalítica. El valor de conversión medio fue del 20,6%.
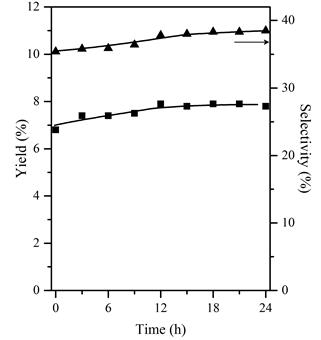
Figura 7 Estabilidad catalítica del CoMoϕy873 a 773 K y una velocidad espacial de 100 mL g-1 min-1 rendimiento (-■-) y selectividad (-▲-) a propeno. El valor medio de conversión fue del 20,6 %
El principal producto de la deshidrogenación oxidativa del propano es el propeno; no obstante, suelen formarse óxidos de carbono (CO y CO2) como subproductos a través de la combustión del propano y del propeno. La reacción de combustión del propano ocurre en paralelo con la ODH; esto explica la incapacidad de alcanzar una selectividad del 100% al propeno . La oxidación consecutiva del propeno en función de la temperatura puede explicarse con respecto a la energía de disociación del enlace (BDE). La BDE para el hidrógeno de metileno es de 98 kcal mol-1 en el propano y de 88 kcal mol-1 en el hidrógeno de metilo en el propeno ; por lo tanto, la transformación del propeno en óxidos de carbono se promueve a temperaturas más altas. Para evitar la oxidación, la desorción del propeno debe ser un paso rápido en la reacción.
La capacidad de los iones metálicos para cambiar entre estados de oxidación, la conductividad electrónica del material, la movilidad del oxígeno de la red, así como, el tipo de oxígeno presente en la superficie son sólo algunos de los factores que pueden afectar a la actividad y selectividad de un catalizador . Aunque, una comparación directa de la actividad catalítica entre el CoMoϕy623 y el CoWsϕy673 no puede hacerse por las diferencias en la composición y la estructura. La reducibilidad puede correlacionarse con la capacidad redox de los materiales, que es necesaria para la actividad catalítica a través de un mecanismo de Mars-vans Krevelen. En nuestro caso, el CoMoϕy623 presenta una menor temperatura de inicio de la reducción, así como, la mayor actividad catalítica en el rango de temperaturas estudiado. Los rendimientos alcanzados con CoMoϕy623 y CoMoϕy873, a diferentes temperaturas, son comparables a los ya reportados en la literatura; el mejor rendimiento para los materiales basados en cobalto es de alrededor del 11% .
Además, la diferencia en el valor de selectividad, Figura 5(b), entre el molibdato de cobalto y el tungstato de cobalto podría atribuirse al cobalto, se encuentra en un estado de espín alto en el tungstato, mientras que está en un estado de espín bajo en el molibdato. Esto es consistente con que el cobalto forma un radical inorgánico (Co-O*) en el tungstato y no en el molibdato, una especie muy activa en el ataque a las parafinas, mejorando la velocidad de abstracción del hidrógeno de metileno.