Imunofluorescence (IF) je běžný morfologický přístup používaný ke stanovení distribuce subcelulárních složek. V testu IF jsou vyžadovány protilátky, které jsou konjugovány s fluorescenčními barvivy. Protilátka specificky rozpoznává antigen vazbou na epitop cíle a fluorofor se detekuje pod fluorescenčním mikroskopem. Proto lze subcelulární složky vizualizovat na tmavém pozadí. IF lze také použít jako alternativní semikvantitativní metodu analýzy ke sledování exprese zájmového objektu.
Existují tři typy IF: přímá IF, nepřímá IF a kombinovaná IF.
Přímá IF používá jednu primární protilátku, která je konjugována s fluorescenčním barvivem.
Přímá IF používá k barvení dvě protilátky: primární protilátku, která se specificky váže na epitop, a odpovídající sekundární protilátku konjugovanou s fluorescenčním barvivem.
Kombinovaná IF je kombinací přímého a nepřímého barvení IF.
Tabulka 1. Srovnání přímé, nepřímé a kombinované IF.
| Typ IF | Přímá | Nepřímá | Kombinace |
|---|---|---|---|
| Schematické schéma | 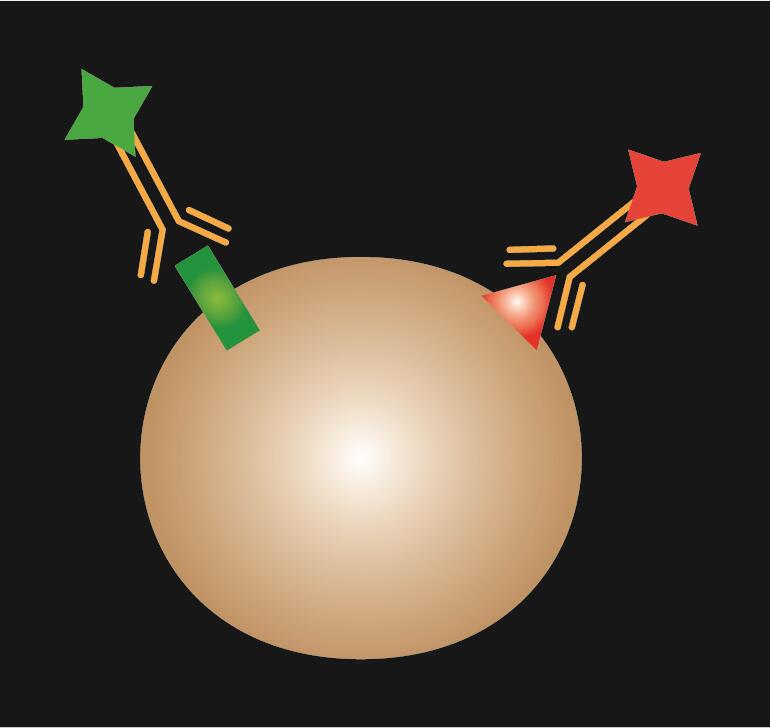 |
. 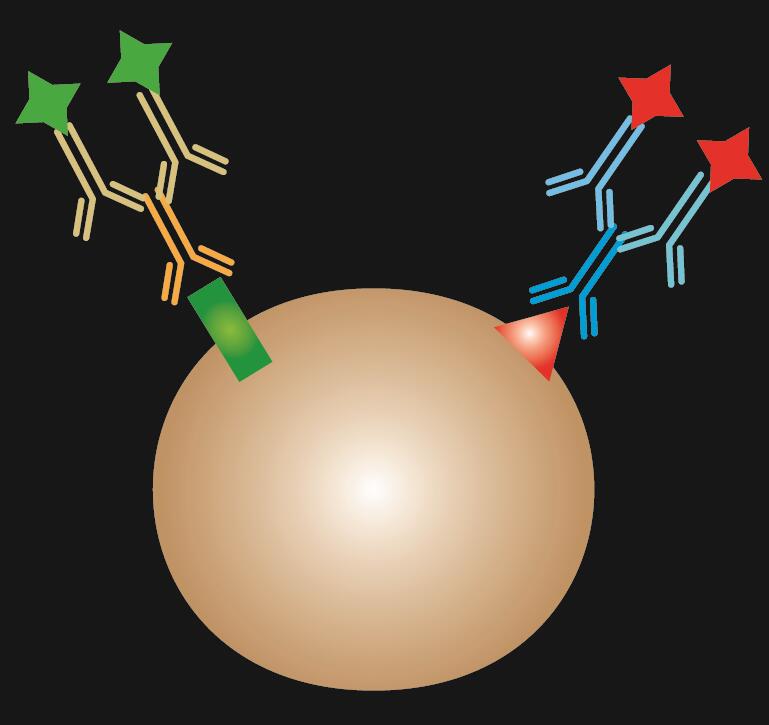 |
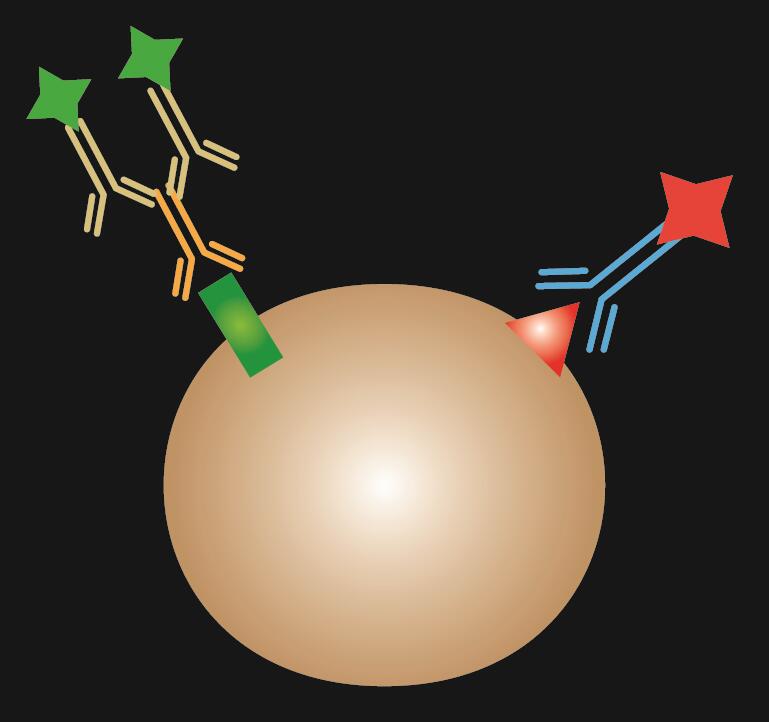 |
| Výhody |
|
|
|
| Nevýhody |
|
|
|
Mezi tři typy IF, je nejoblíbenější nepřímá metoda IF.
Přístup IF lze použít na tkáňových řezech, kultivovaných buněčných liniích a jednotlivých buňkách. Postup IF je podobný imunohistochemii (IHC).
- Odběr a fixace vzorků
Vzorky musí být po odebrání tkáně rychle fixovány a u malých zvířat, jako jsou hlodavci, je lepší provést předběžnou fixaci, ačkoli infuze srdce se 4% formaldehydem nebo paraformaldehydem. Doporučuje se, aby tkáně nebyly silnější než 10 mm a objem fixativa by měl být alespoň 15-20krát větší než objem tkáně. Fixace je velmi důležitá pro zachování morfologie a struktury buněk i integrity antigenu. Proto je třeba fixační roztoky pečlivě vybírat podle různých antigenů a vzorků tkání.
Tabulka 2. Fixační strategie pro dílčí antigeny.
| Antigen | Fixační roztok | Fixační podmínky |
|---|---|---|
| Většina proteinů | 95~100%. alkohol 4% paraformaldehyd |
3~10 min při 37℃ 4~24 hod při 4℃ |
| Enzym | Aceton | 15 min při RT |
| Hormon | 95% alkohol plus 1~5% ledová kyselina octová | 30 min při 4℃ |
| Imunoglobulin | 95% alkohol Uhlíkový tetrachlorid |
10 min při 37 ℃ a poté 15 min při 4 ℃ |
| Vláknitý protein | 95% alkohol plus 1~5% ledová kyselina octová | 10 min při 37 ℃ pak 15 min při 4 ℃ |
| Virus | Aceton Tetrachlorid uhličitý Alkohol |
5~10 min při RT pak 30~60 min při 4℃ |
| Polysacharid a bakterie | Aceton 10% formaldehyd Metanol |
3~10 min při RT pak 30~60 min při 4℃ |
| Lipoid | 10% formaldehyd | 3~10 min při RT |
| Kulturní buňky | Zahřátý 4% paraformaldehyd | 15~20 min. při RT |
- Dehydratace a vložení
Dehydratace je při přípravě tkáňových řezů nutná z následujících důvodů:
1. Parafínový řez: Parafín je nemísitelný s vodou.
2. Zmražený řez: Rozmražené krystalky ledu by zničily morfologii buněk.
Dehydratace se vždy provádí ponořením tkáně do závaží s rostoucím gradientem roztoku ethanolu nebo roztoku sacharózy.
Následně lze vzorky tkání vložit přidáním roztaveného parafínu pro parafínové řezy, zatímco pro zmrazené řezy se přidává sloučenina OCT. Tento krok zajišťuje správnou tvrdost pro vzorky měkkých tkání a umožňuje snadné řezání tkáně.
- Řez a barvení
Vložené tkáně lze řezat na tenké plátky mikrotomem nebo zmrazovacím mikrotomem. O tloušťce řezů je třeba rozhodnout podle průměru buněk a účelu IF testu. Tenčí plátky (≤10 μm) se doporučuje před barvením přímo připevnit na adhezivní sklíčka, protože je lze snadno zastavit při vícenásobném promývání. U silnějších řezů (10 ~ 30 μm) se dosáhne lepšího zobrazení pomocí metody volně plovoucích řezů, protože primární protilátka může proniknout na obě strany řezu. Volně plovoucí řezy se po obarvení upevní na sklíčka. Volně plovoucí řezy malých tkání, jako jsou kořeny dorzálních ganglií (DRG) myší, se obtížně provádějí a vzorek se snadno ztratí. Proto se u některých malých vzorků tkání doporučuje metoda lepených řezů. Pokud se jedná o protilátku konjugovanou s fluorescenčním barvivem, měly by se kroky barvení provádět ve tmě.
Sáhněte po protokolech IF:
- Stick section
- Free floating section
- Cultured cells
- Imaging and analysis
Pozitivní signalizace se virtualizuje pod fluorescenčním mikroskopem na tmavém pozadí. Místo zájmu se obvykle určí souběžným barvením proteinu, jehož umístění bylo známo. Alternativně lze pro kvantitativní analýzu měřit množství pozitivních buněk nebo intenzitu fluorescence pozitivní signalizace. Například silnější intenzita fluorescence odkazuje na relativně vysokou expresi cílového proteinu.
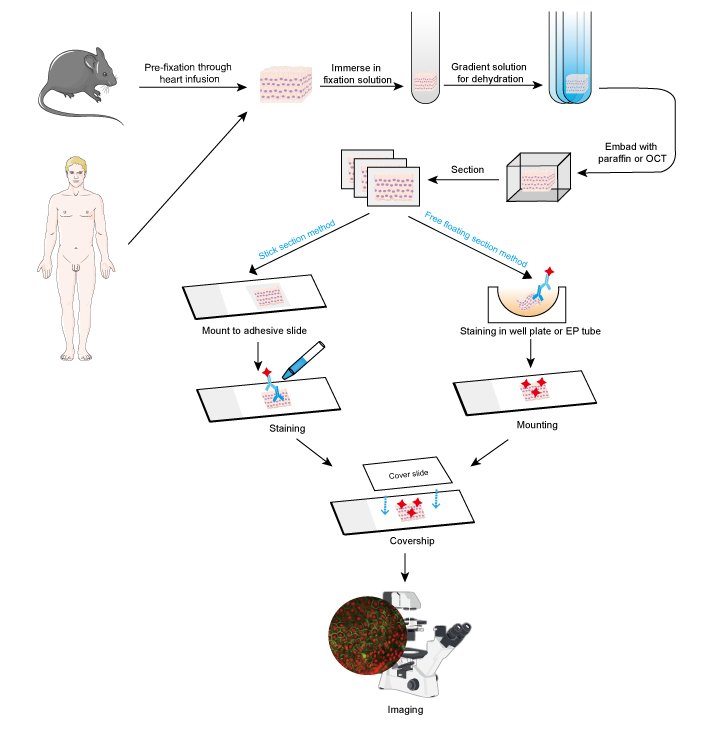
Obrázek 1. Pracovní postup IF na tkáňových řezech.
IF i IHC jsou výkonné přístupy pro morfologickou analýzu s důležitým diagnostickým a prognostickým využitím. Ve svém výzkumu se musí zabývat několika rozdíly:
Tabulka 3. Srovnání IHC a IF
| IHC | IF | |
|---|---|---|
| Metoda značení | Chromogenní | Fluorescenční |
| Krok zpracování | Více jako potřebný substrát | Méně |
| Obrázek |
|
|
| Mikroskop | Světelný mikroskop | Fluorescenční mikroskop |
| Stabilita | Stabilní pro let | Méně stabilní kvůli fotobleachingu |
| Příklad (myší hipokampus) |
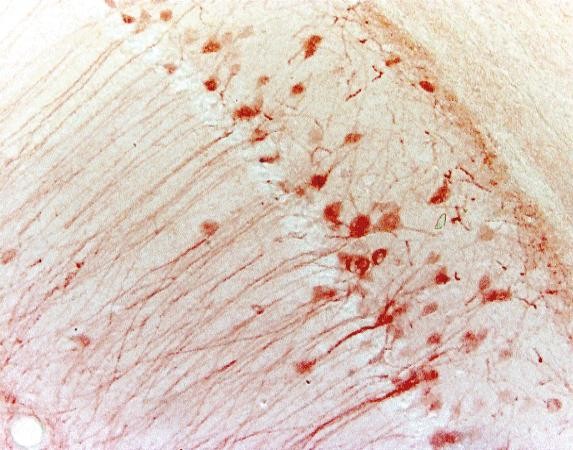 |
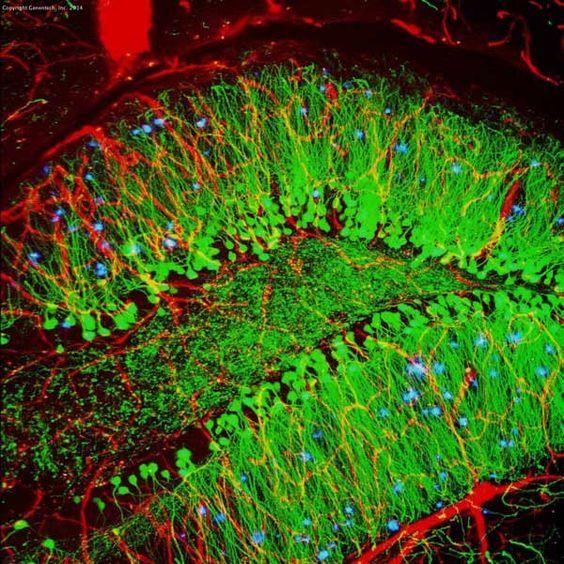 |
.